Жидкий раствор: §19. Жидкие растворы
§19. Жидкие растворы
1. Растворы – это макроскопические однородные смеси двух или большего числа веществ (компонентов), образующих термодинамически равновесные системы. В растворах все компоненты находятся в молекулярно-дисперсном состоянии. Они равномерно распределены в виде отдельных атомов, молекул, ионов или в виде групп из небольшого числа этих частиц. Различают газообразные, жидкие и твердые растворы. В данном параграфе речь пойдет о жидких растворах двухкомпонентного состава.
2. Концентрация растворов. Растворяться в жидкостях могут газы, жидкости и твердые тела. Взаимное растворение жидкостей может быть полным или частичным. Вода и спирт, например, растворяются друг в друге в любом соотношении, а вода и анилин растворяются частично.
Жидкость, взятая в большем количестве, называется растворителем. Другой компонент – растворяемым веществом. Для количественной характеристики соотношения между компонентами растворов используется понятие

а. Весовая концентрация cm есть отношение массы растворенного вещества m1 к массе раствора m1+m2, где m2 – масса растворителя. . (19.1)
Обычно весовую концентрацию выражают в процентах. Например, 5%-й раствор йода, 40%-й раствор спирта, 70%-й раствор уксусной кислоты.
Для приготовления раствора нужной весовой концентрации исходной для расчетов величиной является масса необходимого раствора. Например, для приготовления m = 1 кг 10%-го раствора сахара надо взять m1 = cm1m = 0,11 кг = 0,1 кг сахара и растворить его в
б. Молярная концентрация См выражается числом молей вещества, растворенного в единице объема раствора. . (19.2)
В системе
единиц СИ единица измерения молярной
концентрации Cм моль/м3. Для обычных растворов это очень малая
концентрация. Поэтому в практических
физико-химических исследованиях
применяют более крупную единицу моль
на литр. Очевидно 1 моль/л = 103 моль/м3.
Для обычных растворов это очень малая
концентрация. Поэтому в практических
физико-химических исследованиях
применяют более крупную единицу моль
на литр. Очевидно 1 моль/л = 103 моль/м3.
При одномолярной концентрации в единице объема раствора содержится 1 моль растворенного вещества, содержащий число Авогадро
В общем случае, если известна молярная концентрация раствора См, то известна и концентрация частиц n растворенного вещества, n = СмNА. (19.3)
Поэтому молярная концентрация удобна не только в лабораторной практике, но и в теоретических исследованиях. Для приготовления растворов с известной молярной концентрацией в мерную колбу объемом V помещается вначале известное число v молей растворяемого вещества, а затем заливается растворитель до метки.
в. Молярная
доля c. В случае молярной концентрации Cм неизвестна концентрация в растворе
молекул растворителя. Это приемлемо в
тех случаях, когда растворитель пассивный
и не участвует в физико-химическом
процессе. Если же количество растворителя
должно быть известно, используют молярную
долю c. .
(19.4)
В случае молярной концентрации Cм неизвестна концентрация в растворе
молекул растворителя. Это приемлемо в
тех случаях, когда растворитель пассивный
и не участвует в физико-химическом
процессе. Если же количество растворителя
должно быть известно, используют молярную
долю c. .
(19.4)
Здесь 1 – число молей растворенного вещества,
Молярная доля раствора — это соотношение между числом молекул растворенного вещества и растворителя. Например, в растворе спирта с его молярной долей c1 = 0,2 на 4 молекулы воды приходится одна молекула спирта. .
Переход
от весовой концентрации cm к молярной Cм и молярной
доле c можно выполнить с использованием формул: .
Здесь m1+ m2 = m – масса раствора, 12 – его плотность, M1 и M2 – молярные массы компонент. Очевидно, m1 = cm1m, m2 = cm2m.
3. Растворимость веществ. Раствор, содержащий наибольшее количество вещества, которое может в нем раствориться, называется насыщенным. Если концентрация растворенного вещества меньше, чем в насыщенном растворе, то раствор называется ненасыщенным. Если концентрация больше, раствор называется перенасыщенным
Концентрация
насыщенного раствора есть мера
растворимости, то есть способности
вещества растворяться в растворителе. Растворимость выражают обычно в граммах
вещества, растворяющегося в 100 граммах
растворителя. Например, растворимость
в воде при 20C сахара
составляет 20,4 г, поваренной соли –
36,0 г, соды Na
Растворимость выражают обычно в граммах
вещества, растворяющегося в 100 граммах
растворителя. Например, растворимость
в воде при 20C сахара
составляет 20,4 г, поваренной соли –
36,0 г, соды Na
4. Растворение в жидкостях газов, молекулы которых химически не взаимодействуют между собой и с молекулами растворителя, подчиняется закону Генри: при постоянной температуре растворимость газа пропорциональна парциальному давлению его над раствором (Уильям Генри, 1903 г.). m = kp. (19.7)
Здесь m – масса растворенного газа, p – его парциальное давление над растворителем, k – коэффициент, который зависит от природы газа, растворителя и температуры.
Закон
Генри применим к идеальным плохо
растворимым газам, например, к азоту,
кислороду, водороду, гелию и др. Для
аммиака NH3 и углекислого газа CO2,
хорошо растворяющихся в воде, закон
Генри неприменим.
5. Теплота растворения. Растворение вещества в жидкостях является результатом взаимодействия частиц растворяемого вещества с частицами растворителя. Поскольку растворение – это разделение частиц растворяемого вещества, которые были связаны между собой силами притяжения, то оно требует затраты энергии.
Против сил притяжения должна быть совершена работа, и она совершается силами взаимодействия между частицами растворяемого вещества и растворителя.
Энергию растворения 1 моля вещества в настолько большом количестве растворителя, чтобы частицы растворенного вещества не взаимодействовали между собой, называют молярной теплотой растворения Qp. Эта теплота поглощается из раствора, в результате температура раствора в процессе растворения может понижаться.
Нередко молекулы или ионы растворенного вещества образуют с молекулами растворителя довольно устойчивые комплексы – сольваты (от лат. solvo – растворяю). Так как сольваты обладают меньшей потенциальной энергией по сравнению с молекулами чистого растворителя, то процесс сольватации сопровождается выделением энергии

В результате этих двух процессов растворение вещества может сопровождаться как поглощением энергии, Qp > Qs, температура раствора понижается, так и выделением энергии, Qp < Qs, температура раствора повышается.
В таблице 19 приведены значения суммарной теплоты растворения Q
Таблица 19 | |||||
Вещество | T, K | Q, кДж/моль | Вещество | T, K | Q, кДж/моль |
NaOH, твердый NaCl, твердый Na NaHCO3, твердый KOH, твердый NH4NO3, твердый MgSO47H2O, твердый | 291 291 291 288 291 291 291 | +41,6 -4,9 +23,6 -18,0 +55,6 -26,4 -15,9 | ZnSO4, твердый CuSO4H2O, твердый CuSO45H2O, твердый HCl, газ H2SO4, жидкая HNO3, жидкая CH3COOH, жидкая | 291 291 291 291 291 291 291 | +77,0 +39,0 -11,5 +72,5 +74,7 +31,3 +1,4 |
Существуют такие растворы, в которых Qp = Qs. Тепловой эффект у них отсутствует,
T = 0.
Обычно это близкие по химическим
свойствам вещества. Например CH3OH
и C2H5OH,
бензол и толуол, бензин и керосин. Это
так называемые идеальные растворы.
Тепловой эффект у них отсутствует,
T = 0.
Обычно это близкие по химическим
свойствам вещества. Например CH3OH
и C2H5OH,
бензол и толуол, бензин и керосин. Это
так называемые идеальные растворы.
Растворимость веществ, теплота растворения которых отрицательна Q < 0, с повышением температуры растет. Например, растворимость в воде AgNO3, у которого Q = 22,7 кДж/моль, в интервале температур от 0 до 100C увеличивается с 122 до 952 г.
Относительно
твердых веществ, растворяющихся с
выделением теплоты, обратное утверждение
нельзя сделать однозначно. Дело в том,
что выделение теплоты есть результат
химического взаимодействия молекул
растворителя с молекулами растворяемого
вещества. Во многих случаях с ростом
температуры происходит частичное
разрушение сольватных комплексов.
Поэтому нередко растворимость и этих
веществ с ростом температуры повышается. Например, растворимость соды Na2CO3 (Q = +23,6 кДж/моль)
в интервале температур 0-100C
увеличивается в 8 раз. Но есть и обратные
случаи. Растворимость извести Ca(OH)2 (Q = +11,7 кДж/моль)
падает с 0,185 г до 0,077 г.
Например, растворимость соды Na2CO3 (Q = +23,6 кДж/моль)
в интервале температур 0-100C
увеличивается в 8 раз. Но есть и обратные
случаи. Растворимость извести Ca(OH)2 (Q = +11,7 кДж/моль)
падает с 0,185 г до 0,077 г.
Все газы растворяются с выделением тепла, Q > 0. Растворимость всех газов с ростом температуры уменьшается.
6 . Осмос. (от греч. osmos – толчок, давление) – диффузия растворителя через полупроницаемую мембрану, разделяющую раствор и чистый растворитель.
Пусть
слева от мембраны – чистый растворитель A, а справа – раствор A + B (рис.72). Молекулы A могут свободно
проходить слева направо и справа налево.
Но размер молекул B больше размера
отверстий в мембране, поэтому молекулы B не проходят из раствора в чистый
растворитель. Так как концентрация
молекул растворителя A слева больше,
чем справа, то и поток диффузии молекул A слева больше, чем справа. В результате
уровень раствора справа повышается.
Это продолжается до тех пор, пока потоки
диффузии слева и справа не уравновесятся.
Так как концентрация
молекул растворителя A слева больше,
чем справа, то и поток диффузии молекул A слева больше, чем справа. В результате
уровень раствора справа повышается.
Это продолжается до тех пор, пока потоки
диффузии слева и справа не уравновесятся.
Количественной характеристикой осмоса является осмотическое давление. Величина его равна тому давлению, которое, будучи приложенным к раствору, уравновешивает потоки диффузии молекул растворителя слева и справа. В 1887 г. нидерландский физико-химик Якоб Вант-Гофф открыл закон, определяющий зависимость осмотического давления П от концентрации и температуры раствора. П = vRT V. Вант-Гофф, 1887 (19.8)
Здесь v V – молярная концентрация раствора (v – число молей вещества, растворенного
в объеме V раствора), T – температура, R = 8,31 Дж/(мольK)
– газовая постоянная.
По закону Вант-Гоффа, осмотическое давление, создаваемое растворенным веществом, равно давлению, которое производило бы это вещество, будучи в газообразном состоянии в том же объеме, при той же температуре и в том же структурном составе.
Закон Вант-Гоффа лучше выполняется для растворов малых концентраций, когда отсутствует взаимодействие между молекулами растворенного вещества. Осмотическое давление не зависит от вида полупроницаемой мембраны, от рода растворителя и от особенностей растворенного вещества. Лишь бы его молекулы не проходили сквозь мембрану.
Величина осмотического давления значительна. Например, раствор сахара в воде, молярная концентрация которого Cм = 0,1 моль/л, создает осмотическое давление П = RT V = 0,18,31293/10-3 = 2,43105 Па.
7. Осмос
в электролитах. В растворах кислот,
солей и щелочей осмотическое давление
оказалось больше, чем это следует из
формулы (19. 8). Выходило, что число частиц
в электролитах больше числа молекул
растворенного вещества. Поэтому
Вант-Гофф ввел в свой закон для электролитов
поправочный множитель i (изотонический
коэффициент), который показывает, во
сколько раз наблюдаемое осмотическое
давление больше вычисленного по формуле
(19.8). П = iRTV.
(19.9)
8). Выходило, что число частиц
в электролитах больше числа молекул
растворенного вещества. Поэтому
Вант-Гофф ввел в свой закон для электролитов
поправочный множитель i (изотонический
коэффициент), который показывает, во
сколько раз наблюдаемое осмотическое
давление больше вычисленного по формуле
(19.8). П = iRTV.
(19.9)
Дело в
том, что молекулы солей, кислот и щелочей
в растворах распадаются на ионы, говорят, диссоциируют. Например, NaCl
Na+ + Cl,
HCl H+ + Cl-=,
NaOH Na+ + OH.
Доля молекул, распавшихся на ионы,
называется степенью диссоциации и
обозначается .
Общее увеличение числа частиц растворенного
вещества i = 1+.
Формула закона Вант-Гоффа принимает
вид: П = (1 + )RTV.
(19. 10)
10)
Она применима как к электролитам ( > 0), так и к неэлектролитам ( = 0).
8. Осмос в живой природе играет исключительно важную роль. Осмос лежит в основе корневой системы питания растений. В результате фотосинтеза в них вырабатываются крупные молекулы органических кислот, сахаров и других соединений, которые и создают внутри растений осмотическое давление. Роль полупроницаемой мембраны играет корневая система, которая всасывает воду с мелкими молекулами неорганических веществ. Последние нужны как строительные элементы для синтеза необходимых растению органических веществ. Благодаря осмосу влага в растениях удерживается на высоте в десятки метров.
Питание
представителей царства животных также
происходит благодаря осмосу. Кровь и
лимфа животных – это растворы органических
и неорганических веществ. Если осмотическое
давление в пищеварительном тракте ниже,
чем в крови, влага с питательными
веществами всасывается в кровь. Если
осмотическое давление в крови по каким-то
причинам оказалось ниже, чем в кишечнике
(животное объелось соли), всасывание
меняет направление, организм обезвоживается,
животное погибает.
Если
осмотическое давление в крови по каким-то
причинам оказалось ниже, чем в кишечнике
(животное объелось соли), всасывание
меняет направление, организм обезвоживается,
животное погибает.
9. Поверхностное натяжение растворов зависит от концентрации растворов и от вида растворенного вещества. Наибольшее практическое значение имеют водные растворы.
При растворении в воде неорганических электролитов – кислот, солей и щелочей – поверхностное натяжение раствора увеличивается по линейному закону: = 0+kCм, (19.11)
где 0 – поверхностное натяжение чистой воды, Cм – молярная концентрация раствора, k – коэффициент.
В таблице 20 приведены значения k для некоторых солей при температуре 20C. Численные значения k соответствуют приросту поверхностного натяжения при увеличении концентрации на 1 моль/м3.
Таблица 20 | |
Соль | k, |
KCl NaCl Na2CO3 NaNO3 Na2SO4 | 1,4 1,6 1,3 1,2 1,4 |
Вещества, повышающие поверхностное
натяжение, называются поверхностно-инактивными.
Растворение органических веществ – мыл, спиртов, жирных кислот – обычно понижает поверхностное натяжение. Вещества этой группы называются поверхностно-активными (ПАВ). Молекулы ПАВ построены из двух частей – полярной, гидрофильной группы, имеющей сродство к воде (COOH, OH, NH2, NO2) и неполярного радикала, с которым связана пониженная растворимость ПАВ в воде.
П онижение в растворах ПАВ сопровождается повышением концентрации их молекул в поверхностном слое по сравнению с объемной концентрацией. Это явление называется адсорбцией (от лат. ad – на, sorbeo – поглощаю).
При
малой концентрации адсорбированных
молекул тепловое движение нарушает их
ориентацию, и молекулы в
основном лежат в поверхностном слое
(рис.73-а). С повышением концентрации
взаимодействие углеводородных цепей
между собой усиливается, это способствует
их вертикальной ориентации (рис.73-б).
При насыщении адсорбционного слоя
образуется мономолекулярный слой
ориентированных молекул (рис. 73-в).
73-в).
О бразование адсорбционного слоя полярных молекул позволяет использовать растворы ПАВ в качестве моющих средств. Полярные молекулы обволакивают частицы загрязнений и переносят их в раствор в качестве фрагментов эмульсий.
Адсорбция полярных молекул ПАВ не только понижает поверхностное натяжение жидкости, но и существенно стабилизирует поверхность, позволяя получать устойчивые двусторонние тонкие пленки типа мыльных пузырей. Толщина таких пленок не может быть меньше удвоенного радиуса 2r действия сил межмолекулярного притяжения (рис.74). При толщине пленки меньше 2r отрицательная энергия молекулярного взаимодействия в середине пленки будет убывать по абсолютной величине, разница между энергиями молекул в глубине и в поверхностном слое будет уменьшаться, и система перестанет быть устойчивой.
Реальная минимальная толщина пленок колеблется около 1 мкм, что составляет от нескольких сотен до нескольких тысяч поперечников молекул жидкости.
6.Принцип
Ле-Шателье-Брауна. Для качественной
оценки изменений в равновесной системе,
происходящих при внешнем взаимодействии,
в термодинамике широко применяется принцип подвижного равновесия. Он
гласит: если на систему, находящуюся
в равновесии, направить внешнее
воздействие, нарушающее равновесие, в
ней самопроизвольно происходят изменения
в направлении уменьшения этого
воздействия.
Для качественной
оценки изменений в равновесной системе,
происходящих при внешнем взаимодействии,
в термодинамике широко применяется принцип подвижного равновесия. Он
гласит: если на систему, находящуюся
в равновесии, направить внешнее
воздействие, нарушающее равновесие, в
ней самопроизвольно происходят изменения
в направлении уменьшения этого
воздействия.
Этот принцип открыл в 1884 г. Анри Ле-Шателье, обобщая частные закономерности, а Карл Браун обосновал его на основе 2-го закона термодинамики в 1888 г.
В отличие от 2-го закона термодинамики, также указывающего направление самопроизвольно протекающих процессов и являющегося эффективным методом количественного исследования систем, принцип Ле-Шателье-Брауна носит качественный характер.
Примером
действия принципа Ле-Шателье-Брауна
может служить увеличение растворимости
газов с ростом давления. Когда давление
газа над жидкостью за счет внешнего
воздействия увеличивается, система
переводит часть газа в жидкость, тем
самым ослабляя внешнее воздействие,
растворимость газа растет. Если давление
газа над жидкостью понижать, то система
выделяет обратно часть газа из жидкости,
стремясь к тому, чтобы понижение давления
было как можно меньше. Растворимость
газа уменьшается.
Если давление
газа над жидкостью понижать, то система
выделяет обратно часть газа из жидкости,
стремясь к тому, чтобы понижение давления
было как можно меньше. Растворимость
газа уменьшается.
Принцип Ле-Шателье-Брауна имеет общефизический характер. Примером может служить правило Ленца, определяющее направление индукционного тока.
ЖИДКИЙ РАСТВОР | Deniz Yalıtım
Home ТОВАРЫ Строительная Химия FORCECHEM РЕМОНТНЫЕ РАСТВОРЫ И МАТЕРИАЛЫ ДЛЯ ПОДГОТОВКИ ПОВЕРХНОСТИ ЖИДКИЙ РАСТВОР
ЖИДКИЙ РАСТВОР
ОПИСАНИЕ
Заливной раствор на цементной основе, однокомпонентный, жидкой консистенции, не дает усадки, армированный, с высокой прочностью,.
ОБЛАСТИ ПРИМЕНЕНИЯ
Применяется в стальных конструкциях, сборных конструкциях, при монтаже оборудования, в завесах и колоннах, используется для крепления к основе стальных колонн.
ПРЕИМУЩЕСТВА
Прост в приготовлении и применении. Имеет жидкую текстуру. Обеспечивает надлежащее рабочее время. Не сползает при применении на вертикальных приложениях. Имеет высокие адгезионные свойства. Водо и морозостойкий. Не теряет свои свойства при разнице в температуре.
Имеет жидкую текстуру. Обеспечивает надлежащее рабочее время. Не сползает при применении на вертикальных приложениях. Имеет высокие адгезионные свойства. Водо и морозостойкий. Не теряет свои свойства при разнице в температуре.
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
Необходимо заранее подготовить поверхность, которая должна быть чистой, на ней не должно быть никаких загрязнений, краски, смазки и других веществ. За несколько часов вперед необходимо насыщение водой поверхности, подлежащей ремонту. Во время нанесения на поверхности не должно быть остатков воды. 25 кг жидкого раствора Forcechem® медленно влить в 5.0 – 6.0 литров чистой воды и перемешать с помощью миксера на низкой скорости (400-600 оборотов / мин.) или шпателем до получения однородной массы. Через 5 мин вновь перемешивать в течение 1-2 мин. Приготовленный раствор следует использовать в течение 30 минут. Не применяйте просроченный и покрывшийся коркой раствор. Раствор следует использовать при определенной рабочей температуре, защищать от прямых солнечных лучей, ветра и мороза. Приготовленный раствор следует вылить равномерно на всю область применения. После применения в течении 24 – 48 часов обеспечить защиту от испарения специальными материалами отверждения или мокрыми мешками.
Раствор следует использовать при определенной рабочей температуре, защищать от прямых солнечных лучей, ветра и мороза. Приготовленный раствор следует вылить равномерно на всю область применения. После применения в течении 24 – 48 часов обеспечить защиту от испарения специальными материалами отверждения или мокрыми мешками.
ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
| Внешний вид | Серый цвет |
| Размер частицы | <0.8 мм |
| Пропорции смешивания | 5- 6 л воды /25 кг |
| Количество потребления | 2 кг/м2 на 1 мм толщины |
| Температура применения | От +5 С до +35 С |
| Срок использования | 30 – 40 мин |
| Полный время отверждения | 28 дней |
| Прочность на сжатие | ≥ 55 N/mm2 |
| Токсичность | Не токсичен |
| Прочность адгезии | >2.5 N/ мм2 |
| Прочность на изгиб | > 7. 0 N/ мм2 0 N/ мм2 |
|
Хранение и срок годности | Материал хранить в сухих условиях, в оригинальной неповрежденной и герметичной упаковке, максимум в два слоя, срок годноссти 12 месяцев с даты изготовления при соответствующих условиях хранения. |
Приведенные выше значения действительны при температуре +21 0C и относительной влажности воздуха 50%.
При высоких температурах время укорачивается, при низких температурах время повышается.
Жидкость | Химия, свойства и факты
жидкость
Посмотреть все носители
- Ключевые люди:
- Перси Уильямс Бриджмен Йоханнес Дидерик ван дер Ваальс Исидор Траубе
- Похожие темы:
- жидкокристаллический решение жидкая смесь мутность поглощение
Просмотреть весь связанный контент →
жидкость , в физике одно из трёх основных состояний вещества, промежуточное между газом и кристаллическим твёрдым телом.
Физические свойства жидкостей
Наиболее очевидными физическими свойствами жидкости являются сохранение объема и ее соответствие форме сосуда. Когда жидкое вещество наливается в сосуд, оно принимает форму сосуда, и, пока вещество находится в жидком состоянии, оно будет оставаться внутри сосуда. Кроме того, когда жидкость переливается из одного сосуда в другой, она сохраняет свой объем (пока не происходит испарения или изменения температуры), но не форму. Эти свойства служат удобными критериями для отличия жидкого состояния от твердого и газообразного состояний. Газы, например, расширяются, чтобы заполнить свой сосуд, так что занимаемый ими объем равен объему сосуда. Твердые тела сохраняют свою форму и объем при перемещении из одного контейнера в другой.
Жидкости можно разделить на две основные категории: чистые жидкости и смеси жидкостей. На Земле вода — самая распространенная жидкость, хотя большая часть воды, с которой соприкасаются организмы, находится не в чистом виде, а в смеси, в которой растворены различные вещества. К таким смесям относятся те жидкости, которые необходимы для жизни, например кровь, напитки и морская вода. Морская вода представляет собой жидкую смесь, в которой растворены различные соли. Хотя в чистом виде эти соли представляют собой твердые тела, в океанах они являются частью жидкой фазы. Так, жидкие смеси содержат вещества, которые в чистом виде сами могут быть жидкостями, твердыми телами и даже газами.
К таким смесям относятся те жидкости, которые необходимы для жизни, например кровь, напитки и морская вода. Морская вода представляет собой жидкую смесь, в которой растворены различные соли. Хотя в чистом виде эти соли представляют собой твердые тела, в океанах они являются частью жидкой фазы. Так, жидкие смеси содержат вещества, которые в чистом виде сами могут быть жидкостями, твердыми телами и даже газами.
Жидкое состояние иногда описывают просто как состояние, находящееся между твердым и газообразным состояниями, и для простых молекул это различие однозначно. Однако четкое различие между жидким, газообразным и твердым состояниями имеет место только для тех веществ, молекулы которых состоят из небольшого числа атомов. Когда число превышает примерно 20, жидкость часто может быть охлаждена ниже истинной точки плавления с образованием стекла, которое обладает многими механическими свойствами твердого тела, но не имеет кристаллического порядка. Если число атомов в молекуле превышает примерно 100–200, классификация на твердые, жидкие и газообразные перестает быть полезной. При низких температурах такими веществами обычно являются стекла или аморфные тела, и их жесткость падает с повышением температуры, т. е. они не имеют фиксированных температур плавления; однако некоторые из них могут образовывать настоящие жидкости. Для этих больших молекул газообразное состояние недостижимо, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости. Так ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и каучук).
При низких температурах такими веществами обычно являются стекла или аморфные тела, и их жесткость падает с повышением температуры, т. е. они не имеют фиксированных температур плавления; однако некоторые из них могут образовывать настоящие жидкости. Для этих больших молекул газообразное состояние недостижимо, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости. Так ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и каучук).
Если молекулы большие, жесткие и примерно плоские или линейные, как в ацетате холестерила или p -азоксианизоле, твердое вещество может плавиться в анизотропную жидкость (т. е. такую, которая неоднородна во всех направлениях), в которой молекулы могут свободно перемещаться, но им очень трудно вращаться. Такое состояние называется жидким кристаллом, и анизотропия вызывает изменения показателя преломления (мера изменения направления света при переходе из одной среды в другую) в зависимости от направления падающего света и, следовательно, приводит к необычным оптическим последствия. Жидкие кристаллы нашли широкое применение в устройствах для измерения температуры, дисплеях часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений не образуют жидких кристаллов. Теория нормальных жидкостей есть поэтому преимущественно теория поведения веществ, состоящих из простых молекул.
Жидкие кристаллы нашли широкое применение в устройствах для измерения температуры, дисплеях часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений не образуют жидких кристаллов. Теория нормальных жидкостей есть поэтому преимущественно теория поведения веществ, состоящих из простых молекул.
Жидкость лишена как сильной пространственной упорядоченности твердого тела, хотя имеет высокую плотность твердых тел, так и отсутствия упорядоченности газа, являющегося следствием малой плотности газов, т. е. молекулы газа относительно свободны друг от друга влияние. Сочетание высокой плотности и частичного порядка в жидкостях привело к трудностям в разработке количественно приемлемых теорий жидкостей. Понимание жидкого состояния, как и всех состояний материи, пришло с кинетической молекулярной теорией, утверждавшей, что материя состоит из частиц, находящихся в постоянном движении и что это движение есть проявление тепловой энергии. Чем больше тепловая энергия частицы, тем быстрее она двигалась.
Чем больше тепловая энергия частицы, тем быстрее она двигалась.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Переходы между состояниями материи
В самых общих чертах частицы, из которых состоит материя, включают молекулы, атомы, ионы и электроны. В газе эти частицы находятся достаточно далеко друг от друга и движутся достаточно быстро, чтобы избежать влияния друг друга, которое может быть разного рода, например, притяжения или отталкивания из-за электрических зарядов и специфических сил притяжения, в которых участвуют электроны, вращающиеся вокруг атома. ядра. Движение частиц прямолинейно, и возникающие в результате столкновения происходят без потери энергии, хотя между сталкивающимися частицами может происходить обмен энергиями. Когда газ охлаждается, его частицы движутся медленнее, а те из них, которые достаточно медленны, чтобы задерживаться рядом друг с другом, сливаются, потому что сила притяжения преодолевает их пониженную кинетическую энергию и, по определению, тепловую энергию. Каждая частица, когда она соединяется с другими в жидком состоянии, отдает некоторое количество тепла, называемое скрытой теплотой сжижения, но каждая частица продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, которые частицы могут пройти в жидкости без столкновений, порядка диаметров молекул. По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создает настолько высокую плотность, что жидкость замерзает в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, и их скрытая теплота плавления высвобождается в процессе замерзания. Нагрев твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы они могли избежать влияния друг друга, достаточного для перемещения в жидком состоянии. Дальнейший нагрев обеспечивает жидкие частицы своей теплотой испарения, что позволяет им полностью отделяться друг от друга и переходить в парообразное или газообразное состояние.
Каждая частица, когда она соединяется с другими в жидком состоянии, отдает некоторое количество тепла, называемое скрытой теплотой сжижения, но каждая частица продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, которые частицы могут пройти в жидкости без столкновений, порядка диаметров молекул. По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создает настолько высокую плотность, что жидкость замерзает в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, и их скрытая теплота плавления высвобождается в процессе замерзания. Нагрев твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы они могли избежать влияния друг друга, достаточного для перемещения в жидком состоянии. Дальнейший нагрев обеспечивает жидкие частицы своей теплотой испарения, что позволяет им полностью отделяться друг от друга и переходить в парообразное или газообразное состояние.
Этот резко упрощенный взгляд на состояния материи игнорирует многие усложняющие факторы, самым важным из которых является тот факт, что никакие две частицы не должны двигаться с одинаковой скоростью в газе, жидкости или твердом теле, и связанный с этим факт, что даже в твердом теле некоторые частицы могли приобрести энергию, необходимую для существования в виде частиц газа, в то время как даже в газе некоторые частицы могут быть практически неподвижными в течение короткого времени. Необходимо учитывать среднюю кинетическую энергию частиц, а также тот факт, что движение носит случайный характер. На границе между жидкостью и газом и между жидкостью и твердым телом всегда происходит обмен частицами: медленные молекулы газа конденсируются на поверхности жидкости, а быстрые молекулы жидкости уходят в газ. Равновесие достигается в любой замкнутой системе, так что количество обменов в любом направлении одинаково. Поскольку кинетическая энергия частиц в жидком состоянии может быть определена только в статистических терминах (т. е. можно найти все возможные значения), обсуждение жидкого (а также газообразного) состояния на молекулярном уровне включает формулировки в терминах вероятности функции.
е. можно найти все возможные значения), обсуждение жидкого (а также газообразного) состояния на молекулярном уровне включает формулировки в терминах вероятности функции.
Умягчитель воды | Liquid Solutions Inc
Что такое умягченная и кондиционированная вода?
О
Умягчители воды удаляют кальций и магний из поступающей воды. Это минералы жесткой воды, о которых все говорят.
КАК ЭТО РАБОТАЕТ?
Гигиенический резервуар большого размера заполнен специальным фильтрующим материалом. Когда жесткая вода проходит через резервуар, среда действует как магнит, задерживая минералы жесткости. В конце концов, носитель становится «насыщенным» и нуждается в очистке и «перезарядке». Затем сложный клапан с микропроцессорным управлением автоматически промывает фильтрующий материал раствором соли или калия.
Удаление этих минералов избавляет от образования накипи, преждевременного выхода из строя водяного оборудования и многих других преимуществ.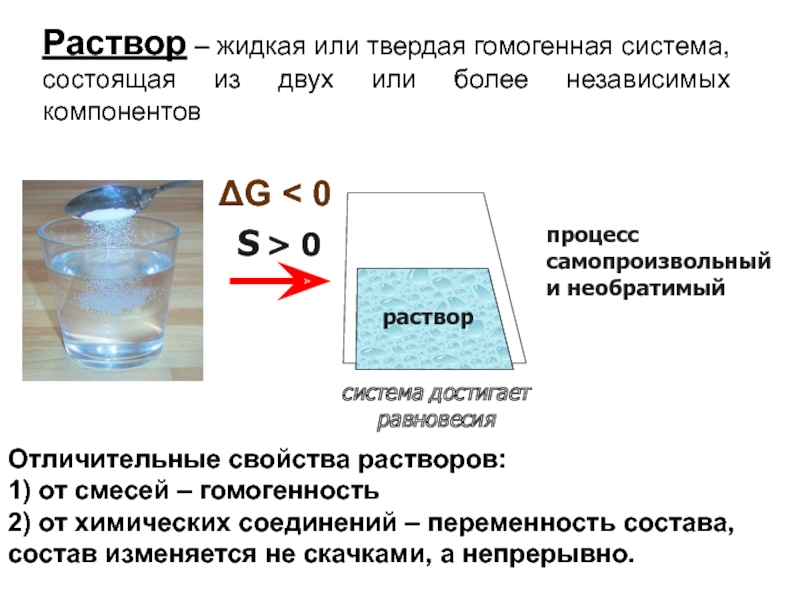 Обработчики воды, иногда называемые кондиционерами, удаляют жесткость, но также обеспечивают уменьшение хлора, мутности, пестицидов и других загрязняющих веществ с помощью среды с активированным углем. Для дополнительной информации о преимуществах мягкой кондиционированной воды посетите нашу страницу часто задаваемых вопросов или позвоните для получения бесплатной консультации.
Обработчики воды, иногда называемые кондиционерами, удаляют жесткость, но также обеспечивают уменьшение хлора, мутности, пестицидов и других загрязняющих веществ с помощью среды с активированным углем. Для дополнительной информации о преимуществах мягкой кондиционированной воды посетите нашу страницу часто задаваемых вопросов или позвоните для получения бесплатной консультации.
Что делать, если я не могу купить умягчитель воды в своем городе или не могу поднять необходимое количество соли для поддержания работы системы?
В подобных случаях будет внедрена система под названием «Зеленая машина». Эта система, как и умягчитель воды, имеет большой санитарный резервуар, заполненный специальным фильтрующим материалом. Эта среда уникальна тем, что содержит большое количество углерода, а также запатентованную систему картриджей Turbo Tech, которая при использовании в сочетании со специальной средой очищает воду от таких загрязнений, как хлор, фтор, мышьяк, бром и многие другие.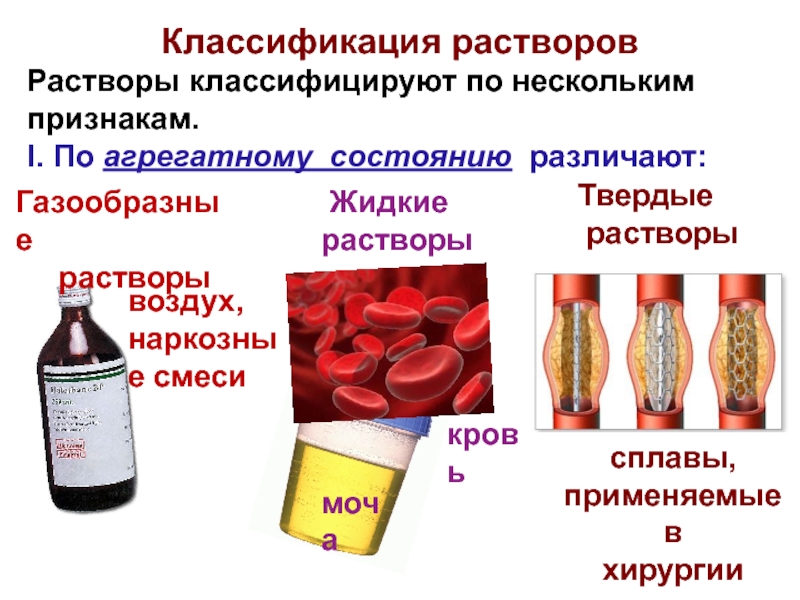 . В дополнение к этому, его специальные среды помогут разрушить молекулы кальция, проходящие через систему, делая их меньше. Из-за этого кальцию гораздо труднее прикрепиться к конструкции трубопровода вашего дома и приборам на водной основе. Важно отметить, что хотя Green Machine и является отличной системой, она не является умягчителем воды и не может обеспечить мягкую воду. Многие компании ложно рекламируют, что можно получить мягкую воду без использования соли или калия. К сожалению, это неправда, и в настоящее время нет способа удалить кальций без соли или калия.
. В дополнение к этому, его специальные среды помогут разрушить молекулы кальция, проходящие через систему, делая их меньше. Из-за этого кальцию гораздо труднее прикрепиться к конструкции трубопровода вашего дома и приборам на водной основе. Важно отметить, что хотя Green Machine и является отличной системой, она не является умягчителем воды и не может обеспечить мягкую воду. Многие компании ложно рекламируют, что можно получить мягкую воду без использования соли или калия. К сожалению, это неправда, и в настоящее время нет способа удалить кальций без соли или калия.
Что такое обратный осмос?
Обратный осмос — это процесс, посредством которого наша кондиционированная вода затем доводится до ультрачистой стадии. Используя самую экономичную, современную обработку, вода прогоняется через 5 различных фильтров, включая полупроницаемую мембрану обратного осмоса. Эти поры в мембране премиум-класса TFC настолько малы, если быть точным, 10 000 микрон, что почти ничего не может пройти через них, кроме молекул воды. В результате получается очищенная вода премиум-класса, которую мы рекомендуем использовать для питья и приготовления пищи. Приготовление кофе, варка лапши, мытье овощей и салата, приготовление лимонада для детей и т. д. Это пищевая вода премиум-класса, которой можно наслаждаться в любое время, до 50 галлонов в день! Загрязняющие вещества, такие как мышьяк, фтор, хлор, бром и многие другие химические вещества, могут присутствовать в водопроводной воде. Мы даем вам полный контроль над вашей водой и тем, чем вы кормите свою семью.
В результате получается очищенная вода премиум-класса, которую мы рекомендуем использовать для питья и приготовления пищи. Приготовление кофе, варка лапши, мытье овощей и салата, приготовление лимонада для детей и т. д. Это пищевая вода премиум-класса, которой можно наслаждаться в любое время, до 50 галлонов в день! Загрязняющие вещества, такие как мышьяк, фтор, хлор, бром и многие другие химические вещества, могут присутствовать в водопроводной воде. Мы даем вам полный контроль над вашей водой и тем, чем вы кормите свою семью.
Правительство штата и федеральное правительство имеют свои стандарты питьевой воды, и мы призываем вас иметь более высокий набор стандартов, чем правительство. Они делают все возможное и по большей части соблюдают правила, насколько это возможно, но ежедневная обработка миллионов галлонов воды просто делает ее очень дорогой для высокой очистки воды.
Свойства
Защита от накипи из жесткой воды, которая может повредить стеклянную посуду, душевые двери, трубопроводы и водные приборы, такие как льдогенераторы, стиральные машины, водонагреватели и посудомоечные машины
До и После
Значительная экономия на мыле и чистящих средствах, которые вы используете дома. Это связано с тем, что для мягкой воды не требуется столько мыла или чистящих средств, чтобы насытить воду и добиться оптимальной эффективности. В результате сотни долларов экономии каждый год.
Это связано с тем, что для мягкой воды не требуется столько мыла или чистящих средств, чтобы насытить воду и добиться оптимальной эффективности. В результате сотни долларов экономии каждый год.
Вода в пластиковых бутылках очень вредна для нашей матушки-земли. Продукт должен быть упакован в пластик, доставлен грузовиками на склады и лежать на полках, пока потребители не заберут его домой. Поток отходов огромен и может быть полностью устранен с помощью домашней очистки обратным осмосом.
Мягкая, шелковистая кожа и волосы, долговечная одежда и менее агрессивное использование химикатов означают лучшую защиту окружающей среды.
Вода, которая ежедневно фильтруется для вас. Удобно расположенный рядом с кухонным краном, готовый к использованию в любых целях, таких как варка макарон, приготовление кофе или даже полив комнатных растений. Больше не нужно таскать воду в бутылках из магазина или 5-галлонные кувшины, оставленные на вашем крыльце.
Получите полный контроль над тем, что находится в вашей воде.
