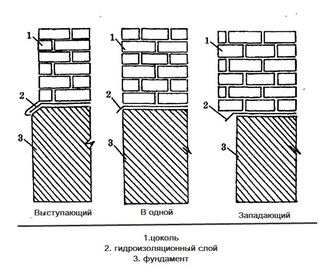
Виды цоколя: Типы, виды и размеры цоколей ламп
как не ошибиться с выбором лампы
При выборе лампочки необходимо обращать внимание на тип ее цоколя, иначе она может попросту не подойти к патрону светильника. Какими бывают цоколи лампочек и как разобраться в существующем многообразии цоколей разного типа.
Существую следующие типы цоколей:
1) Первая буква указывает на тип цоколя:
E – резьбовой цоколь (Эдисона)
G – штырьковый цоколь
R – цоколь с утопленным контактом
B – штифтовой цоколь (Байонет)
F– цоколь с одним штырьком
a – цилиндрический штырёк
b – рифленый штырёк
c – штырёк специальной формы
S – софитный цоколь
K – цоколь с кабельными соединениями
H – цоколь для ксеноновых ламп
P – фокусирующий цоколь
T – телефонный цоколь
W – основание, в котором электрический контакт с патроном осуществляется непосредственно через токовые вводы, расположенные на стеклянном основании лампы.
2) Число в обозначении цоколя указывает диаметр соединительной части или расстояние между штырьками.
3) Строчные буквы на конце показывают количество контактных пластин, штырьков или гибких соединений (только для некоторых типов):
s – один контакт
d – два контакта
t – три контакта
q – четыре контакта
p – пять контактов
4) Иногда к первой букве добавляется еще одна буква, уточняющаяя (для некоторых типов):
U – энергосберегающая лампочка;
A – автомобильная лампа.
Светодиодные лампы имеют стандартные цоколи, которые подходят к большинству применяемых в быту патронов.
Резьбовой цоколь Е (Эдисона):
Цоколь Е10 – это самый маленький из резьбовых цоколей. Каждый из нас в детстве наверняка вворачивал миниатюрные лампочки с этим цоколем в елочные гирлянды. А еще они применяются в карманных фонарях.
Цоколь Е14 – так называемые «миньоны» для миниатюрных классических ламп, чаще всего используемых в небольших светильниках, бра и люстрах. Современные светодиодные лампы также изготавливаются в таком цоколе, ими можно заменить любую стандартную лампу накаливанию, при этом произойдет существенная экономия электроэнергии. Их отличает наибольшее разнообразие типов: грушевидная, свечеобразная, каплевидная, шарообразная, зеркальная и др.
Цоколь Е27 – осветительные приборы с таким цоколем наиболее распространены, они подходят под стандартные патроны, которые установлены в каждом помещении. Светодиодные лампы с таким цоколем максимально напоминают стандартные и привычные нам лампы накаливания, они подойдут к любому светильнику с аналогичным патроном. Можно также приобрести лампы с цоколем Е26, который предназначен для напряжения в 110 В.
Цоколь Е40 – цоколь «голиаф». Используется в основном в уличных светильниках, и для освещения производственных помещений. При замене обычной лампы на светодиодную с аналогичным цоколем, вы сэкономите затраты на электроэнергию в 10 раз, и получите лампу с долгим сроком службы – более 10 лет.
При замене обычной лампы на светодиодную с аналогичным цоколем, вы сэкономите затраты на электроэнергию в 10 раз, и получите лампу с долгим сроком службы – более 10 лет.
Штыковой цоколь G:
Штырьковый цоколь G использовался ранее для установки трубчатых люминесцентных ламп. Здесь для соединения лампы и патрона используется штыревая система. Цифрой обозначается расстояние между контактами. Буквы U X Y Z указывают на модификацию конструкции. Такие цоколя не являются взаимозаменяемыми!
Цоколь G13 – В серии светодиодных ламп созданы трубки Т8 и Т10, которые идеально подходят для установки в патрон G13. На эти лампы легко заменить ранее использовавшиеся люминесцентные лампы. Помимо общего цоколя светодиодные трубки имеют схожий внешний вид с люминесцентными.
Цоколь G53 – Наиболее актуальной заменой галогенных ламп для освещения эксклюзивных бутиков является светодиодная лампа с цоколем G53, она обеспечивает яркий и приятный цвет, показывая товар в самом привлекательном свете.
Цоколь GU10
Цоколь GU5,3 – наиболее часто встречается в галогеновых лампах накаливания MR16. Такой цоколь используется в ювелирных магазинах, для освещение витрин, подсветки для картин, акцентного освещения, в мебельных светильниках, в подвесных и натяжных потолках. Светодиодные лампы с таким цоколем представлены достаточно широкой линейкой, поэтому они смогут полноценно заменить галогенные лампы.
Штифтовой цоколь B:
Этот вид ламповых цоколей появился в процессе эволюции конструкции Эдисона. Он был разработан для того, чтобы ускорить процесс замены лампочек и сделать их более компактными. В его основе — пара симметрично расположенных круглых боковых штифтов, которые вставляются в соответствующие им прорези патрона. Затем цоколь фиксируют, прокручивая на четверть оборота.
Цоколь ВА – разновидность штифтового цоколя лампы накаливания, применяемая в автомобилях. Этот подтип обладает несимметричными боковыми контактами, что позволяет закрепить лампу в патроне определённым образом и сфокусировать световой поток автомобильных фонарей, фар, навигационных судовых огней и т.д.
Помимо основных, существуют достаточно редкой встречающиеся такие типы цоколей, как цоколь с утопленным контактом R. Основные представители ламп с цоколем R7s – кварцевые галогенные лампы. Они используются в осветительных установках высокой интенсивности. Такие лампы маленькие и легкие, их применяют в сетях переменного тока 220 В, 50Гц. Обратите внимание, после обозначения цоколя R7s, указываются цифры: 78 или 118. Они показывают общую длину лампы в мм.
Софитный цоколь S:
Софитный двусторонний цоколь S как правило применяется в светильниках для освещения ванных комнат, подсветке зеркал или сценическом оборудовании.
Фокусирующий цоколь P:
Применяется для прожекторов, фонарей, кинопроекторов, навигационных огней и т.д. Этот цоколь лампы накаливания содержит в себе сборную линзу, которая и направляет поток света в нужную сторону. Цифры обычно обозначают диаметр фокусирующего фланца или части цоколя, на которой горизонтально устанавливается лампа.
Телефонный цоколь Т:
Эти цоколи подходят лампочкам подсветки, пультов, мнемосхем и т.д. Цифры означают измеренную по контактным пластинкам внешнюю ширину.
Цоколь типа W:
В случае такого цоколя контакт с патроном происходит прямо через токовые вводы, которые расположены на стеклянном основании лампы. Цифрами обозначают общую толщину стеклянной части с одним токовым вводом. Далее следует знак умножения и ширина основания цоколя в миллиметрах.
На сегодняшний день существует так же ряд нестандартных цоколей, используемых в некоторых проекционных лампах, цоколь с кабельным соединением (К), а так же специальные цоколи для ксеноновых ламп, обозначаемые буквой Н и цифрами в соответствии с модификацией.
При создании светодиодных ламп были учтены различные варианты цоколей. Светодиодные лампы производятся под самые распространенные различные виды патронов. Поэтому решив заменить любую из ранее используемых вами ламп, вам не составит труда найти аналогичную замену в линейке светодиодных ламп с подходящим для вас цоколем.
E27 | Пожалуй, самый распространенный вид цоколя. Имеется практически в каждом доме и квартире. | |
| E14 | Довольно популярен в открытых бра и светильниках с небольшой глубиной используемого плафона. Лампы с таким цоколем часто называют «свеча» и «шарик» | |
| E40 | Самый большой цоколь, его применяют в уличном и промышленном освещении. Создан для обеспечения работы мощных ламп, имеет большой диаметр цоколя, чтобы поддерживать постоянный контакт. | |
| G13 | Цоколь с расстоянием между штырьками 13 мм. Лампы с таким цоколем выпускаются в виде трубок. Светодиодные лампы с цоколем G13 с лёгкостью заменяют устаревшие люминесцентные лампы в светильниках типа ЛСП, ЛПО, Армстронг, которые, как правило, используются в офисных помещениях. | |
| G9 | Штырьковый цоколь, в виде двух плоских вытянутых петель. Такие патроны имеют широкое распространение в современных люстрах и светильниках | |
| G4 | Имеет тонкие и длинные штырьки, с расстоянием между ними в 4 мм. Такой цоколь позволяет устанавливать и заменять лампы одним движением. Капсульные лампы G4, чаще всего, применяют для декоративного или акцентного освещения | |
| GU10 | На концах контактов этого штырькового цоколя имеются небольшие утолщения. Лампа легко устанавливается и используется в местах, где может быть вибрация Лампа легко устанавливается и используется в местах, где может быть вибрация | |
| GU5.3 | Расстояние между штырьками всего 5.3 мм, чаще всего такой цоколь используют в софитах, применяемые для подсветки и акцентного освещения | |
| GX53 | Такой вид цоколя зачастую используется в светильниках-холдерах со встроенным патроном. Такие светильники удобно встраивать в подвесные и натяжные потолки | |
| GX70 | Этот цоколь разработан для более мощных ламп «таблеток», используемых в качестве основного освещения. |
Виды цоколей ламп освещения, типы и классификация лампочек
Если вы решили приобрести светильник для спальни или любой другой комнаты, то обратите первым делом ваше внимание на то, какой цоколь у лампы. Лампы могут не идти в комплекте с осветительным прибором, по этой причине рекомендуется выяснить вид цоколя, благо сейчас на рынке их огромное количество. Лампочки бывают разной формы, размера, мощности и иметь разные цоколи, с помощью которых они закреплены в патроне осветительного прибора. Также с их помощью в лампу поступает электричество.
Лампочки бывают разной формы, размера, мощности и иметь разные цоколи, с помощью которых они закреплены в патроне осветительного прибора. Также с их помощью в лампу поступает электричество.
Цоколи изготавливают из металла или керамики. Во внутренней их области имеется контакт, через который подается ток на рабочую область. У любого осветительного прибора есть один либо несколько таких патронов для крепления ламп. При покупке лампы обращайте внимание на то, чтобы цоколь совпадал с размером патрона.
Все лампы со временем нуждаются в замене, так как их срок эксплуатации не вечен. Для оптимального выбора рекомендуется заранее ознакомиться с основными видами ламп и тем, какой цоколь у обычной лампочки.
Виды цоколей для разных лампРазновидности цоколей для ламп
Различают несколько видов цоколей ламп, получивших широкое применение в самых разных сферах. Из-за этого их принято классифицировать; согласно этой классификации все разновидности бывают определенной категории. Кроме того, обычно мы в большинстве случаев имеем дело со следующими двумя цоколями лампочек: резьбовым и штырьковым.
Из-за этого их принято классифицировать; согласно этой классификации все разновидности бывают определенной категории. Кроме того, обычно мы в большинстве случаев имеем дело со следующими двумя цоколями лампочек: резьбовым и штырьковым.
Традиционно подразумевается, что резьбовой цоколь – это и есть винтовой. Его принято маркировать буквой Е. Цоколь E27 получил широкое применение в большинстве типов ламп, среди которых и бытовые. После буквы непременно отмечается число – это диаметр резьбового соединения. В бытовой лампочке применяется 2 размера – E27 и E14.
У обычной лампы накаливания резьбовой тип цоколей E27 или, как еще его принято называть, миньон. У многих новейших осветительных приборов такая конструкция. Она самая удобная для использования, и пользуется спросом у широких масс населения. Габариты резьбового соединения для ламп не менялись в течение нескольких десятков лет, по этой причине даже новые светодиодные лампочки, приобретенные сегодня, можно вкрутить в старую люстру. Кроме того, лампа с цоколем типа E отличается своими размерами – она имеет малый вес.
Кроме того, лампа с цоколем типа E отличается своими размерами – она имеет малый вес.
В Америке стандартные размеры цоколей совсем иные, чем в Европе. Это связано с тем, что там в сети напряжение составляет 110 В. Чтобы нечаянно не вкрутить европейскую лампочку, нужно помнить, что диаметр у них другой: Е12, Е17, Е26 и Е39.
Классификация цоколейЭта разновидность тоже получила широкое применение в различных областях. Этот цоколь состоит из 2 металлических штырьков, играющих в то же время роль электрического контакта. Эти штыри обеспечивают удержание прибора в патроне, потому что их вставляют в патрон очень плотно. Размеры штырей бывают разного диаметра. Цоколь маркируется буквой G, обозначающей, что это штырьковый тип, а число после нее указывает на расстояние между штырьками. К примеру, цоколь G4, цоколь G9, цоколь G5 либо G13. Последний, G13, получил сегодня широкое распространение в лампах-трубках. Они имеются в каждом подъезде.
Такой тип цоколей можно встретить у разных ламп: накаливания, люминесцентных, галогенных. Цоколь G очень распространен в светодиодном освещении. Кроме того, лампы с таким цоколем вы можете приобрести и для обычной старой люстры.
Цоколь G очень распространен в светодиодном освещении. Кроме того, лампы с таким цоколем вы можете приобрести и для обычной старой люстры.
Кроме обыкновенных, указанных ранее, существуют также виды лампочек и типы цоколей, которые не так востребованы, однако успешно используются в разнообразных осветительных приборах:
- Тип с утопленным контактом (R). Он получил широкое применение главным образом в технике, которая работает с высокой интенсивностью с питанием от переменного тока.
- Штифтовой вариант (В) позволяет очень легко сменить лампочку в патроне благодаря тому, что у него несимметричные контакты по бокам. Практически это усовершенствованный вид резьбовой разновидности.
- Одноштырьковый (F), который в свою очередь бывает цилиндрическим, с рифленой областью и особенной формой.
- Софитный (S) используется в осветительных приборах гостиниц и транспортных средств. Отличается симметричным расположением контактов.
- Фиксирующий (P) используется в специальных мощных прожекторах и фонарях.

- Телефонный (Т) оснащен маленькой лампочкой для разнообразных пультов, какой-либо подсветки.
В большинстве случаев на цоколе имеется, кроме основной маркировки, еще одна буква. Она обозначает подвид этого светильника:
- V – вариант с коническим концом.
- U – цоколь люминесцентных ламп.
- A – лампочка для машин.
Классификация лампочек
Далее рассмотрим наиболее популярные в быту осветительные приборы, среди которых стоит отметить лампу накаливания, галогенную, энергосберегающую, люминесцентную и светодиодную лампу.
- Лампа накаливания.
Лампа накаливания является самым массовым из всех типов ламп и, вероятнее всего, вы с ней знакомы. Она так востребована из-за низкой себестоимости и несложной конструкции. Применяется в простейших видах осветительных приборов. Но у ламп накаливания есть огромный недостаток – такой светильник сильно уступает по техническим свойствам своим собратьям. Длительность ее эксплуатации равна 1 000 часов, хоть это не такой уж серьезный, но все же минус. Многие модели ламп накаливания выпускают с цоколями Е14 и Е27.
Длительность ее эксплуатации равна 1 000 часов, хоть это не такой уж серьезный, но все же минус. Многие модели ламп накаливания выпускают с цоколями Е14 и Е27.
Существуют и рефлекторные виды светильников накаливания. Они отличаются посеребренной поверхностью. Это дает возможность направлять свет в какой-то конкретный участок, по этой причине такие осветительные приборы применяются для получения направленной освещенности помещения. Сегодня вы можете приобрести рефлекторные приборы для освещения R50, R63 и R80, где цифра является диаметром прибора. У них типы патронов другие, а цоколь E14 либо Е27.
- Галогенные лампы.
Отличаются длительным сроком эксплуатации – 4 000 часов. Имеют высокий индекс цветопередачи, который составляет 100%. У них размеры меньше, чему у обыкновенной лампы, форма тоже бывает разная, соответственно, и область применения значительно шире. Цоколь для галогенных ламп – G9, G4, R7s, GU10.
- Энергосберегающие лампы.
Такие осветительные приборы получили достаточно широкое распространение на сегодняшний день. Они пользуются огромным спросом среди потребителей. Такими типами лампочек пользуются так часто из-за того, что они могут снизить расходы на электричество. Реализуются они везде, а смонтировать их не составляет особого труда.
Они пользуются огромным спросом среди потребителей. Такими типами лампочек пользуются так часто из-за того, что они могут снизить расходы на электричество. Реализуются они везде, а смонтировать их не составляет особого труда.
Новейшие технологии в производстве позволили создать энергосберегающие лампы компактного размера, разнообразной мощности, различных форм, а также с продолжительным сроком эксплуатации. Но важное значение имеет то, что они не любят постоянного включения и выключения, так как при этом снижается срок их эксплуатации.
Виды лампВажный момент: на сегодняшний день небольшие энергосберегающие лампочки вы можете купить с почти любыми видами цоколей: Е27, G13, GU10, G9, GU5.3, G4, GU4. Кроме того, они используются с типом цоколя E14.
- Люминесцентные лампы.
Их принято также именовать трубчатыми либо линейными из-за особой формы. Буква Т – это диаметр, а число – это диаметр в дюймах. К примеру, T12 (диаметр 12/8 дюйма).
Они также именуются «энергосберегающими», однако это не главное их достоинство. А основное преимущество – это длительный период эксплуатации, составляющий 25 000–100 000 часов. Если переведем это число в годы, то выходит 3–12 лет постоянной работы.
А основное преимущество – это длительный период эксплуатации, составляющий 25 000–100 000 часов. Если переведем это число в годы, то выходит 3–12 лет постоянной работы.
На сегодняшний день принято различать типы цоколей и для светодиодных ламп. Кроме того, бывает и лампочка без цоколя. Выглядит она как обычная.
Лампы с цоколем G13 сегодня так же востребованы, как светодиодные модели. Они не быстро нагреваются. По этой причине лампы с цоколем G13 лучше использовать в помещении, где строго соблюдается температурный режим.
Цоколи светодиодных ламп
Классификация ламп по типу цоколя — чрезвычайно удобный способ, который используется многими продавцами…
Классификация ламп по типу цоколя — чрезвычайно удобный способ, который используется многими продавцами осветительной техники, как в нашей стране, так и за рубежом. Цоколь служит для крепления лампы в патроне. Также через него осуществляется подача электроэнергии. Светодиодные (LED — Light Emitting Diode) лампы сравнительно недавно стали доступны для рядового покупателя. Еще несколько лет назад они стоили неоправданно дорого. Однако последнее время эта технология развивается бурными темпами. Стоимость одного люмена, произведенного светодиодными источниками света, понизилась в несколько раз, а технические параметры, такие как световая отдача, яркость, энергоэффективность, уже давно превзошли показатели других видов ламп. К тому же надо отметить одну особенность, которая в наибольшей мере присуща светодиодным лампам. Раньше было принято, что каждый класс осветительных приборов выпускался со своим видом цоколя. Это обуславливалось как конструктивными особенностями каждого вида ламп, так и преимущественными областями применения. Разработчики и производители светодиодных ламп поступили иначе. Изначально была сделана ставка на прямую замену ламп старого образца. Т.е. для замены лампы накаливания, галогенной, люминесцентной, энергосберегающей на светодиодный аналог достаточно иметь информацию о ее цоколе и просто приобрести светодиодную с таким же.
Светодиодные (LED — Light Emitting Diode) лампы сравнительно недавно стали доступны для рядового покупателя. Еще несколько лет назад они стоили неоправданно дорого. Однако последнее время эта технология развивается бурными темпами. Стоимость одного люмена, произведенного светодиодными источниками света, понизилась в несколько раз, а технические параметры, такие как световая отдача, яркость, энергоэффективность, уже давно превзошли показатели других видов ламп. К тому же надо отметить одну особенность, которая в наибольшей мере присуща светодиодным лампам. Раньше было принято, что каждый класс осветительных приборов выпускался со своим видом цоколя. Это обуславливалось как конструктивными особенностями каждого вида ламп, так и преимущественными областями применения. Разработчики и производители светодиодных ламп поступили иначе. Изначально была сделана ставка на прямую замену ламп старого образца. Т.е. для замены лампы накаливания, галогенной, люминесцентной, энергосберегающей на светодиодный аналог достаточно иметь информацию о ее цоколе и просто приобрести светодиодную с таким же. В результате получим множество неоспоримых достоинств – от сбережения электроэнергии и экономии бюджета до отсутствия вредных веществ (ртуть, тяжелые металлы), ультрафиолетового излучения и пульсаций.
В результате получим множество неоспоримых достоинств – от сбережения электроэнергии и экономии бюджета до отсутствия вредных веществ (ртуть, тяжелые металлы), ультрафиолетового излучения и пульсаций.
Теперь обсудим, какие же цоколи для светодиодных ламп пользуются наибольшей популярностью. Начнем с цоколя «Эдисона», резьбового соединения с патроном разного диаметра. Исторически он использовался в лампах накаливания. Число, указанное после буквенного обозначения в этом случае обозначает диаметр цоколя в миллиметрах. Т.е., например, маркировка Е27 говорит о том, что перед Вами цоколь «Эдисона» диаметром 27мм, а светодиодная лампа G9 аналогично имеет ширину цоколя 9 мм.
Обозначение другого класса цоколей начинается с латинской буквы G. Это штырьковое соединение с патроном, где последующие цифры показывают расстояние между контактами (тоже в миллиметрах). Вторая буква в маркировке указывает на некие особенности цоколя. К примеру, GU10 предполагает наличие утолщений на конце штырьков. Данный вид цоколя использовался либо в галогенных (G4, G9, GU5.3, GU10, GX53), либо люминесцентных (G13, G5, G23, G24) лампах.
К примеру, GU10 предполагает наличие утолщений на конце штырьков. Данный вид цоколя использовался либо в галогенных (G4, G9, GU5.3, GU10, GX53), либо люминесцентных (G13, G5, G23, G24) лампах.
Отдельно надо отметить цоколь, название которого начинается с латинской буквой R. Так маркируется цоколь с утопленным контактом, последующая цифра показывает его толщину в миллиметрах. Этот вид соединения применяется для линейных галогенных ламп в прожекторах.
В этой статье мы не будем останавливаться на других видах соединений и цоколей, т.к. в настоящий момент они либо практически не применяются в светодиодных лампах, либо исторически мало используются на территории РФ.
В таблице наглядно представлены все основные типы цоколей для светодиодных ламп.
В заключение отметим некоторые сложности, с которыми можно столкнуться при прямой замене ламп на светодиодный аналог:
-
Габаритные размеры светодиодных ламп могут отличаться от размеров тех традиционных ламп, на смену которым они пришли.

-
Трансформаторы от галогенных ламп не подходят для питания светодиодных.
-
Не всегда возможно использование диммеров от ламп накаливания и «галогенок». Дело в том, что для этого эффекта в светодиодных лампах применяются специальные электронные устройства, работающие по принципу ШИМ (широтно-импульсная модуляция). Для получения качественного диммирования рекомендуем поменять и старый выключатель с реостатом на специальный контроллер. Это позволит управлять световым потоком светодиодной лампы, в том числе и дистанционно. Другой вариант – это покупка диммируемой светодиодной лампы. В этом случае в драйвер монтируется специальная микросхема, позволяющая лампе менять яркость при изменении входящего напряжения. Такие лампы стоят несколько дороже обычных.
-
При демонтаже люминесцентной лампы необходимо предварительно удалить ПРА (пускорегулирующий аппарат), из светильника, а затем подключить светодиодную лампу непосредственно к клеммам.

Обо всем этом подробнее Вы сможете ознакомиться на нашем сайте в других статьях, а также разделах и описаниях конкретных ламп.
| Прежде чем купить лампу, рекомендуем обратить пристальное внимание на тип ее цоколя, иначе она может просто не подойти к светильнику. Все типы цоколей обозначаются согласно единым требованиям ГОСТ. Например, что обозначает лампа Е27? Большая буква в обозначениии указывает на тип цоколя: B — штифтовой цоколь (Байонет)E — резьбовой цоколь (Эдисона) F — цоколь с одним штырьком, гдеa — цилиндрический штырёк b — рифленый штырёк c — штырёк специальной формыG — штырьковый цокольH — цоколь для ксеноновых лампK — цоколь с кабельными соединениямиP — фокусирующий цоколь R — цоколь с утопленным контактомS — софитный цокольT — телефонный цокольW — основание, в котором электрический контакт с патроном осуществляется непосредственно через токовые вводы, расположенные на стеклянном основании лампы.  Число, следующее за буквенным обозначением, указывает диаметр соединительной части цоколя или расстояние между штырьками. Строчные буквы после цифры показывают количество контактных пластин, штырьков или гибких соединений: s — один контакт Иногда к первой букве добавляется еще одна буква, уточняющаяя (для некоторых типов): U — энергосберегающая лампочка; Пример: Лампа Е27 — резьбовой цоколь, диаметр соединительной части — 27 мм. Цоколь Эдисона — резьбовая система быстрого соединения лампы с патроном, самый популярный тип цоколя.
Штырьковый цоколь G: Штырьковый цоколь G использовался ранее только для установки трубчатых люминесцентных ламп. Споявлением новых вилов ламп, для соединения лампы и патрона используются разлиные штырьковые системы. Буквы U X Y Z указывают на модификацию конструкции. Такие цоколя не являются взаимозаменяемыми! Пример: лампа G13 R — Цоколь с утопленным контактом
Софитный двусторонний цоколь S как правило применяется в светильниках для освещения ванных комнат, подсветке зеркал или сценическом оборудовании. Применяется для прожекторов, фонарей, кинопроекторов, навигационных огней и т.д. Этот цоколь лампы накаливания содержит в себе сборную линзу, которая и направляет поток света в нужную сторону. Цифры обычно обозначают диаметр фокусирующего фланца или части цоколя, на которой горизонтально устанавливается лампа. Эти цоколи подходят лампочкам подсветки, пультов, мнемосхем и т.д. Цифры означают измеренную по контактным пластинкам внешнюю ширину. В случае такого цоколя контакт с патроном происходит прямо через токовые вводы, которые расположены на стеклянном основании лампы. Цифрами обозначают общую толщину стеклянной части с одним токовым вводом. Далее следует знак умножения и ширина основания цоколя в миллиметрах. На сегодняшний день существует так же ряд нестандартных цоколей, используемых в некоторых проекционных лампах, цоколь с кабельным соединением (К), а так же специальные цоколи для ксеноновых ламп, обозначаемые буквой Н и цифрами в соответствии с модификацией. В некоторых случаях вместо типа цоколя указывается тип лампы. MR16 (цифры могут различаться) — стандартный типоразмер галогенных ламп накаливания с отражателем. R50 (цифры показывают диаметр лампы)- типоразмер рефлекторных ламп. 2D — это компактные люминесцентные лампы. Подробнее про виды ламп Колбные лампы T5 (диаметр 5/8 дюйма=1.59 см), Подробнее про лампы Т8 Рекомендуем также посмотреть: Обозначение ламп Какие светодиодные лампы лучше Энергосберегающие лампы — вредны или нет? Как выбрать хороший стабилизатор напряжения |
E27, E14, E40, G4, GU10, GU5.3, G53, GX53, G13
Для полноценного функционирования и замены лампу подбирают в соответствии с патроном или разъемом, который используется в светильнике. Наиболее распространены резьбовые цоколи, также называемые цоколями Эдисона (обозначаются литерой E), и штырьковые разъемы (обозначаются буквой G). Кроме букв, в маркировке цоколя используются цифры, указывающие диаметр цоколя для первого типа или расстояние между контактами в разъеме — для второго. Традиционными считаются цоколи E27 (стандарт) и E14 (миньон).
E27 и E14 — резьбовые цоколи диаметром 27 мм и 14 мм соответственно. Чаще всего в бытовые светильники встраивают такой цоколь.
Чаще всего в бытовые светильники встраивают такой цоколь.
E40 — самый большой резьбовой цоколь, использующийся в мощных лампах для освещения промышленных помещений и улиц. Лампа с указанным цоколем эквивалентна, например, ртутной люминесцентной лампе ДРЛ.
G4, GU10, GU5.3 — штырьковые разъемы, применяемые в галогеновых лампах. Лампы на основе светодиодов с указанным типом разъема полноценно заменяют галогеновые лампы MR16. G4 используется в небольших лампах для точечной дизайнерской подсветки, GU5.3 — для подсветки ниш, картин, стендов и витрин, GU10 — в потолочном освещении. Лампы с GU10 фиксируются в патроне за счет поворота.
G53 — двухконтактный разъем с плоскими контактами. Чаще всего такие лампы используются во встраиваемых светильниках.
GX53 — двухконтактный разъем с контактами в форме штырька. Конструкция такого типа обычно требуется в натяжных и подвесных потолках. Как правило, это круглые лампы, в которых светодиоды расположены на плоской поверхности.
Конструкция такого типа обычно требуется в натяжных и подвесных потолках. Как правило, это круглые лампы, в которых светодиоды расположены на плоской поверхности.
G13 — двухштырьковый разъем, в котором контакты находятся на расстоянии 13 мм. Используется в большинстве типовых ламп дневного света и трубчатых лампах серии Т8.
Типы цоколей ламп | Освещение Philips
Найдите подходящее освещение
Удобные средства, помогающие сделать правильный выбор
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes, nascetur ridiculus mus. Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Donec quam felis, ultricies nec, pellentesque eu, pretium quis, sem. Nulla consequat massa quis enim.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes,
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes,
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Aenean massa. Cum sociis natoque penatibus et magnis dis parturient montes,
Базовое определение в химии
В химии основание — это химическое соединение, которое отдает электроны, принимает протоны или выделяет ионы гидроксида (ОН-) в водном растворе. Базы отображают определенные характерные свойства, которые можно использовать для их идентификации. Они имеют тенденцию быть скользкими на ощупь (например, мыло), могут иметь горький вкус, вступать в реакцию с кислотами с образованием солей и катализировать определенные реакции. Типы баз включают базу Аррениуса, базу Бронстеда-Лоури и базу Льюиса. Примеры оснований включают гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов и мыло.
Типы баз включают базу Аррениуса, базу Бронстеда-Лоури и базу Льюиса. Примеры оснований включают гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов и мыло.
Ключевые выводы: базовое определение
- Основание — это вещество, которое реагирует с кислотой в кислотно-основной реакции.
- Механизм, с помощью которого работает база, обсуждался на протяжении всей истории. Обычно основание либо принимает протон, либо выделяет гидроксид-анион при растворении в воде, либо отдает электрон.
- Примеры оснований включают гидроксиды и мыло.
Происхождение слова
Слово «основа» вошло в употребление в 1717 году французским химиком Луи Лемери.Лемери использовал это слово как синоним алхимической концепции Парацельса о «матрице» в алхимии. Парацельс предположил, что природные соли выросли в результате смешивания универсальной кислоты с матрицей.
Хотя Лемери, возможно, первым использовал слово «основа», его современное употребление обычно приписывают французскому химику Гийому-Франсуа Руэлю. Руэль определил нейтральную соль как продукт объединения кислоты с другим веществом, которое действует как «основание» для соли. Примеры оснований Руэля включают щелочи, металлы, масла или абсорбирующую землю.В 18 веке соли представляли собой твердые кристаллы, а кислоты — жидкости. Таким образом, для ранних химиков было логично, что материал, нейтрализующий кислоту, каким-то образом разрушил ее «дух» и позволил ей принять твердую форму.
Руэль определил нейтральную соль как продукт объединения кислоты с другим веществом, которое действует как «основание» для соли. Примеры оснований Руэля включают щелочи, металлы, масла или абсорбирующую землю.В 18 веке соли представляли собой твердые кристаллы, а кислоты — жидкости. Таким образом, для ранних химиков было логично, что материал, нейтрализующий кислоту, каким-то образом разрушил ее «дух» и позволил ей принять твердую форму.
Свойства основания
База демонстрирует несколько характерных свойств:
- Водный раствор основания или расплавленные основания диссоциируют на ионы и проводят электричество.
- Сильные основания и концентрированные основания являются едкими. Они бурно реагируют с кислотами и органическими веществами.
- Основания предсказуемо реагируют с индикаторами pH. Основа превращает лакмусовую бумагу в синий, метиловый оранжевый — в желтый и фенолфталеин — в розовый. Бромтимоловый синий остается синим в присутствии основания.

- Щелочной раствор имеет pH больше 7.
- Основания имеют горький вкус. (Не пробуй их!)
Типы оснований
Основания можно разделить на категории в зависимости от степени их диссоциации в воде и реакционной способности.
- Сильное основание полностью диссоциирует на ионы в воде или представляет собой соединение, способное отщеплять протон (H + ) из очень слабой кислоты.Примеры сильных оснований включают гидроксид натрия (NaOH) и гидроксид калия (КОН).
- Слабое основание не полностью диссоциирует в воде. Его водный раствор включает как слабое основание, так и сопряженную с ним кислоту.
- Супербаза даже лучше при депротонировании, чем сильная база. Эти основания имеют очень слабые сопряженные кислоты. Такие основания образуются при смешивании щелочного металла с сопряженной с ним кислотой. Супероснование не может оставаться в водном растворе, потому что это более сильное основание, чем гидроксид-ион.
 Пример супероснования в гидриде натрия (NaH). Самым сильным супероснованием является дианион орто-диэтинилбензола (C 6 H 4 (C 2 ) 2 ) 2−.
Пример супероснования в гидриде натрия (NaH). Самым сильным супероснованием является дианион орто-диэтинилбензола (C 6 H 4 (C 2 ) 2 ) 2−. - Нейтральное основание — это основание, которое образует связь с нейтральной кислотой, так что кислота и основание имеют общую пару электронов от основания.
- Твердая основа активна в твердой форме. Примеры включают диоксид кремния (SiO 2 ) и NaOH, нанесенный на оксид алюминия. Твердые основания могут использоваться в анионообменных смолах или для реакций с газообразными кислотами.
Реакция между кислотой и основанием
Кислота и основание реагируют друг с другом в реакции нейтрализации. При нейтрализации водная кислота и водное основание образуют водный раствор соли и воды. Если соль насыщенная или нерастворимая, она может выпадать в осадок из раствора.
Хотя может показаться, что кислоты и основания — противоположности, некоторые виды могут действовать как кислоты или основания. Фактически, некоторые сильные кислоты могут действовать как основания.
Фактически, некоторые сильные кислоты могут действовать как основания.
Источники
- Дженсен, Уильям Б.(2006). «Происхождение термина« основа ». The Journal of Chemical Education . 83 (8): 1130. doi: 10.1021 / ed083p1130
- Johll, Matthew E. (2009). Investigating chemistry: a forensic перспектива (2-е изд.). Нью-Йорк: WH Freeman and Co. ISBN 1429209895.
- Whitten, Kenneth W.; Peck, Larry; Davis, Raymond E .; Lockwood, Lisa; Stanley, George G. (2009) ). Chemistry (9-е изд.). ISBN 0-495-39163-8.
- Zumdahl, Steven; DeCoste, Donald (2013). Химические принципы (7-е изд.). Мэри Финч.
20 распространенных примеров оснований в повседневной жизни
Что такое основание в химии? Основные вещества реагируют на водные растворы, принимая протоны, отдавая электроны или выделяя гидроксид-ионы. Они нейтрализуют кислоты, реагируя с ионами водорода с образованием солей и воды.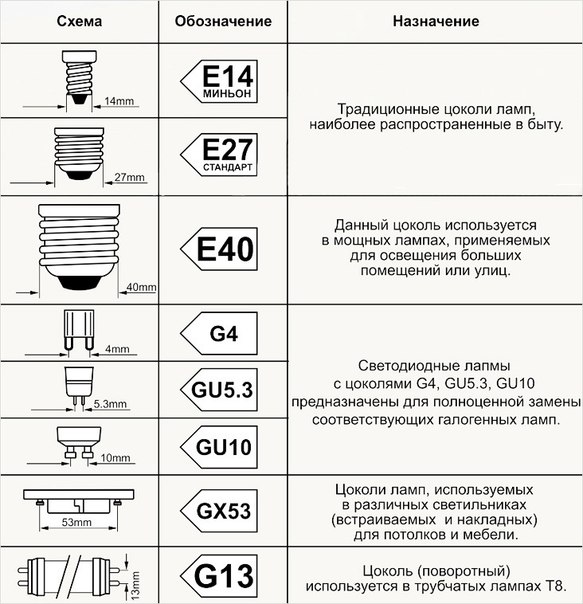 Основание, растворяющееся в воде, также известно как щелочь.
Основание, растворяющееся в воде, также известно как щелочь.
Свойства оснований
Даже если у вас нет микроскопа для измерения химических реакций, вы можете определить, является ли вещество основанием или кислотой.Базы можно описать следующими способами:
Классификация баз
Как узнать, с каким типом базы вы имеете дело? Большинство баз можно разделить на сильные и слабые; концентрированный или разбавленный; или одноосновные, двухосновные или трехосновные кислоты. Эти качества можно определить в следующих классификациях.
Степень ионизации
Этот тип классификации описывает прочность основания. Если в основании мало гидроксильных ионов, оно считается слабым.
- Сильные основания содержат большое количество гидроксильных ионов.
- Слабые основания не растворяются полностью в воде, как сильные основания.
Концентрация
Если основа разбавлена, она содержит большое количество воды.
- Концентрированные основания имеют высокий процент основных веществ по сравнению с их уровнем воды.
- Разбавленные основания имеют более низкие концентрации основания и больше воды.
Кислотность
Это кажется нелогичным, но основания тоже могут быть кислотными. В зависимости от количества гидроксильных ионов, которые соединяются с ионами водорода, основание можно разделить на один из трех типов:
- Одноосновное: одно каждого иона
- Диацидное: две комбинации каждого иона
- Трехкислотный: три комбинации каждого иона
Примеры повседневных оснований
Хотя химики обычно соглашаются с основным определением оснований, они не всегда находят консенсус, когда дело доходит до определения их поведения.Дополнительные классификации оснований описывают, что они делают в конкретных химических контекстах.
Arrhenius Bases
Названные в честь шведского ученого Сванте Аррениуса для описания поведения оснований в воде, эти основания диссоциируют при добавлении в водный раствор, превращая их в сильных основания .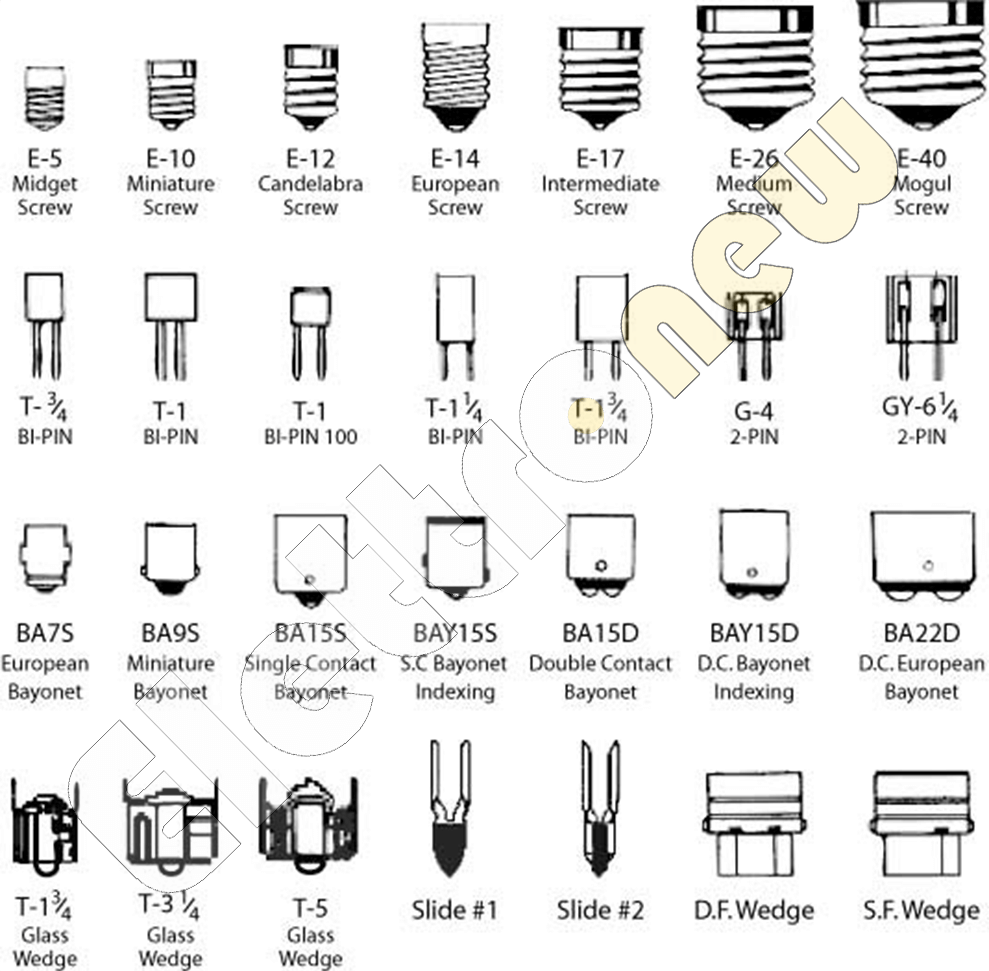 Они образуют ионы гидроксида и увеличивают концентрацию гидроксида в воде. Некоторые примеры распространенных продуктов, содержащих основы Аррениуса, включают:
Они образуют ионы гидроксида и увеличивают концентрацию гидроксида в воде. Некоторые примеры распространенных продуктов, содержащих основы Аррениуса, включают:
- Очиститель канализации
- Моющее средство для стирки
- Смазка
- Щелочные батареи
- Мыло и средства для ванн
- Сахар
- Пищевая сода 900ns13 Lowry Основания, которые принимают протоны от других молекул, известны как основания Бренстеда-Лоури.Они были частью пересмотренного определения химиков Йоханнеса Бронстеда и Томаса Лоури 1923 года, в котором основное внимание уделялось переносу протонов между веществами. Базы Brønsted-Lowry можно найти в следующих продуктах:
- Аммиак
- Щелочные батареи
- Ополаскиватель для рта
- Пластик
- Местные обезболивающие
- Жевательная резинка
- Обивка мебели
- Спирт
- Краска для волос
- Сигаретный дым
- Пестициды
- Пластырь
- Соль Эпсома
Кислоты проводят электричество (т.е.е. они являются электролитами)
Они превращают синюю лакмусовую бумажку в красную
Большинство кислот твердые
Имеет кислый вкус
Они производят водород после реакции с активными металлами, такими как цинк, магний алюминий или железо.

Кислоты имеют низкое значение pH, т.е. ниже 7.
Соли и вода образуются, когда кислота реагирует с основанием или щелочами.
Большинство кислот твердые.
Некоторые кислоты могут иметь коррозионную природу.
Слабые и более летучие кислоты заменяются сильными и менее летучими кислотами из их солей.
Раствор основы имеет баланс pH более 7.
Основа имеет горький вкус, поэтому никогда не пробуйте ее попробовать.
Когда водный раствор основания или раствор расплавленного основания диссоциируют на ионы, они проводят электричество.
Сильное основание активно реагирует с кислотами и органическими веществами, поскольку эти основания являются едкими.
Основания правильно реагируют с индикаторами pH. Он превращает лакмусовую бумагу в синий, метиловый оранжевый желтый и фенолфталеиновый розовый, тогда как бромтимоловый синий остается синим в присутствии основания.

Сильное основание — полностью диссоциирует на ионы в воде или в соединении, которое может удалить протон (H +) из слабой кислоты. Примеры сильного основания — гидроксид натрия (NaOH) и гидроксид калия (КОН).
Слабое основание — эти основания полностью диссоциируют в воде. Водный раствор является одним из примеров, который включает основание и его сопряженную кислоту.
Нейтральное основание — это основание, которое образует связь с нейтральной кислотой.
Супероснование — Этот тип основания образован щелочным металлом с его сопряженной кислотой и даже лучше по сравнению с сильным основанием. Одним из примеров супероснования является гидрид натрия (NaH).
Твердая основа — может использоваться в анионообменных смолах или для реакций с газообразными кислотами.
 Активен в твердой форме. Диоксид кремния (SiO₂) и NaOH, нанесенные на оксид алюминия, являются примерами твердой основы.
Активен в твердой форме. Диоксид кремния (SiO₂) и NaOH, нанесенные на оксид алюминия, являются примерами твердой основы.Соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия (соли) и воды.{-} \) ионы. Соль все еще образуется как единственный продукт, но вода не образуется.
Важно понимать, насколько полезны эти реакции нейтрализации. Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция (\ (\ text {CaO} \)) — это основа (все оксиды металлов являются основаниями), которую наносят на слишком кислую почву.
 Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках.
Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках.Известняк (белый камень или карбонат кальция) используется в выгребных ямах (или длинных отстойниках). Известняк — это основа, которая помогает нейтрализовать кислотные отходы.
Биологические применения
Кислоты в желудке (например, соляная кислота) играют важную роль в переваривании пищи. Однако, когда у человека есть язва желудка или когда в желудке слишком много кислоты, эти кислоты могут вызвать сильную боль. Антациды используются для нейтрализации кислот, чтобы они не горели так сильно. Антациды — это основания, нейтрализующие кислоту. Примерами антацидов являются гидроксид алюминия, гидроксид магния («магнезиальное молоко») и бикарбонат натрия («бикарбонат соды»).
 Антациды также можно использовать для снятия изжоги.
Антациды также можно использовать для снятия изжоги.Промышленное использование
Основной гидроксид кальция (известковая вода) может использоваться для поглощения вредного кислого \ (\ text {SO} _ {2} \) газа, который выделяется на электростанциях и при сжигании ископаемого топлива.
Укусы пчел являются кислыми и имеют pH от \ (\ text {5} \) до \ (\ text {5,5} \). Их можно успокоить, используя такие вещества, как бикарбонат соды и молоко магнезии. Обе основы помогают нейтрализовать кислотный пчелиный укус и немного уменьшить зуд!
Кислотно-основные реакции
Цель
Для исследования кислотно-основных реакций.
Аппаратура и материалы
- Мерная колба
- колбы конические
- раствор гидроксида натрия
- раствор соляной кислоты
- пипетка
- индикатор
Метод
Используйте пипетку, чтобы добавить \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в мерную колбу.
 Долить до отметки водой и хорошо взболтать.
Долить до отметки водой и хорошо взболтать.Отмерьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в коническую колбу. Добавьте несколько капель индикатора.
Медленно добавьте \ (\ text {10} \) \ (\ text {ml} \) соляной кислоты. Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Наблюдения
Раствор меняет цвет после добавления заданного количества соляной кислоты.
В приведенном выше эксперименте вы использовали индикатор, чтобы увидеть, когда кислота нейтрализует основание. Индикаторы — это химические соединения, которые меняют цвет в зависимости от того, в кислоте они или в основе.
Включен рекомендуемый эксперимент для неформальной оценки по обнаружению природных индикаторов.
 Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекали цвет из растения, кипятя его, а затем сливая жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полосок бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекали цвет из растения, кипятя его, а затем сливая жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полосок бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.Важно, чтобы учащиеся не клали лицо или нос прямо над или в стакан, когда нюхали лук и ванильную эссенцию.
 Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах к своему лицу.
Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах к своему лицу.Кислоты и щелочи едкие и могут вызвать серьезные ожоги, поэтому с ними нужно обращаться осторожно.
Показатели
Цель
Чтобы определить, какие растения и продукты питания могут выступать в качестве индикаторов.
Аппаратура и материалы
- Возможные индикаторы: красная капуста, свекла, ягоды (например, шелковица), порошок карри, красный виноград, лук, чай (ройбуш или обычный), разрыхлитель, ванильная эссенция
- кислоты (например, уксус, соляная кислота), основания (напр.грамм. аммиак (во многих бытовых чистящих средствах)) для проверки
- Стаканы
Метод
Возьмите небольшое количество первого возможного индикатора (не используйте лук, ванильную эссенцию и разрыхлитель). Варить массу до тех пор, пока вода не изменит цвет.
Отфильтруйте полученный раствор в стакан, стараясь не попасть в стакан.
 (Также можно вылить воду через дуршлаг или сито.)
(Также можно вылить воду через дуршлаг или сито.)Половину полученного окрашенного раствора налейте во второй стакан.
Поместите один стакан на лист бумаги формата А4 с надписью «кислоты». Поместите другой стакан на лист бумаги с надписью «основы».
Повторите со всеми другими возможными индикаторами (кроме лука, ванильной эссенции и разрыхлителя).
Во все мензурки на листе с кислотой осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты.Запишите свои наблюдения.
Во все мензурки на листе основы осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) основы. Запишите свои наблюдения.
Если у вас более одной кислоты или основания, вам нужно будет повторить вышеуказанные шаги, чтобы получить свежие индикаторные образцы для вашей второй кислоты или основания.
 Или вы можете использовать меньшее количество полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Или вы можете использовать меньшее количество полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.Обратите внимание на запах лука и ванильной эссенции.Положите в стакан небольшой кусочек лука. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Поместите небольшой кусочек лука в стакан. Это для тестирования с базой. Залейте \ (\ text {5} \) \ (\ text {ml} \) основы. Помашите рукой над стаканом, чтобы выдувать воздух к носу.Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Наконец, поместите в стакан чайную ложку разрыхлителя. Осторожно налейте в стакан \ (\ text {5} \) \ (\ text {ml} \) кислоты.
 Запишите свои наблюдения. Повторите, используя базу.
Запишите свои наблюдения. Повторите, используя базу.
Наблюдения
Lewbert Chem. Льюис открыл ковалентную связь и внимательно изучил концепцию электронных пар.
 Основания, которые являются донорами электронных пар, известны как основания Льюиса, а вещества, которые принимают эти электронные пары, — кислоты Льюиса. Вот несколько примеров баз в домашних условиях.
Основания, которые являются донорами электронных пар, известны как основания Льюиса, а вещества, которые принимают эти электронные пары, — кислоты Льюиса. Вот несколько примеров баз в домашних условиях.Дополнительные ресурсы по химии
Если вы готовы узнать больше о химии, взгляните на эти примеры катализаторов, которые запускать каждую химическую реакцию.Вы также можете прочитать о других химических характеристиках, таких как воспламеняемость и токсичность, в нашей статье о химических свойствах.
Что такое база в химии?
Традиционно основания имеют горький вкус, а кислоты — кислые, но в химии определения эволюционировали так, что вещества являются основаниями или кислотами, используя их химические свойства. Эта классификация важна, потому что кислоты и основания могут реагировать с образованием солей, и они являются основой многих других типов обычных химических реакций. Основания имеют определенные общие химические свойства, и выбор подходящего химического вещества может повлиять на результат реакции.
Основания имеют определенные общие химические свойства, и выбор подходящего химического вещества может повлиять на результат реакции.
TL; DR (слишком долго; не читал)
Более ограниченное и старое определение заключалось в том, что основание — это вещество, которое растворяется в воде и диссоциирует на гидроксид или ион OH — и положительный ион. В более общем определении основание — это вещество, которое при растворении в воде увеличивает количество гидроксид-ионов. Это определение достаточно широко, чтобы включать вещества, которые сами по себе не содержат гидроксид-ионы в составе своих молекул, а также реакции, которые не происходят в воде.
Ранние определения базы
Химические вещества были базами из-за их наблюдаемых свойств. В этом отношении основы представляли собой вещества, которые имели горький вкус, были скользкими и превращали лакмусовую краску из красного в синий. Когда вы добавляли кислоты к основаниям, оба вещества теряли свои характеристики, и вы получали твердое вещество или соль. Основания получили свое название от этих реакций, потому что они были «основным» химическим веществом, к которому вы добавляли кислоты.
Основания получили свое название от этих реакций, потому что они были «основным» химическим веществом, к которому вы добавляли кислоты.
Arrhenius Bases
Сванте Аррениус предложил более общее определение в 1887 году.Аррениус изучал ионы в водных растворах, предполагая, что поваренная соль или NaCl растворяются в воде путем разделения на положительные ионы натрия и отрицательные ионы хлора. Основываясь на этой теории, он думал, что основания — это вещества, которые растворяются в воде с образованием отрицательных ионов OH — и положительных ионов. С другой стороны, кислоты производили положительные ионы H + и другие отрицательные ионы. Эта теория хорошо работает со многими распространенными химическими веществами, такими как щелочь или NaOH. Щелок растворяется в воде с образованием положительных ионов натрия Na + и отрицательных ионов OH –, и это сильное основание.
Определение Аррениуса не объясняет, почему такие вещества, как NaCO 3 , которые не имеют гидроксид-иона, который может растворяться в воде, тем не менее обладают свойствами, типичными для оснований. Определение также работает только для реакций в воде, потому что оно указывает, что основания должны растворяться в воде.
Определение также работает только для реакций в воде, потому что оно указывает, что основания должны растворяться в воде.
Кислоты и основания в химии
Определения Аррениуса верны в том смысле, что они идентифицируют гидроксид-ион как активный компонент для оснований. Для кислот определения Аррениуса указывают, что кислотное вещество растворяется с образованием положительных ионов водорода H + , соответствующего активному компоненту для кислот.
Эти определения могут применяться к веществам вне водных растворов, которые не содержат гидроксид или ионы водорода. Вместо этого основания могут быть веществами, которые при растворении в воде увеличивают количество гидроксид-ионов в растворе. Кислоты также увеличивают количество ионов водорода. Это более широкое определение успешно объединяет все вещества, которые ведут себя как основание, в более общую категорию и описывает, что такое основания в химии.
Кислоты и основания, найденные в домах
Кислоты — это молекулы, которые выделяют ионы или протоны водорода в растворе. Обычно они кислые и могут растворять металлы. Основания — это также молекулы, имеющие горький вкус и непрозрачную окраску. Кислоты и основания бывают сильными или слабыми. Когда вы объединяете кислоты и основания в смесь, они нейтрализуют друг друга. Кислоты и щелочи можно найти в собственном доме в виде продуктов питания и хозяйственных товаров.
Обычно они кислые и могут растворять металлы. Основания — это также молекулы, имеющие горький вкус и непрозрачную окраску. Кислоты и основания бывают сильными или слабыми. Когда вы объединяете кислоты и основания в смесь, они нейтрализуют друг друга. Кислоты и щелочи можно найти в собственном доме в виде продуктов питания и хозяйственных товаров.
Цитрусовые
••• Polka Dot Images / Polka Dot / Getty Images
Апельсины и лимоны, например, содержат лимонную кислоту, которая делает их кислыми домашними продуктами.
Зубная паста
••• Jupiterimages / Pixland / Getty Images
Зубная паста — неотъемлемая часть ванной комнаты дома. Это базовое вещество. Иногда зубные пасты идеально подходят для временного снятия ожогов кожи.
Уксус
••• Hemera Technologies / AbleStock.com / Getty Images
Уксус — популярный продукт питания в домашних условиях. Он содержит уксусную кислоту. Люди используют его дома для приготовления пищи, и он идеально подходит в качестве чистящего средства из-за своей кислой природы. Он может удалить плесень и плесень с таких поверхностей, как плитка и стекло.
Люди используют его дома для приготовления пищи, и он идеально подходит в качестве чистящего средства из-за своей кислой природы. Он может удалить плесень и плесень с таких поверхностей, как плитка и стекло.
Газированные напитки
••• ITStock Free / Polka Dot / Getty Images
Газированные напитки или газированные напитки являются кислотами, поскольку содержат углекислоту. Хотя эти газированные напитки безопасны для употребления, они могут вызывать коррозию металлов и других материалов.
Пищевая сода
••• Jupiterimages / Polka Dot / Getty Images
Пищевая сода или бикарбонат натрия является примером основы. Пищевая сода — слабое основание, используемое в пищу человеком.Люди используют его в кулинарии, выпечке и уборке. Иногда люди используют пищевую соду в спреях для глажки, чтобы одежда оставалась свежей и плотной.
Чистящие порошки
••• Thinkstock Images / Comstock / Getty Images
Бытовые чистящие порошки являются основой и не могут быть использованы при приготовлении пищи из-за их сильной природы. Они действуют на металлы и другие поверхности. Примеры основных чистящих порошков включают стиральные порошки, чистящие средства для ванной и отбеливатели.
Они действуют на металлы и другие поверхности. Примеры основных чистящих порошков включают стиральные порошки, чистящие средства для ванной и отбеливатели.
Мыло
••• Hemera Technologies / AbleStock.com / Getty Images
Мыло также является примером сильной основы, используемой для купания и очистки.
Аммиак
••• Jupiterimages / Photos.com / Getty Images
Аммиак представляет собой бесцветный газ при комнатной температуре. При производстве в жидкой форме в виде гидроксида аммония он становится бытовым продуктом с множеством применений. Большинство людей предпочитают его в качестве моющего и дезинфицирующего раствора для различных поверхностей и приспособлений. Поскольку гидроксид аммония не опасен для кожи человека, он также действует как средство от укусов насекомых.
Разница между кислотой и щелочью
Кислота и основание — это химические вещества, которые играют жизненно важную роль в химии и легко доступны в нашей повседневной жизни. Примеры кислот включают лимонную кислоту и молочную кислоту, присутствующие в лимонах и молочных продуктах соответственно. Некоторые примеры основ включают чистящие средства, такие как отбеливатель и нашатырный спирт. Практически каждая жидкость, о которой мы можем думать в повседневной жизни, является кислотной или щелочной, за исключением воды.Определение кислоты и основания развивалось со временем с помощью 3 наборов теорий, в том числе теорий Аррениуса, Бронстеда и Льюиса. Вещества, которые действуют как кислоты и основания, называются амфотеризмом. Вода является наиболее распространенным примером амфотеризма, поскольку действует как кислота и основание.
Примеры кислот включают лимонную кислоту и молочную кислоту, присутствующие в лимонах и молочных продуктах соответственно. Некоторые примеры основ включают чистящие средства, такие как отбеливатель и нашатырный спирт. Практически каждая жидкость, о которой мы можем думать в повседневной жизни, является кислотной или щелочной, за исключением воды.Определение кислоты и основания развивалось со временем с помощью 3 наборов теорий, в том числе теорий Аррениуса, Бронстеда и Льюиса. Вещества, которые действуют как кислоты и основания, называются амфотеризмом. Вода является наиболее распространенным примером амфотеризма, поскольку действует как кислота и основание.
Что такое кислота?
Согласно Аррениусу, вещество можно назвать кислотным, если оно ионизируется или распадается в водном растворе с образованием ионов водорода (ионы H +). Этот тип классификации кислот может работать для водных растворов.Ограничение этого типа классификации состоит в том, что когда и кислоты, и основания реагируют друг с другом, они нейтрализуются, поскольку ионы водорода и ионы гидроксида реагируют с образованием воды.
H + (водн.) + OH- (водн.) H₂O (l)
Согласно теории Бренстеда, вещество считается кислотным, если оно отдает протон (донор ионов водорода). Бронстед не пошел против теории Аррениуса, он просто добавил к ней. Соединение, которое отдает ионы H +, называется кислотой Бренстеда-Лоури, включая обычные кислоты, а также амины и спирт.Это определение кислоты по Бренстеду-Лоури — лучшее определение кислоты.
Согласно теории Льюиса, вещество считается кислотным, если оно принимает электроны от другого вещества, участвующего в реакции. Внешняя оболочка кислот становится завершенной после принятия электронных пар в их валентную оболочку. Нет изменений в степени окисления реакции, включая кислоты.
Свойства кислот следующие:
Типы кислот следующие:
Сильные кислоты полностью диссоциируют ионы в воде, а слабые кислоты частично диссоциируют ионы в воде. Кислоты делятся на 2 типа в зависимости от диссоциации ионов в воде, т.е. сильные кислоты и слабые кислоты, как указано ниже: —
1.Сильные кислоты — сильная кислота полностью диссоциирует ионы в воде. Есть только 6 сильных кислот, а именно:
Есть только 6 сильных кислот, а именно:
2. Слабые кислоты — Слабая кислота частично диссоциирует ионы в воде. Остальные кислоты, за исключением этих 6 кислот, являются слабыми кислотами. Водород и галоген соединяются в реакции с образованием слабой кислоты, а именно фтористоводородной кислоты, в то время как соляная кислота является очень сильной и чрезвычайно мощной, а также коррозионной по природе, но считается слабой кислотой.
Что такое база?
Основание — это химическое соединение, которое отдает электроны, принимает протоны или выделяет ионы гидроксида (ОН-) в водных растворах.База показывает определенные характеристики, которые можно использовать для их идентификации. Вы можете идентифицировать основание с помощью этих данных способов, например, они скользкие на ощупь (например, мыло), горькие на вкус, вступают в реакцию с кислотой с образованием соли и катализируют определенные реакции. Он включает в себя базу Аррениуса, базу Бронстеда-Лоури и базу Льюиса как типы баз. Есть несколько примеров оснований, таких как гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов и мыло.
Есть несколько примеров оснований, таких как гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов и мыло.
Свойства основы можно перечислить следующим образом:
Типы оснований
Различия между кислотой и щелочью
Основа | Кислота | Основание |
Кислота — это вид химического соединения, которое при растворении в воде дает раствор с активностью ионов H +, большей, чем у очищенной воды. | Основание — это водное вещество, которое отдает электроны, принимает протоны или выделяет ионы гидроксида (ОН-). | |
2. Определение Бронстеда Лоури | Кислота является донором протонов. | В то время как основание является акцептором протонов. |
3. | Уксусная кислота (CH2COOH) и серная кислота являются двумя примерами кислоты. | Гидроксид натрия (NaOH) и аммиак — два примера оснований. |
4. Значение pH | Значения pH кислоты меньше 7,0. | С другой стороны, значение pH основания больше 7,0. |
5. Фенолфталеин | Кислота остается бесцветной при растворении. | Основания делают раствор розовым при растворении. |
6. Химическая формула | Кислота начинается с химической формулы H, например, HCL (соляная кислота), но есть исключение для CH₂COOH. | В то же время основание имеет химическую формулу ОН на конце. Например, NaOH (гидроксид натрия). |
7. Лакмусовая бумага | Кислота превращает синюю лакмусовую бумагу в красную. | База превращает красную лакмусовую бумагу в синюю. |
8. Прочность | Кислота в основном зависит от концентрации ионов гидроксония. | Аналогично происходит в базе. |
9. Характеристики | Кислота может быть в твердой, жидкой или газовой форме в зависимости от температуры. | Основы имеют горький вкус, немного скользкий и твердый, за исключением аммиака, который присутствует в газообразном состоянии |
10.Диссоциация | Когда кислоты растворяются в воде, они выделяют ионы водорода (H +). | Основание высвобождает гидроксид-ионы (ОН-) при растворении в воде. |
11. Примеры | Примеры кислот: уксусная кислота, серная кислота и т. | Примеры оснований: гидроксид натрия, аммиак и т. Д. |
Типы реакций — Осадки и кислоты / основания
Типы реакций — осадки и кислоты / основанияТипы реакций
Нижеследующее содержание является сутью лекции 13.В этой лекции мы рассмотрим реакции осаждения и кислотно-основные реакции.
Растворимость и осаждение
Продолжая обсуждение того, что заставляет реакцию переходить в продукт, мы теперь вернемся к образованию твердого вещества. В реакции, в которой один из продуктов практически не имеет растворимости (способности растворяться) в воде, образуется твердое вещество. Это твердое вещество называется осадком. Это связано с тем, что так же, как дождь падает с неба, твердое вещество, которое образуется, выпадает из раствора и собирается на дне контейнера, в котором оно находится.
Уловка для понимания реакции осаждения состоит в том, чтобы знать, какие соединения, образующиеся, не растворимы. К сожалению, единственный способ узнать это — запомнить некоторые правила растворимости:
К сожалению, единственный способ узнать это — запомнить некоторые правила растворимости:
В приведенной выше таблице представлены несколько правил, которые вы должны запомнить. Обратите внимание, что из большинства правил есть исключения. Вам также нужно будет знать это.
Написание уравнения реакции осаждения:
Типичные вопросы, касающиеся реакции осаждения, потребуют идентификации чистого ионного уравнения, которое мы рассмотрели ранее, или будут простым вопросом, в котором вам нужно завершить реакцию и определить, будет ли она производить продукт или нет.Другими словами, он будет образовывать какие-либо соединения, которые стимулируют реакцию в прямом направлении.
Вот пример:
Какие продукты для следующей реакции?
AgNO 3 (водн.) + KI (водн.) →?
Чтобы ответить на вопрос, вы должны понять, что это реакция Метатезиса. Это причудливое слово для обозначения «обмена партнерами» в качестве реакции.
Это причудливое слово для обозначения «обмена партнерами» в качестве реакции.
Лучший способ завершить этот процесс и правильно спрогнозировать продукты — разделить каждый из реагентов на ионы:
Ag + + NO 3 — + K + + I — →
Теперь поменяйте местами положительные ионы и сделайте так, чтобы новые соединения уравновешивали заряды, чтобы соединение было нейтральным.
Ag + + NO 3 — + K + + I — → AgI (s) + KNO 3 (водн.)
Идентификация AgI как твердого вещества происходит из исключений из правил для галогенидов, указанных в таблице выше.
Чистое ионное уравнение для этой реакции будет включать только те ионы, которые образуют твердое тело, поэтому:
Ag + (водн. ) + I — (водн.) → AgI (s)
) + I — (водн.) → AgI (s)
Чтобы отработать эти реакции, вам нужно потратить некоторое время сначала на работу с правилами, а затем использовать приведенные ниже вопросы, чтобы проверить себя.
Практические задачи и ответы
Теперь перейдем ко второй части этой лекции о реакциях ….
Кислоты и основания
Как мы видели, когда мы работали над номенклатурой, кислоты можно идентифицировать по тому, как их формула записана с ионизируемыми атомами водорода в передней части молекулы: H Cl, H 2 SO 4 и т. Д. Кислота определяется ее способностью отдавать этот водород (также называемый протоном), когда он находится в водном растворе.С другой стороны, основания обычно распознаются по присутствию гидроксид-иона в их формуле: Na OH , Ba ( OH ) 2 и т. Д. Мы определяем основание по его способности поглощать протоны из раствора.
Д. Мы определяем основание по его способности поглощать протоны из раствора.
Итак, теперь, когда мы знаем, что они собой представляют, что нам с ними делать? Что ж, всякий раз, когда кислота и гидроксидное основание взаимодействуют вместе, они всегда производят одни и те же два типа продуктов: соль и воду.
Пример: HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
NaCl — это соль этой реакции, а вода вам уже знакома. Если мы посмотрим на чистое ионное уравнение для этой реакции, оно показывает, что движущей силой реакции является производство воды:
H + (водн. ) + OH — (водн.) → H 2 O (л)
) + OH — (водн.) → H 2 O (л)
Когда вы взаимодействуете с кислотой и основанием, этот процесс называется нейтрализацией.Это связано с тем, что продукты реакции не вносят никаких протонов или гидроксид-ионов в раствор, кроме нормальной диссоциации воды в воде, которая является очень небольшой величиной (константа диссоциации Kw = 1,0 x 10 -14 ). Концентрация H + на основе этой диссоциации составляет 1,0 x 10 -7 M, и когда мы берем pH этого значения (-log (1,0 x 10 -7 )), он равен 7, что определяется как нейтральный pH.
А пока мы сконцентрируемся на реакциях сильных кислот и оснований.В таблице ниже указаны сильные кислоты и основания, которые вам необходимо знать. Все остальные кислоты и основания будут считаться слабыми для целей этого курса.
Вот некоторые практические задачи для реакций кислот и оснований:
Рабочий лист и ключ
Кислотно-основные реакции | Типы реакций
13.
 2 Кислотно-основные реакции (ESBQY)
2 Кислотно-основные реакции (ESBQY)Реакция между кислотой и основанием известна как реакция нейтрализации .Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
В химии слово соль не означает белое вещество, которым вы посыпаете пищу (это белое вещество является солью, но не единственной солью). Соль (для химиков) — это продукт кислотно-основной реакции, состоящий из катиона основания и аниона кислоты.




 »»»»Теплый свет лампы
»»»»Холодный свет лампы
»»»Аналоги ламп накаливания до 100 Вт.
»»»»Теплый свет лампы
»»»»Холодный свет лампы
»»»Аналоги ламп накаливания до 500 Вт.
»»»»Теплый свет лампы
»»Лампы накаливания
»»Лампы люминесцентные
»»»Лампы Т4 люминесцентные
»»»Лампы Т5 люминесцентные
»»»Лампы Т8 люминесцентные
»»Лампы галогенные
»»»Лампы галогенные декоративные
»»»Лампы галогенные G4, GU 5.3, GU10
»»»Блоки защиты галогенных ламп
»»Лампы металлогалогенные
»»Лампы ртутные и натриевые
»Светильники
»»Светодиодные светильники LED
»»»Потолочные светодиодные светильники
»»»»Светодиодный светильник под Армстронг
»»»»Встраиваемые светодиодные светильники
»»»»Накладные светодиодные светильники
»»»»Точечные светодиодные светильники
»»»»Крепления для потолочных светильников
»»»Настольные светодиодные светильники
»»»Прожекторы светодиодные
»»»Светодиодные светильники уличного освещения
»»»Для ЖКХ
»»Для дома
»»»Потолочные светильники, люстры
»»»»Светильники под лампу накаливания
»»»»Люстры
»»»»Люминесцентные светильники
»»»Настенные светильники, бра
»»»»Светильники под лампу накаливания
»»»»Люминесцентные светильники
»»»Ночники
»»»Для ванной и туалета
»»»Для кухни
»»»Точечные светильники
»»»Настольные светильники
»»Светильники лофт
»»Диско шар
»»Для дачи
»»Для теплицы
»»Для бани и сауны
»»Для гаража и подвала
»»Для производства
»»Для офиса
»»Для склада и производства
»»Для улицы
»»»Кронштейны для уличных светильниов
»»Светильники для сада и парка
»»Для подсветки
»»Для спортивного зала
»»Для магазина
»»Переносные светильники
»»Аварийные светильники
»»Аккумуляторные светильники
»»Патроны к светильникам
»Светодиодная подсветка
»»Светодиодная подсветка потолка
»»»Светодиодная гибкая лента для помещений на самоклеющейся основе ULS-3528
»»» Светодиодная гибкая лента для помещений на самоклеющейся основе ULS-5050
»»»Светодиодная гибкая герметичная лента ULS-3528
»»»Светодиодная гибкая герметичная лента ULS-5050
»»»Драйверы для светодиодов
»»»Контроллеры для управления светодиодными источниками света
»»Светодиодная подсветка шкафа
»»Электронные трансформаторы
»Стабилизаторы напряжения
»»Однофазные стабилизаторы напряжения
»»Стабилизаторы напряжения напольные, электронные
»»Стабилизаторы напряжения настенные, релейные
»»Стабилизаторы напряжения настольные
»»Стабилизаторы напряжения электромеханические
»Низковольтная аппаратура
»»Автоматические выключатели
»»»Автоматы для проводов сечением до 25мм.
»»»»Теплый свет лампы
»»»»Холодный свет лампы
»»»Аналоги ламп накаливания до 100 Вт.
»»»»Теплый свет лампы
»»»»Холодный свет лампы
»»»Аналоги ламп накаливания до 500 Вт.
»»»»Теплый свет лампы
»»Лампы накаливания
»»Лампы люминесцентные
»»»Лампы Т4 люминесцентные
»»»Лампы Т5 люминесцентные
»»»Лампы Т8 люминесцентные
»»Лампы галогенные
»»»Лампы галогенные декоративные
»»»Лампы галогенные G4, GU 5.3, GU10
»»»Блоки защиты галогенных ламп
»»Лампы металлогалогенные
»»Лампы ртутные и натриевые
»Светильники
»»Светодиодные светильники LED
»»»Потолочные светодиодные светильники
»»»»Светодиодный светильник под Армстронг
»»»»Встраиваемые светодиодные светильники
»»»»Накладные светодиодные светильники
»»»»Точечные светодиодные светильники
»»»»Крепления для потолочных светильников
»»»Настольные светодиодные светильники
»»»Прожекторы светодиодные
»»»Светодиодные светильники уличного освещения
»»»Для ЖКХ
»»Для дома
»»»Потолочные светильники, люстры
»»»»Светильники под лампу накаливания
»»»»Люстры
»»»»Люминесцентные светильники
»»»Настенные светильники, бра
»»»»Светильники под лампу накаливания
»»»»Люминесцентные светильники
»»»Ночники
»»»Для ванной и туалета
»»»Для кухни
»»»Точечные светильники
»»»Настольные светильники
»»Светильники лофт
»»Диско шар
»»Для дачи
»»Для теплицы
»»Для бани и сауны
»»Для гаража и подвала
»»Для производства
»»Для офиса
»»Для склада и производства
»»Для улицы
»»»Кронштейны для уличных светильниов
»»Светильники для сада и парка
»»Для подсветки
»»Для спортивного зала
»»Для магазина
»»Переносные светильники
»»Аварийные светильники
»»Аккумуляторные светильники
»»Патроны к светильникам
»Светодиодная подсветка
»»Светодиодная подсветка потолка
»»»Светодиодная гибкая лента для помещений на самоклеющейся основе ULS-3528
»»» Светодиодная гибкая лента для помещений на самоклеющейся основе ULS-5050
»»»Светодиодная гибкая герметичная лента ULS-3528
»»»Светодиодная гибкая герметичная лента ULS-5050
»»»Драйверы для светодиодов
»»»Контроллеры для управления светодиодными источниками света
»»Светодиодная подсветка шкафа
»»Электронные трансформаторы
»Стабилизаторы напряжения
»»Однофазные стабилизаторы напряжения
»»Стабилизаторы напряжения напольные, электронные
»»Стабилизаторы напряжения настенные, релейные
»»Стабилизаторы напряжения настольные
»»Стабилизаторы напряжения электромеханические
»Низковольтная аппаратура
»»Автоматические выключатели
»»»Автоматы для проводов сечением до 25мм. »»»»Для дома, характеристика B
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы для проводов сечением до 35мм.
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы для проводов сечением до 50мм.
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы промышленные ВА88
»»УЗО
»»Дифференциальные автоматы
»»»Серия АВДТ 63
»»»Серия АВДТ 64 с защитой
»»»Дифавтоматы АД12, АД14
»»»Серия DX
»»Разрядники, ограничители импульсных перенапряжений
»»Выключатель нагрузки (мини-рубильник)
»»Предохранители
»»»Плавкие вставки цилиндрические ПВЦ
»»»Предохранители автоматические резьбовые ПАР
»»»Предохранители ППНН
»»Контакторы
»»»Контакторы модульные серии КМ63
»»»Контакторы малогабаритные КМН
»»»Контакторы КМН в оболочке IP54
»»Пускатели ручные
»Электроустановочные изделия
»»Выключатели
»»»Выключатели внутренние
»»»Выключатели накладные
»»Розетки
»»»Розетки внутренние
»»»»Серия INARI
»»»»Серия LARIO
»»»»Серия VATTERN
»»»»Серия MELAREN
»»»»Розетки, выключатели Legrand Valena
»»»Розетки накладные
»»»»Серия SUNGARY
»»»»Серия BALATON
»»»»Серия SAIMA
»»Коробки монтажные, подрозетники
»»»Монтажные коробки для открытой проводки
»»»Монтажные коробки для скрытой проводки
»»Удлинители электрические
»»»Удлинители бытовые
»»»Удлинители силовые
»»Сетевые фильтры
»»Тройники электрические
»»Вилки электрические
»»Силовые разъёмы
»»»Вилки переносные
»»»Розетки стационарные
»»»Розетки переносные
»»»Розетки стационарные для скрытой установки
»»»Вилки стационарные
»Щитовое оборудование
»»Корпуса к щитам электрическим
»»»Для помещения
»»»»Пластиковые боксы
»»»»»Боксы пластиковые навесные
»»»»»Боксы пластиковые встраиваемые
»»»»»Бокс КМПн
»»»»Металлические корпуса
»»»»»Щиты распределительные
»»»»»Щиты учётно-распределительные
»»»»»Щиты с монтажной панелью
»»»»»Щиты этажные
»»»»Шкафы напольные
»»»»»Сборно-разборные шкафы
»»»»»Моноблочные шкафы
»»»»»Аксессуары к шкафам
»»»Для улицы IP65
»»Электрощиты в сборе
»»»Ящики с понижающим трансформатором (ЯТП)
»»»Ящики с рубильником и предохранителями (ЯРП)
»»»Ящики с блоком «рубильник-предохранитель» (ЯБПВУ)
»»»Щитки осветительные (ОЩВ)
»»Аксессуры для шкафов и щитов
»»»Шина нулевая
»»»Шина нулевая на DIN-рейку в корпусе
»»»Шина N нулевая с изолятором на DIN-рейку
»»»Шина N нулевая, в изоляторе
»»»Шина N нулевая на угловых изоляторах
»»»Шина соединительная
»»»DIN-рейки
»Фонарики
»»Фонарики налобные
»»Фонари прожекторы
»»Фонари ручные
»»Фонари кемпинговые
»»Фонари с зарядкой от сети
»»Фонари для охоты
»Провод, Кабель
»»Кабель
»»»Кабель медный NYM (3-я изоляция, еврост.
»»»»Для дома, характеристика B
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы для проводов сечением до 35мм.
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы для проводов сечением до 50мм.
»»»»Для дома, характеристика C
»»»»Для производства, характеристика D
»»»Автоматы промышленные ВА88
»»УЗО
»»Дифференциальные автоматы
»»»Серия АВДТ 63
»»»Серия АВДТ 64 с защитой
»»»Дифавтоматы АД12, АД14
»»»Серия DX
»»Разрядники, ограничители импульсных перенапряжений
»»Выключатель нагрузки (мини-рубильник)
»»Предохранители
»»»Плавкие вставки цилиндрические ПВЦ
»»»Предохранители автоматические резьбовые ПАР
»»»Предохранители ППНН
»»Контакторы
»»»Контакторы модульные серии КМ63
»»»Контакторы малогабаритные КМН
»»»Контакторы КМН в оболочке IP54
»»Пускатели ручные
»Электроустановочные изделия
»»Выключатели
»»»Выключатели внутренние
»»»Выключатели накладные
»»Розетки
»»»Розетки внутренние
»»»»Серия INARI
»»»»Серия LARIO
»»»»Серия VATTERN
»»»»Серия MELAREN
»»»»Розетки, выключатели Legrand Valena
»»»Розетки накладные
»»»»Серия SUNGARY
»»»»Серия BALATON
»»»»Серия SAIMA
»»Коробки монтажные, подрозетники
»»»Монтажные коробки для открытой проводки
»»»Монтажные коробки для скрытой проводки
»»Удлинители электрические
»»»Удлинители бытовые
»»»Удлинители силовые
»»Сетевые фильтры
»»Тройники электрические
»»Вилки электрические
»»Силовые разъёмы
»»»Вилки переносные
»»»Розетки стационарные
»»»Розетки переносные
»»»Розетки стационарные для скрытой установки
»»»Вилки стационарные
»Щитовое оборудование
»»Корпуса к щитам электрическим
»»»Для помещения
»»»»Пластиковые боксы
»»»»»Боксы пластиковые навесные
»»»»»Боксы пластиковые встраиваемые
»»»»»Бокс КМПн
»»»»Металлические корпуса
»»»»»Щиты распределительные
»»»»»Щиты учётно-распределительные
»»»»»Щиты с монтажной панелью
»»»»»Щиты этажные
»»»»Шкафы напольные
»»»»»Сборно-разборные шкафы
»»»»»Моноблочные шкафы
»»»»»Аксессуары к шкафам
»»»Для улицы IP65
»»Электрощиты в сборе
»»»Ящики с понижающим трансформатором (ЯТП)
»»»Ящики с рубильником и предохранителями (ЯРП)
»»»Ящики с блоком «рубильник-предохранитель» (ЯБПВУ)
»»»Щитки осветительные (ОЩВ)
»»Аксессуры для шкафов и щитов
»»»Шина нулевая
»»»Шина нулевая на DIN-рейку в корпусе
»»»Шина N нулевая с изолятором на DIN-рейку
»»»Шина N нулевая, в изоляторе
»»»Шина N нулевая на угловых изоляторах
»»»Шина соединительная
»»»DIN-рейки
»Фонарики
»»Фонарики налобные
»»Фонари прожекторы
»»Фонари ручные
»»Фонари кемпинговые
»»Фонари с зарядкой от сети
»»Фонари для охоты
»Провод, Кабель
»»Кабель
»»»Кабель медный NYM (3-я изоляция, еврост. )
»»»Кабель медный силовой ВВГ-нг
»»»Кабель медный силовой ВВГ
»»»Кабель алюминиевый АВВГ, АВВГп
»»»Кабель бронированный
»»Провод
»»»Провод медный
»»»Провод медный осветительный ПУНП, ПУГНП
»»»Провод монтажный
»»»Провод медный гибкий соединительный ПВС
»»»Провод медный гибкий соединительный ШВВП (ПГВВП)
»»»Провод медный установочный ПВ
»»»Провод водопогружной ( ВВП)
»»»Провод алюминиевый
»»»Провод телефонный
»»»Провод ВВП
»Звонки дверные
»»Звонки беспроводные
»»»1 звонок + 1 кнопка
»»»1 звонок + 2 кнопки
»»»2 звонка + 1 кнопка
»»»1 звонок (вилка 220В) + 1кнопка (батарейка А23)
»»Звонки проводные
»Системы для прокладки кабеля
»»Кабельные каналы
»»Гофрированные трубы
»»»Аксессуары для труб
»»Металлорукав
»»»Аксессуары для металлорукава
»»»Металлорукав в ПВХ-изоляции
»»Труба ПВХ
»»»Аксессуары для труб
»»Лотки металлические
»Климатическое оборудование
»»Тепловые пушки и вентиляторы
»»»Тепловые пушки
»»»Масляные радиаторы
»»»Тепловентиляторы электрические
»»»»Керамические обогреватели
»»»»Спиральные обогреватели
»»Охлаждаемся, климатическое оборудование
»»»Кондиционеры напольные
»Инструмент, расходные материалы
»»Инструмент
»»Изоляция
»»»Термоусаживаемая трубка ТУТнг
»»»Изолента
»»Клеммы, зажимы
»»»Строительно-монтажная клемма КБМ
»»»Зажим винтовой ЗВИ
»»»Соединительный изолирующий зажим СИЗ
»»Хомуты, скобы
»»»Лента спиральная монтажная пластиковая ЛСМ
»»»Хомут нейлон
»»»Хомут полиамид
»»»Кабельный хомут с горизонтальным замком
»»»Скоба плоская
»»»Скоба круглая
»Умный дом
»»Датчики движения
»»Дистанционное управление
»»Фотореле
)
»»»Кабель медный силовой ВВГ-нг
»»»Кабель медный силовой ВВГ
»»»Кабель алюминиевый АВВГ, АВВГп
»»»Кабель бронированный
»»Провод
»»»Провод медный
»»»Провод медный осветительный ПУНП, ПУГНП
»»»Провод монтажный
»»»Провод медный гибкий соединительный ПВС
»»»Провод медный гибкий соединительный ШВВП (ПГВВП)
»»»Провод медный установочный ПВ
»»»Провод водопогружной ( ВВП)
»»»Провод алюминиевый
»»»Провод телефонный
»»»Провод ВВП
»Звонки дверные
»»Звонки беспроводные
»»»1 звонок + 1 кнопка
»»»1 звонок + 2 кнопки
»»»2 звонка + 1 кнопка
»»»1 звонок (вилка 220В) + 1кнопка (батарейка А23)
»»Звонки проводные
»Системы для прокладки кабеля
»»Кабельные каналы
»»Гофрированные трубы
»»»Аксессуары для труб
»»Металлорукав
»»»Аксессуары для металлорукава
»»»Металлорукав в ПВХ-изоляции
»»Труба ПВХ
»»»Аксессуары для труб
»»Лотки металлические
»Климатическое оборудование
»»Тепловые пушки и вентиляторы
»»»Тепловые пушки
»»»Масляные радиаторы
»»»Тепловентиляторы электрические
»»»»Керамические обогреватели
»»»»Спиральные обогреватели
»»Охлаждаемся, климатическое оборудование
»»»Кондиционеры напольные
»Инструмент, расходные материалы
»»Инструмент
»»Изоляция
»»»Термоусаживаемая трубка ТУТнг
»»»Изолента
»»Клеммы, зажимы
»»»Строительно-монтажная клемма КБМ
»»»Зажим винтовой ЗВИ
»»»Соединительный изолирующий зажим СИЗ
»»Хомуты, скобы
»»»Лента спиральная монтажная пластиковая ЛСМ
»»»Хомут нейлон
»»»Хомут полиамид
»»»Кабельный хомут с горизонтальным замком
»»»Скоба плоская
»»»Скоба круглая
»Умный дом
»»Датчики движения
»»Дистанционное управление
»»Фотореле

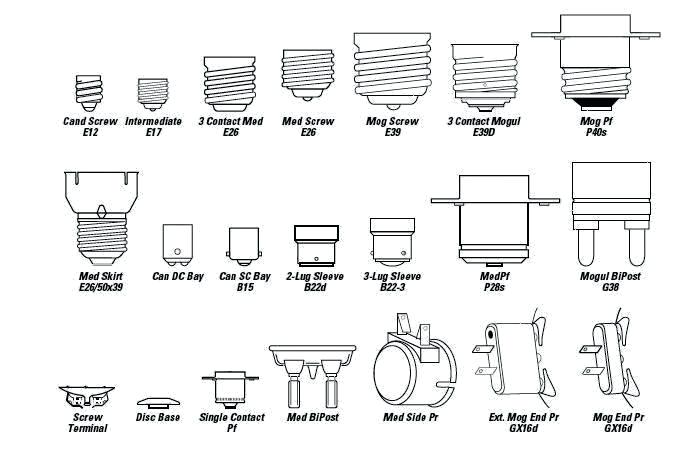
 Цифрами обозначают диаметр корпуса (S6, S7, S8,5).
Цифрами обозначают диаметр корпуса (S6, S7, S8,5).
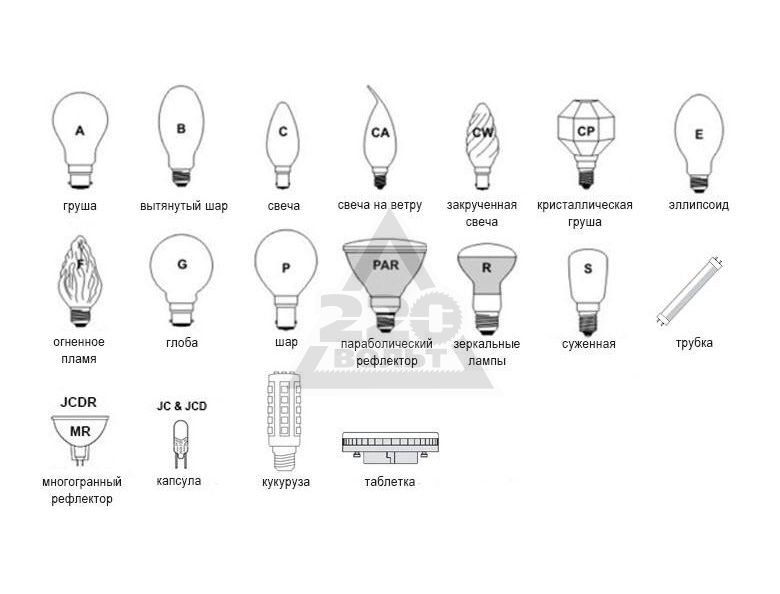

 Пример супероснования в гидриде натрия (NaH). Самым сильным супероснованием является дианион орто-диэтинилбензола (C 6 H 4 (C 2 ) 2 ) 2−.
Пример супероснования в гидриде натрия (NaH). Самым сильным супероснованием является дианион орто-диэтинилбензола (C 6 H 4 (C 2 ) 2 ) 2−..jpg)

 Активен в твердой форме. Диоксид кремния (SiO₂) и NaOH, нанесенные на оксид алюминия, являются примерами твердой основы.
Активен в твердой форме. Диоксид кремния (SiO₂) и NaOH, нанесенные на оксид алюминия, являются примерами твердой основы. Примеры
Примеры
 Д.
Д. Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках.
Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках. Антациды также можно использовать для снятия изжоги.
Антациды также можно использовать для снятия изжоги. Долить до отметки водой и хорошо взболтать.
Долить до отметки водой и хорошо взболтать. Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекали цвет из растения, кипятя его, а затем сливая жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полосок бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекали цвет из растения, кипятя его, а затем сливая жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полосок бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе. Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах к своему лицу.
Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах к своему лицу. (Также можно вылить воду через дуршлаг или сито.)
(Также можно вылить воду через дуршлаг или сито.) Или вы можете использовать меньшее количество полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Или вы можете использовать меньшее количество полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить. Запишите свои наблюдения. Повторите, используя базу.
Запишите свои наблюдения. Повторите, используя базу. Эссенция ванили и лук должны потерять свой характерный запах в базе.
Эссенция ванили и лук должны потерять свой характерный запах в базе.
 \ (X \) и \ (y \) представляют собой соотношение, в котором металл соединяется с оксидом, и зависит от валентности металла.
\ (X \) и \ (y \) представляют собой соотношение, в котором металл соединяется с оксидом, и зависит от валентности металла.

 Работайте в хорошо вентилируемом помещении.
Работайте в хорошо вентилируемом помещении.
 Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Это порошок хлорида натрия.
Когда этот раствор нагревали, было отмечено небольшое количество белого порошка. Это порошок хлорида натрия.