Состав для раствора: пропорции и как правильно разводить с песком
Как приготовить строительный раствор
Ни какая стройка сегодня не обходится без использование такого популярного стройматериала, как цемент. Для того, чтобы правильно приготовить цементный (строительный) раствор, нужно учитывать тот факт, что для разных работ он имеет как свой состав, так и способ приготовления. Так, разные составы раствора используются для кладки кирпича, отделки потолка или стен, стяжки пола и тд.
Из чего состоит цементный раствор?
Классический цементный раствор включаем в себя три компонента. Это цемент, песок и вода. Все эти компоненты смешиваются между собой в определенной пропорции, исходя из вида строительных работ. Так же следует отметить, что для приготовления строй.раствора используется не только ценент, но и бетон. Несмотря на схожесть этих двух компонентов, бетонный и цементный растворы позволяют решать разные строительные задачи. Кроме того, в бетонный раствор дополнительно к основным компонентам добавляется щебень.
Прежде, чем мы перейдем непосредственно к составам строительного раствора, обратим внимание на несколько важных моментов:
- Цемент для раствора должен быть сухим, без наличия твердых комков.
 Чтобы комки не образовывались – храните цемент в сухом и закрытом помещении.
Чтобы комки не образовывались – храните цемент в сухом и закрытом помещении. - Песок следует использовать, предварительно отчистив его от мусора и примесей. На практике часто используется карьерный, речной или обычный песок.
- Следует так же использовать и чистую воду комнатной температуры (20-25 градусов С).
Состав цементного раствора
Теперь перейдем непосредственно к замешиванию раствора. «Золотой серединой» считается состав с пропорциями 1:3 (цемент:песок). Вода добавляется по необходимости, после смешивания цемента и песка до однородной массы, а ее количество может достигать от 80% до 95% от используемого объема цемента в зависимости от требуемой консистенции (например, на 10л цемента должно приходиться 8-9,5л воды).
Такой раствор подойдет как для кирпичной кладки, так и для штукатурных работ. Однако, подобны состав имеет существенный недостаток – ограниченное время до его застывания. Поэтому часто в раствор добавляются различные вещества, увеличивающие время его твердения. Самый популярный из них – известковое молоко. С его использованием время использования приготовленного раствора увеличивается до 4 часов. В данном случае раствор разбавляется уже не водой, а приготовленным заранее известковым молоком. Альтернативный вариант – добавить в цементный раствор немного моющего средства (50-100г на 10л смеси). Подобная добавка не только увеличивает время затвердевания раствора, но и делает его более пластичным.
Самый популярный из них – известковое молоко. С его использованием время использования приготовленного раствора увеличивается до 4 часов. В данном случае раствор разбавляется уже не водой, а приготовленным заранее известковым молоком. Альтернативный вариант – добавить в цементный раствор немного моющего средства (50-100г на 10л смеси). Подобная добавка не только увеличивает время затвердевания раствора, но и делает его более пластичным.
Несмотря на то, что процесс кажется довольно простым, не всегда с первого раза получается замешать раствор нужной консистенции, даже следуя правилу 1:3. В таком случае, если по завершению приготовления раствора он оказался слишком тощим (жидким) – следует подсыпать в него еще цемента. Если же наоборот, раствор слишком жирный (густой) – добавить воду или песок, доводя до нужного состояния.
Немного о маркировках смеси
Следует учитывать тот факт, что приготовленный цементный раствор имеет свою маркировку. Так, бывают растворы с маркировками М10, М50, М100, М125, М500 и тд.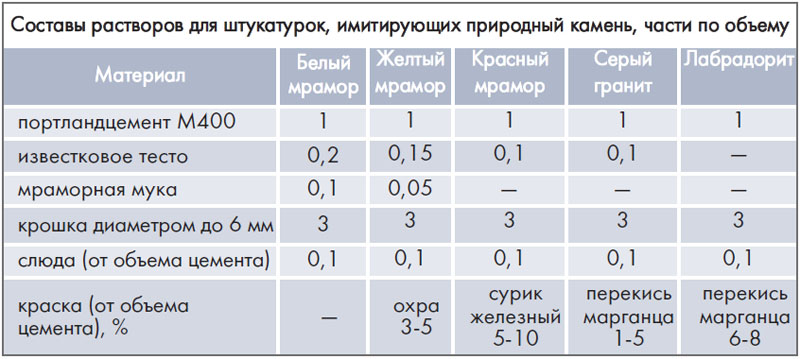 В частном строительстве обычно используются растворы марок М75 и М150.
В частном строительстве обычно используются растворы марок М75 и М150.
Маркировка готового раствора напрямую не зависит от марки цемента, используемого для его приготовления. Смесь одной марки всегда можно приготовить из разных марок цемента. Так, есть соотношение песка к цементу будет 3:1, то из марки М300 получится марка М100.
Профессиональные строители рекомендуют применять состав той же марки, что и используемый для строительства материал. Однако, на практике такое встречается редко. Например, если использовать кирпич М300 при выгонке стен, то нет смысла выбирать раствор той же марки, поскольку с таким раствором будет сложно работать, да и затраты на его изготовление окажутся выше.
Состав строительных растворов
Строительным раствором называют смесь, состоящую из вяжущего вещества (цемент, известь и прочее), инертных заполнителей (песок, шлак) и воды, добавленной в зависимости от потребной густоты раствора. Растворы применяют для связывания между собой камней, кирпичей и для штукатурных работ.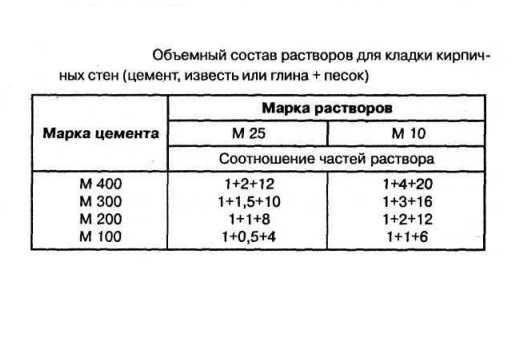 Их различают по ряду показателей.
Их различают по ряду показателей.
1. Объемный вес. Тяжелые растворы имеют объемный вес 1700-2200 кг/м3, а легкие или теплые растворы — до 1700
кг/м3. В последних песок заменен шлаком или другим инертным материалом, обладающим плохой теплопроводностью.
2. Механическая прочность. По механической прочности растворы характеризуют марками 2, 4, 10, 25, 50, 100 и выше.
Растворы делят на воздушные и гидравлические. Названия растворов — глиняные, известковые, цементные и смешанные, или сложные — зависят от вяжущего вещества входящего в их состав.
Состав раствора обозначают отношением количества вяжущего вещества к количеству инертного заполнителя по объему, например 1 : 3.
Известковые растворы обладают малой прочностью. Применяют их для кладки стен малоэтажных зданий. В зависимости от жирности извести, применяют составы растворов от 1 : 2 до 1 : 3, в объемных частях. Известь применяют в виде теста. В последнее время вместо него на строительстве используют молотую негашеную известь. Известковые растворы употребляют также и для штукатурки стен, но в связи с медленным схватыванием извести при штукатурных работах в них добавляют от 0,25 до 1 части строительного гипса на 1 часть известкового теста.
В последнее время вместо него на строительстве используют молотую негашеную известь. Известковые растворы употребляют также и для штукатурки стен, но в связи с медленным схватыванием извести при штукатурных работах в них добавляют от 0,25 до 1 части строительного гипса на 1 часть известкового теста.
Цементные растворы обладают большой прочностью, поэтому их применяют для кладки фундаментов, стен, столбов в сырых местах, при устройстве основания — стяжки по обрезу фундамента для гидроизоляции, а также при штукатурке сырых помещений. Состав растворов — от 1 : 2 до 1:8.
В связи с большой жесткостью цементного раствора к нему добавляют известковое или глиняное тесто.
Смешанный, или сложный, цементно-известковый или цементно-глиняный раствор бывает различного состава, в зависимости от марки цемента, — от 1 : 1 : 4 до 1 : 1 : 14. В этих формулах первым обозначен цемент, вторым — известь или глина и третьим — песок или шлак, в зависимости от теплопроводности раствора.
Глиняные растворы обладают малой прочностью. Их применяют при кладке печей, очагов и при штукатурке стен. В зависимости от жирности глины, применяют составы растворов от 1 : 2 до 1 : 3.
Их применяют при кладке печей, очагов и при штукатурке стен. В зависимости от жирности глины, применяют составы растворов от 1 : 2 до 1 : 3.
Кроме указанных выше растворов, в строительстве применяют для наружной отделки зданий штукатурные сухие терразитовые смеси, состоящие из окрашенных вяжущих и декоративных заполнителей. Терразитовая смесь, смешанная с водой, дает цветной штукатурный раствор. Составы и цвета терразитовых смесей подбирают по соответствующим таблицам.
Известковый раствор приготовляют в растворомешалке, куда закладывают известковое тесто, песок и добавляют воду. После перемешивания готовый раствор содержат в ящике и расходуют по мере надобности.
Цементные растворы приготовляют в растворомешалках в виде сухой смеси цемента с песком (гарцовка). Воду добавляют в цементный раствор на месте работ. Сухую смесь цемента с песком, или гарцовку, можно хранить не более одних суток.
Смешанные, или сложные, растворы приготовляют теми же способами.
Следующие статьи:
- Сортаменты лесоматериалов
- Местные строительные материалы
- Применение отделочных строительных материалов
- Болезни и вредители строительной древесины
- Изготовление и применение бетона
Предыдущие статьи:
- Основные виды цемента
- Виды вяжущих веществ
- Вяжущие вещества
- Виды строительных блоков
- Черепица и плитки
Дальше >>
4.
 3: Состав растворов
3: Состав растворов- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
Растворы представляют собой гомогенные смеси , содержащие один или более растворяет в растворителе . Растворитель, составляющий большую часть раствора, тогда как растворенное вещество — это вещество, растворенное внутри растворителя.
Единицы относительной концентрации
Концентрации часто выражаются в относительных единицах (например, в процентах) с обычно используемыми тремя различными типами процентных концентраций:
- Массовые проценты когда дана масса растворенного вещества и масса раствора: \[\text{Процент массы}=\dfrac{\text{Масса растворенного вещества}}{\text{Масса раствора}} \times 100\% \ ярлык{1}\]
-
- Процент массы/объема: Другой вариант процентной концентрации — это процент массы/объема, который измеряет массу или вес растворенного вещества в граммах (например, в граммах) по сравнению с объемом раствора (например, в мл).
 Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
\[\text{Масса/объем в процентах}= \dfrac{\text{Масса растворенного вещества (г)}}{\text{Объем раствора (мл)}} \times 100\% \label{3}\ ]
Рисунок использован с разрешения Википедии.
Пример \(\PageIndex{1}\): «Крепость» алкоголя как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как двойное процентное содержание алкоголя по объему (об./об.). называется доказательством. Какова концентрация алкоголя в спиртных напитках Bacardi 151 , которые продаются с крепостью 151 (отсюда и название)?
Рисунок: Почти пустая бутылка Bacardi 151. из Википедии.Раствор
Он будет иметь содержание спирта 75,5% (вес/вес) в соответствии с определением «пруф».
При расчете этих процентов единицы измерения растворенного вещества и раствора должны быть эквивалентными единицами (а весовые/объемные проценты (w/v %) определяются в граммах и миллилитрах).
| Вы НЕ МОЖЕТЕ подключить… | Вы НЕ МОЖЕТЕ подключить… |
|---|---|
| (2 г растворенного вещества) / (1 кг раствора) | (2 г растворенного вещества) / (1000 г раствора) |
| или (0,002 кг растворенного вещества) / (1 кг раствора) | |
| (5 мл растворенного вещества) / (1 л раствора) | (5 мл растворенного вещества) / (1000 мл раствора) |
| или (0,005 л растворенного вещества) / (1 л раствора) | |
| (8 г растворенного вещества) / (1 л раствора) | (8 г растворенного вещества) / (1000 мл раствора) |
| или (0,008 кг растворенного вещества) / (1 л раствора) |
Единицы концентрации разведения
Иногда, когда растворы слишком разбавлены, их процентная концентрация слишком мала. Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют
Таким образом, вместо использования очень низких процентных концентраций, таких как 0,00001% или 0,000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций аналогичен кулинарным рецептам. Например, в рецепте может быть указано, что нужно использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет использовать в уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо того, чтобы использовать количество рецепта «1 часть на десять», химики часто используют
- Части на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (так же, как 1 мг растворенного вещества и 1 л раствора), создаст очень маленькую процентную концентрацию. Поскольку раствор, подобный этому, был бы очень разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г/мл (но будет отличаться для разных растворителей).
 Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
- Частей на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз более разбавлен, чем 1 ppm. \[\text{1 ppb} = \dfrac{1\; \mu \text{g раствор}}{\text{1 л раствора}}\]
- Части на триллион : Как и в случае с ppb, идея частей на триллион (ppt) аналогична концепции частей на миллион.
 Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Пример \(\PageIndex{2}\): частей на миллион в атмосфере
Вот таблица с объемными процентами различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент массы отличается от состава по массе или состава по количеству молей.
| Название элемента | Объемный процент (об./об.) | частей на миллион (об/об) |
|---|---|---|
| Азот | 78. 084 084 | 780 840 |
| Кислород | 20,946 | 209 460 |
| Водяной пар | 4,0% | 40 000 |
| Аргон | 0,934 | 9 340 |
| Углекислый газ | 0,0379 | 379* (но быстро растет) |
| Неон | 0,008 | 8,0 |
| Гелий | 0,000524 | 5,24 |
| Метан | 0,00017 | 1,7 |
| Криптон | 0,000114 | 1,14 |
| Озон | 0,000001 | 0,1 |
| Моноксид азота | 0,00003 | 0,305 |
Единицы концентрации, основанные на молях
- Мольная доля : Мольная доля вещества – это доля всех его молекул (или атомов) от общего числа молекул (или атомов).
 Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\] - Мольные проценты : Мольные проценты (вещества A) выражены \(\chi_A\) в виде процентов. \[\text{Молярный процент (вещества A)}= \chi_A \times 100\%\]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора. \[M= \dfrac{\text{Моли растворенного вещества}}{\text{Литры раствора}}\]
- Моляльность : Моляльность (m) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \[m= \dfrac{\text{Моли растворенного вещества}}{\text{Килограммы растворителя}}\]
 50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.
50 мл дистиллированной воды (0 М), раствор гидроксида натрия 0,1 М и раствор соляной кислоты 0,1 М из group4swimmingpool.Уравнения молярности и моляльности отличаются только своими знаменателями. Однако это огромная разница. Как вы помните, объем зависит от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Поэтому молярности растворов также различаются при разных температурах. Это создает преимущество использования моляльности над молярностью. Использование моляльностей, а не молярностей для лабораторных экспериментов лучше всего удерживает результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, моляльность не зависит от температуры.
Пример \(\PageIndex{1}\)
В растворе содержится 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый/объемный процент растворенного вещества.
Раствор
Процент по массе
= (Масса растворенного вещества) / (Масса раствора) x 100%|
=(6,0508г) / (110,605г + 6,0508г) x 100%
=(0,0518688312) x 100%0025
Объемный процент
= (Объем растворенного вещества) / (Объем раствора) x 100 %
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100 %
= (0,0450791032 %)
=4,507914659%
Объемный процент = 4,51%
Масса/объемный процент
= (масса растворенного вещества) / (объем раствора) x 100% ) x 100 %
= (0,0520) x 100 %
= 5,205 %
Процент массы/объема = 5,2054 %
Пример \(\PageIndex{2}\)
Используя раствор, показанный на рисунке ниже, найдите молярный процент вещества C. (1mol C / 6.022×10 23 C molecules) = 8.30288941×10 — 24 mol C
Total Moles= (24 molecules) x (1mol / 6.022×10 23 molecules)= 3.98538691×10 — 23 моль всего
X C = (8,30288941×10 — 24 моль C) / (3,98538691×10 — 23 моль) = . 2083333333
2083333333
Процентный процент C
= X7 C4343434343888888888888). 100 %
= 20,83333333
Моль Процент C = 20 %
Пример \(\PageIndex{3}\)
1,5 л раствора состоит из 0,25 г NaCl. Найдите его молярность.
Раствор
Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (моль растворенного вещества) / (литры раствора)
= (0,004277MOL NaCl) / (1,5 л)
= 0,002851 М
Molarity = 0,0029M
. PageIndex{4}\) 0,88 г NaCl растворяют в 2,0 л воды. Найдите его моляльность. Моль NaCl= (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг / 1000 г) = 2,0 кг воды Моляльность = (моль растворенного вещества) / (кг растворителя) = (0,01506 моль NaCl) / (2,0 кг) = 0,0075290897 м 4.3: Композиция Решений распространяется по незаявленной лицензии и была создана, изменена и/или курирована LibreTexts. Раствор представляет собой гомогенную смесь. Растворы также могут быть получены путем смешивания многих различных фаз.
иметь значение. Например, воздух
решение. Растворенные газы выделяют кислород, углекислый газ, аргон, озон и
другие растворяются в
растворитель газообразный азот. Другой пример можно найти в «золотых» украшениях. Большинство
золотые украшения проданы
в мире не 24-каратное (т.е. 100% чистое золото), а скорее
раствор других металлов,
обычно серебро и медь в золотом растворителе. Такой раствор металла (ов)
в другом металле называется
амальгама. Пожалуй, самым важным свойством раствора является его концентрация.
Разбавленная уксусная кислота
раствор, также называемый уксусом, используется в кулинарии, в то время как концентрированный
раствор уксусной кислоты
убьет тебя, если проглотит. Единственная разница между такими решениями состоит в том,
концентрация
растворенный. Молярность, количество молей растворенного вещества на литр раствора, имеет
единицы моль / л, которые
сокращенно M. Эта единица является наиболее часто используемой мерой
концентрация. Это полезно
когда вы хотите знать количество молей растворенного вещества, когда вы знаете
как молярность, так и
объем раствора. Например, легко вычислить объем
раствора 1,5 М HCl, необходимой для полной реакции с 0,32 моль NaOH: Нормальность, количество молярных эквивалентов растворенного вещества на литр
решение, имеет единицы
эквивалентов / л, которые сокращенно N. Для иллюстрации
разница между молярностью и
нормальности предположим, что мы использовали 1,5 M раствор серной
кислота,
H 2 SO 4 вместо 1,5 М раствора
соляная кислота, HCl в
приведенный выше пример. Так как серная кислота может отдать два протона
NaOH, как указано в
, потребуется только вдвое меньше серной
кислота как соляная кислота
для нейтрализации гидроксида натрия. Раствор
Ссылки
 Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531
Общая химия: принципы и современные приложения. 8-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531 На этой странице нет тегов.
Состав растворов: Состав раствора
Введение в решения
 Это означает, что компоненты
решение настолько равномерно
распределены по всей смеси, что нет заметных различий в
сочинение. Решения могут
образуется при смешивании двух веществ, таких как сахар и вода. Если
ты насыпаешь пачку сахара
в стакан воды, изначально у вас взвесь в виде сахара
кристаллы плавают в стекле.
Когда вы будете перемешивать сахар и воду достаточно долго, вы
в итоге получить прозрачную бесцветную
смесь. Некоторых людей, особенно маленьких детей, можно обмануть таким
демонстрация в
думая, что сахар «исчез». Однако, как химики, мы знаем
лучше. Закон
Закон сохранения материи утверждает, что сахар не может просто так исчезнуть, он
должно быть, ушел куда-то еще.
Это где-то еще находится в решении. Сахар стал равномерным
рассеянный. На самом деле сахар
молекулы настолько хорошо распределены, что мы больше не можем видеть ни одного сахара
кристаллы. Однако, если вы
попробовав воду, вы обнаружите, что она сладкая, что подтверждает присутствие
сахар в воде.
второстепенный компонент раствора называется растворенным веществом.
Это означает, что компоненты
решение настолько равномерно
распределены по всей смеси, что нет заметных различий в
сочинение. Решения могут
образуется при смешивании двух веществ, таких как сахар и вода. Если
ты насыпаешь пачку сахара
в стакан воды, изначально у вас взвесь в виде сахара
кристаллы плавают в стекле.
Когда вы будете перемешивать сахар и воду достаточно долго, вы
в итоге получить прозрачную бесцветную
смесь. Некоторых людей, особенно маленьких детей, можно обмануть таким
демонстрация в
думая, что сахар «исчез». Однако, как химики, мы знаем
лучше. Закон
Закон сохранения материи утверждает, что сахар не может просто так исчезнуть, он
должно быть, ушел куда-то еще.
Это где-то еще находится в решении. Сахар стал равномерным
рассеянный. На самом деле сахар
молекулы настолько хорошо распределены, что мы больше не можем видеть ни одного сахара
кристаллы. Однако, если вы
попробовав воду, вы обнаружите, что она сладкая, что подтверждает присутствие
сахар в воде.
второстепенный компонент раствора называется растворенным веществом. В настоящее время
например, сахар является растворенным веществом.
Основной компонент раствора называется растворителем. В этом
случае вода является растворителем.
В настоящее время
например, сахар является растворенным веществом.
Основной компонент раствора называется растворителем. В этом
случае вода является растворителем. Состав растворов
 Для количественного определения концентрации растворов химики
придумали много разных
единицы концентрации, каждая из которых полезна для разных целей.
Для количественного определения концентрации растворов химики
придумали много разных
единицы концентрации, каждая из которых полезна для разных целей.

 Чтобы комки не образовывались – храните цемент в сухом и закрытом помещении.
Чтобы комки не образовывались – храните цемент в сухом и закрытом помещении. Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).
Примером может быть 0,9%(мас./об.) раствора \(NaCl\) в медицинских солевых растворах, который содержит 0,9 г \(NaCl\) на каждые 100 мл раствора (см. рисунок ниже). Процент массы/объема используется для выражения концентрации раствора, когда дана масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица концентрации не является истинной относительной единицей (например, процент), однако ее часто используют в качестве простой единицы концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса. Более того, поскольку плотность разбавленных водных растворов близка к 1 г/мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (составляя истинную относительную единицу измерения). (м/м)).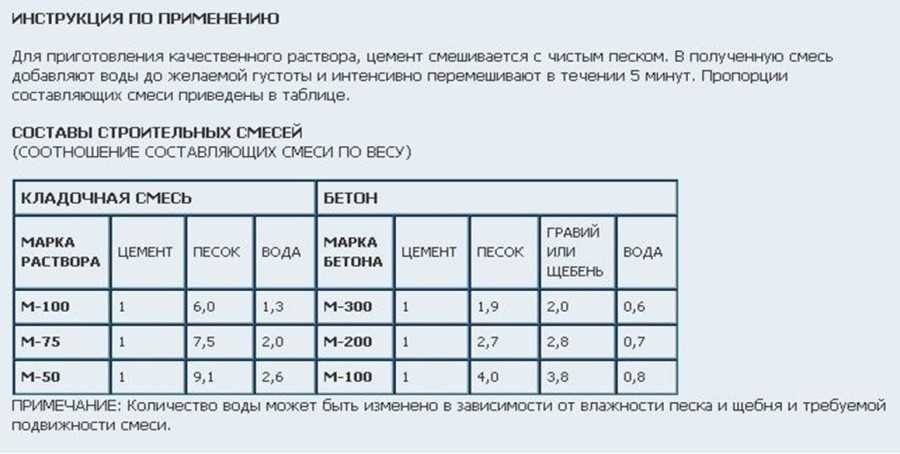 Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже).
Итак, после математических расчетов и преобразования миллилитров раствора в граммы раствора (при условии, что вода является растворителем): \[\dfrac{\text{1 г растворенного вещества}}{\text{1000000 мл раствора}} \times \dfrac {\text{1 мл}}{\text{1 г}} = \dfrac{\text{1 г растворенного вещества}}{\text{1000000 г раствора}}\] Получаем (1 г растворенного вещества)/(1000000 г решение). Поскольку и растворенное вещество, и раствор теперь выражаются в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \[\text{1 ppm}= \dfrac{\text{1 мг растворенного вещества}}{\text{1 л раствора}}\] Вместо этого можно использовать единицу ppm в терминах объем/объем (v/v). (см. пример ниже). Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]
Однако 1 ppt в 1000 раз более разбавлен, чем 1 ppb, и в 1000000 раз более разбавлен, чем 1 ppm. \[\text{1 ppt} = \dfrac{ \text{1 нг растворенного вещества}}{\text{1 л раствора}}\]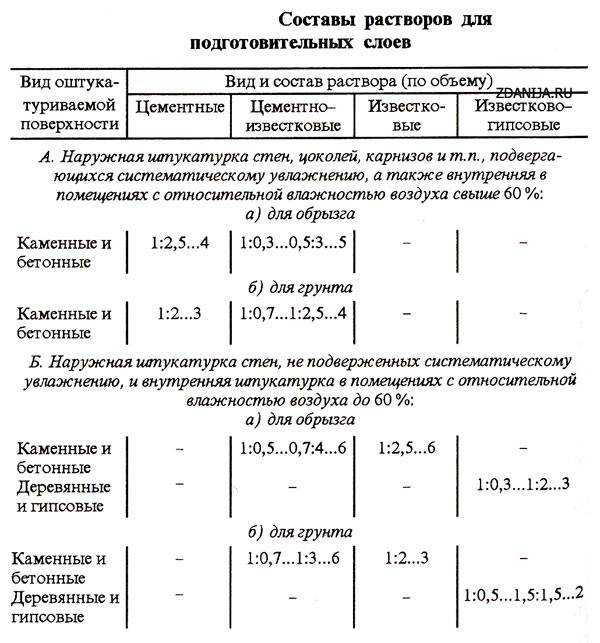 Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]
Это также может иногда пригодиться при работе с уравнением \(PV=nRT\). \[\chi_A= \dfrac{\text{количество молей вещества A}}{\text{общее количество молей в растворе}}\] Кроме того, имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \[\chi_A + \chi_B + \chi_C \;+\; … \;=1\]