Снип минимальная глубина заложения фундамента: СП 50-101-2004 Проектирование и устройство оснований и фундаментов зданий и сооружений
Глубина заложения фундаментов | Стройматериалы
Глубина заложения фундаментов является одним из основных факторов, обеспечивающих необходимую несущую способность основания.
Глубина заложения фундаментов должна определяться с учетом:
1. Назначения, а также конструктивных особенностей зданий и сооружений (например, наличие подвалов, подземных коммуникаций, фундаментов под оборудование и т. д.).
2. Величины и характера нагрузок и воздействий, действующих на основание.
3. Глубины заложения фундаментов примыкающих зданий и сооружений, а также оборудования.
4. Существующего и проектируемого рельефа застраиваемой территории.
5. Геологических условий площадки строительства (строительных свойств грунтов, характера напластований отдельных видов грунта, наличия слоев, склонных к скольжению; наличия пустот, образовавшихся вследствие выветривания, растворения солей; наличия пустот, засыпанных строительным мусором или насыпным грунтом и пр.).
6.
7. Принятой конструкции фундаментов и методов производства работ.
8. Возможности пучения грунтов при промерзании и осадки при их оттаивании.
Глубина заложения фундаментов из условия возможности пучения грунтов при промерзании указана в приведённой таблице.
Помимо пучения грунтов, залегающих в основании, необходимо считаться с возможностью выпучивания фундаментов вследствие смерзания боковой поверхности фундаментов с окружающим его пучащимся грунтом.
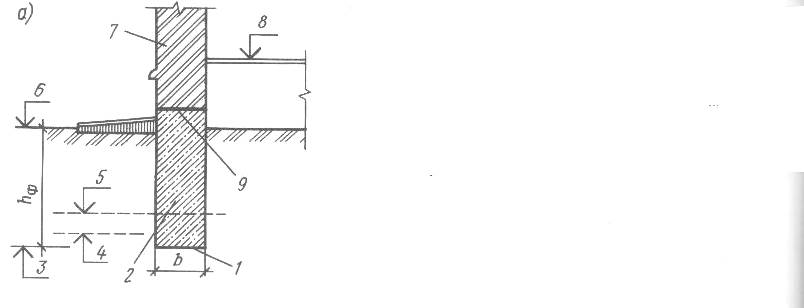
Глубина заложения фундаментов исчисляется от поверхности планировки или пола подвала до подошвы фундамента, т.е. нижней его поверхности, опирающейся на несущий слой грунта и передающей на него нагрузки. При наличии бетонной подготовки под фундаментом глубина заложения принимается до низа подготовки.
Минимальная глубина заложения фундаментов — 500 мм от поверхности земли может быть принята:
• для грунтов, где глубина заложения фундаментов (согласно таблице 6. 1, пп. 1, 2, 5) не зависит от глубины промерзания;
1, пп. 1, 2, 5) не зависит от глубины промерзания;
• для всех видов грунтов при малоэтажном строительстве без подвалов (одноэтажные жилые дома, хозяйственные постройки и т.п.). В этом случае фундаменты необходимо выполнить в виде непрерывной монолитной железобетонной ленты под всеми стенами с двойным непрерывным армированием в нижней и верхней зонах фундамента арматурой не менее 0 12АН (5 шт.). Стык арматуры выполнять внахлест не менее 30 диаметров арматуры (360 мм).
Растительный слой земли, который необходимо удалять, должен быть меньше 500 мм, при этом под подошвой фундаментов следует устроить песчаную подготовку толщиной 100—150 мм.
При выборе глубины заложения фундаментов в соответствии с инженерно-геологическими и гидрологическими условиями рекомендуется:
| № | Расстояние от поверх- | Глубина заложе- | |
п/п | ности планировки до | ния фундаментов | |
| Виды грунтов | уровня грунтовых вод | ||
в период промерзания | планировки | ||
грунтов | |||
1. | Скальные и крупно- | Не зависит от глубины | Не зависит |
| обломочные грунты; | залегания грунтовых | глубины | |
| пески гравелистые, | вод | промерзания | |
| крупные и средней | |||
| крупности | |||
| 2. | Пески | Превышает расчетную | То же |
| леватые; супеси | глубину промерзания | ||
| твердой | на 2 м и более | ||
| консистенции | |||
3. | Пески мелкие и | Менее расчетной глу- | Не менее расчет- |
| пылеватые; супеси, | бины промерзания или | ной глубины про- | |
| независимо от | превышает | мерзания | |
| влажности | чем на 2 м | ||
| 4. | Супеси пластичной | Не зависит от глубины | То же |
| и текущей | залегания грунтовых | ||
| консистенции | вод | ||
5. | Суглинки и глины с | Превышает расчетную | Не зависит от |
| консистенцией | глубину промерзания | глубины | |
| В < 0,5 | на 2 м | промерзания, | |
| 6. | Суглинки и глины | То же | назначается |
| мягкопластичной | согласно техниче- | ||
| консистенции | ским условиям | ||
| 7 | Суглинки и глины | Не зависит от глубины | Не менее расчет- |
| текучепластичной и | залегания грунтовых | ной глубины | |
| текучей | вод | промерзания | |
| консистенции | |||
8. | Суглинки и глины | Менее расчетной | То же |
| независимо от | глубины промерзания | ||
| консистенции | или превышает её менее чем на 2 м |
1. Выбирать несущие слои грунта с учетом его несущей способности, положения в напластовании геологического разреза и способа производства работ.
2. Предусматривать заглубление фундамента в несущий слой грунта на 10—50 см.
3. Не оставлять под подошвой фундамента слой грунта малой толщины, если строительные свойства грунта этого слоя значительно хуже свойств подстилающего слоя.
4. При заложении фундаментов ниже уровня грунтовых вод (с учетом его колебания) предусматривать методы производства работ, сохраняющих структуру грунта.
При заложении фундаментов ниже уровня грунтовых вод (с учетом его колебания) предусматривать методы производства работ, сохраняющих структуру грунта.
5. Если глубина заложения фундаментов по условиям несущей способности и деформируемости грунтов основания оказывается чрезмерно большой, целесообразно предусматривать специальные мероприятия по подготовке оснований или переходить на свайные фундаменты.
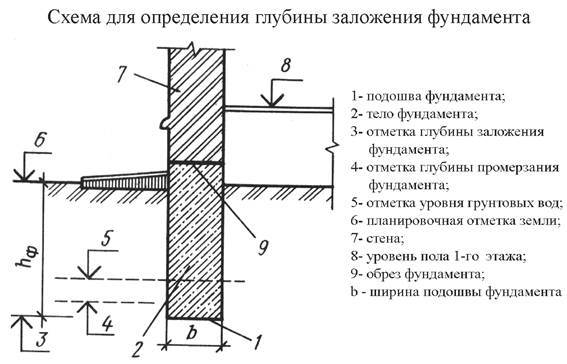
Для фундаментов, которые должны иметь глубину зало жения не менее расчетной глубины промерзания предусматриваются следующие мероприятия:
• глубина заложения фундаментов внутренних стен и колонн отапливаемых зданий и сооружений, считая от поверхности планировки земли, должна назначаться независимо от расчетной глубины промерзания грунтов при условии, если грунты основания в период строительства будут защищены от увлажнения и промерзания;
• глубина заложения фундаментов наружных и внутренних стен и колонн отапливаемых зданий и сооружений должна приниматься:
при холодных подвалах и технических подпольях (имею щих отрицательную температуру в зимний период времени) — не менее 0,5 Н (половины расчетной глубины промерзания), считая 0,5 Н от пола подвала или технического подполья;
при теплых подвалах и технических подпольях— вне зависимости от расчетной глубины промерзания грунта при условии его защиты в период строительства от увлажнения и промерзания;
• глубина заложения фундаментов наружных и внутренних стен и колонн неотапливаемых зданий и сооружений должна назначаться не менее расчетной глубины промерзания (И), считая её от пола подвала или технического подполья, а при отсутствии подвала или технического подполья — от поверхности планировки земли.
глубина заложения фундамента — расчет глубины
Содержание:
При обустройстве основания для дома нужно сначала провести необходимые расчеты. Так глубину определяют, основываясь на конкретных факторах. Важно учитывать, как проходят грунтовые воды, и как промерзает почва. Нужно ознакомиться со всеми особенностями, которые определяют фундамент мелкого заложения и глубокого, чтобы выполнить работу качественно.
Самые распространенные ошибки совершаемые при устройстве МЗЛФ
Мелкозаглубленный ленточный фундамент устанавливается на небольшой глубине, благодаря чему и получил свое название. Это удобный вариант при монтаже, но достаточно часто люди допускают элементарные ошибки при строительстве МЗЛФ.
Распространенные ошибки:
- Обустройство фундамента без расчета. Чтобы определить размер основания, нужно предварительно рассчитать все параметры.
- Бетонная заливка без предварительного обустройства песчано-гравийной подушки.
 Из-за этого земля прилегает к основанию и деформирует его.
Из-за этого земля прилегает к основанию и деформирует его. - Неправильное армирование. Нарушения могут наблюдаться как в выборе материала, так и в установке.
- Прерывание строительства. Нельзя оставлять фундамент незавершенным на зиму. Нужно обустроить основание за один сезон.
Эти элементарные ошибки можно легко предотвратить. Достаточно обратиться к профессионалам, которые быстро и качественно выполнят работу. Самостоятельно заложить фундамент без опыта и знаний будет сложно.
Как рассчитать мелкозаглубленный фундамент ленточного типа
Расчет глубины заложения фундамента выполняется с учетом веса дома и сопротивления почвы. Земля должна выдерживать массу строения, которая передается ей через основание.
Именно на грунт припадает вес всего дома, а не на фундамент, как некоторые ошибочно предполагают.
Самостоятельно выполнить заложение фундамента расчет достаточно сложно. Лучше доверить эту работу профессионалам. Также можно воспользоваться онлайн программами и специальными калькуляторами. Проблема расчетов в том, что требуются геолого-геодезические исследования. Это не бесплатная процедура, которую качественно сможет выполнить архитектор, который и проектирует дом.
Проблема расчетов в том, что требуются геолого-геодезические исследования. Это не бесплатная процедура, которую качественно сможет выполнить архитектор, который и проектирует дом.
Некоторые владельцы не выполняют никаких изысканий. Выбор оптимальных показателей они проводят по таблицам. Главное знать материалы, которые используются для строительства, и рыхлость почвы. Фундаменты глубокого заложения используются для пучинистого грунта. Для нормальной земли основания можно заглублять неглубоко.
Типы конструкций мелкозаглубленного фундамента
Мелкозаглубленный фундамент бывает монолитным и сборным. Ленточное основание рекомендуется выполнять по монолитной технологии. Для сборной конструкции потребуется сделать единый армирующий пояс.
Разновидности фундамента по типу сечения:
- Прямоугольные;
- В форме буквы «Т».
Первый вариант обладает меньшей несущей способностью. Его обычно используют для каркасных домов. Для больших коттеджей лучше использовать основание в форме буквы «Т». Этот фундамент обладает более широким основанием, что позволяет выдержать большие нагрузки.
Этот фундамент обладает более широким основанием, что позволяет выдержать большие нагрузки.
Нормы глубины установки МЗЛФ
Для правильного обустройства фундамента нужно выбрать оптимальную глубину заложения основания. Мелкозаглубленный фундамент для дома не закладывают глубоко. Обычно основание не достает уровня промерзания грунта.
Глубокая установка может стать причиной морозного пучения. Влага в грунте замерзает и начинает давить на конструкцию, деформируя ее. В основании появляются трещины. Именно поэтому фундамент мелкозаглубленный актуально использовать для непучинистой земли. Показатель глубины установки зависит от уровня промерзания.
Глубина заложения основания:
- Если уровень промерзания находится на глубине 2 м, то фундамент закладывается на глубине 50 см;
- Когда промерзание составляет 3 м, то глубина заложения составляет 75 см;
- Если уровень промерзания превышает 3 м, то фундамент закладывается на глубине 1 м.
При строительстве требуется учитывать уровень грунтовых вод. При их близком расположении к почве лучше отдать предпочтение глубокой закладке фундамента.
При их близком расположении к почве лучше отдать предпочтение глубокой закладке фундамента.
Минимальная глубина в зависимости от типа и глубины промерзания грунта
Заложение фундамента на определенную глубину выполняется с учетом многих факторов. Придется оттолкнуться и от минимальных норм заглубления основания. Наименьшие показатели определяются уровнем промерзания почвы, расположением грунтовых вод, коэффициента пористости.
Минимальная глубина заложения фундамента согласно СНиП:
- При глубине промерзания пучинистой почвы 1 м и непучинистой 2 м глубина заложения фундамента составляет 50 см;
- При глубине промерзания 1,5 и 3 м для непучинистой и пучинистой земли соответственно – 75 см;
- Для больших показателей используют минимальную глубину заложения 100 см.
Большая глубина промерзание и близкое расположение подземных вод увеличивают нагрузку при сезонном пучении. Именно поэтому потребуется оборудовать фундамент глубже.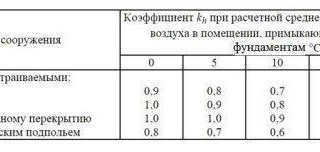 Но если правильно утеплить основание и обустроить дренажную систему, то показатель глубины может быть и небольшим.
Но если правильно утеплить основание и обустроить дренажную систему, то показатель глубины может быть и небольшим.
Взаимосвязь между глубиной заложения ленточного фундамента и УГВ
При определении глубины установки фундамента обязательно учитывают уровень грунтовых вод. Все особенности детально прописаны в санитарных нормах и правилах. Уровень подземных вод обязательно сопоставляются с промерзанием грунта. Именно от этих показателей зависит прочность фундамента.
Особенности укладки фундамента в зависимости от УГВ:
- При расположении подземных вод ниже уровня промерзания, то расчет проводят по стандартной схеме, учитывая только нагрузку на землю;
- Для мягкой почвы фундамент нужно закладывать ниже уровня подземных вод, дополнительно оборудовав дренажную систему;
- При высоком залегании почвенных вод нельзя использовать ленточный фундамент;
- На болотистой почве разрешено сделать основание только на сваях, которые заглубляются ниже уровня промерзания.

Если воды проходят высоко и при оборудованной дренажной системе, грунт будет оседать. Это особенно актуально для песчаной земли.
Способы уменьшить глубину промерзания грунта
Уменьшить показатель промерзания почвы можно, если выполнить утепление самого фундамента. Также обрабатывается земля с наружной стороны от основания. Процедуру выполняют с помощью пенополистирольных плит. Дли гидроляции нужно их обернуть в мембранную пленку. Количество утеплителя определяется общими климатическими условиями региона, уровнем прохождения грунтовых вод, толщиной фундамента и другими факторами.
Для утепления можно взять и другие материалы. Главное, чтобы они обеспечивали не только теплоизоляцию, но и необходимую прочность. Толщина слоя зависит от толщины утеплителя.
Песчаная или песчано гравийная подушка под фундаментом
Для оборудования подушки обычно используют песок или щебень. В обоих случаях придерживаются толщины в 20 см. Песок нужно намочить и утрамбовать. Для этого используется виброплита. Щебень укладывают последовательно, выполняя утрамбовку на каждом этапе.
Для этого используется виброплита. Щебень укладывают последовательно, выполняя утрамбовку на каждом этапе.
При оборудовании подушки сразу предусматривают дренажную систему. Ее устанавливают на уровне с подошвой. Дренаж должен представлять единую систему.
При заглублении фундамента на 40 см можно устранить пучение почвы. В этом случае потребуется дополнительное утепление наружной стороны основания. Для более глубокого залегания предусматривается утепление отмостки.
Материалы для оборудования щитов:
- Деревянная доска. Ее толщина должна быть не меньше 5 см. такой материал можно применять повторно, но сама установка занимает много времени.
- Многослойная фанера. Это прочный и влагоустойчивый материал, но дорогой.
- ОСП. После разбора опалубки материал можно применять повторно. Он обладает устойчивостью к влаге.
Лучше всего применять ОСП. Это прочный, недорогой и устойчивый материал. Другие варианты недолговечные или слишком дорогие. Древесину перед использованием нужно дополнительно обработать антисептическими средствами.
Фундаменты мелкого заложения используют чаще, ведь такое строительство не требуется много земляных работ. Но если грунтовые воды и промерзание земли не позволяют такого близкого обустройства, то потребуется сделать фундамент глубокого заложения. МЗЛФ можно установить на неблагоприятной земле, если дополнительно выполнить утепление, оборудовать дренах и песчано-гравийную подушку.
Видео по теме глубина заложения фундамента
1 глубина заложения фундамента
2 фундаменты мелкого заложения
Как определить глубину заложения фундамента
Уже на этапе оценки характера грунта стоит задуматься над тем, какой будет глубина заложения фундамента. От этого зависит не только объем земляных работ, но и будущие затраты на строительные материалы. В этой статье мы поговорим о том, на какую глубину копать фундамент, от чего стоит отталкиваться при выборе конкретных параметров будущего основания дома. При этом будем руководствоваться нормативным документом СНиП 2.02.01–83, с которым советуем ознакомиться и нашим читателям.
Определение глубины фундамента под дом
Если еще недавно большинство индивидуальных застройщиков стремилось к возведению загородных домов, в проекте которых обязательно должен был быть либо подземный гараж, либо подвал (что уже само по себе требовало большого заглубления фундамента), то сегодня переплачивать за такое удовольствие 15-20 тыс. $ мало кому хочется. Допустим, что с большой высотой фундамента над землей можно смириться – все-таки уже часть надземной постройки, а вот зарывать деньги в землю не всегда хочется. Поэтому в большинстве случаев все сводится к заглублению фундамента на достаточную минимальную глубину. От чего она зависит?
Что учитывается при расчете глубины заложения фундамента
Все тот же СНиП 2.02.01–83 определяет, на что стоит обращать внимание при выборе глубины заложения фундамента под дом:
- в первую очередь, на проект строящегося дома. Например, стоит рассчитать нагрузку на фундамент со стороны дома. О том, как это сделать, мы писали в этой статье;
- конечно же, самого пристального внимания требует грунт на стройплощадке, глубина промерзания грунта (ГПГ), а также уровень грунтовых вод (УГВ), который меняется сезонно;
- если рядом с уже построенным зданием планируется возведение иной постройки, то нужно руководствоваться иными правилами выбора глубины заложения основания. В статье «Фундамент для пристройки к дому» этот вопрос изложен достаточно подробно. Так же придают немалое значение глубине прокладки инженерных коммуникаций, которые не должны быть расположены ниже подошвы фундамента;
- многое зависит от рельефа территории, на которой находится стройплощадка
Расчет нормативной глубины сезонного промерзания грунта
В принципе, рассчитывать нормативную ГПГ вовсе необязательно. Можно, например, воспользоваться информацией, представленной на рисунке ниже и с достаточной степенью точности вычислить ГПГ для вашего участка.
А можно пойти по более сложному пути и воспользоваться следующей формулой:
d1=d0√M, где
d1 – искомое значение нормативной сезонной ГПГ;
d0 – величина, которая зависит от характера грунта. Так, для скальных и крупнообломочных грунтов она принимает значение 0,34 м, для крупных и средних песков – 0,3, для супесей и мелких песков – 0,28, для глин и суглинков – 0,23;
M – коэффициент, принимающий значение модуля среднемесячной отрицательной температуры за зиму. Например, в декабре средняя температура составила -10 °С, в январе – -16 °С, в феврале – -18°С. Тогда наш коэффициент М примет значение 14,7.
Для глинистого грунта, используя значение коэффициента М, полученное ранее, получаем:
d1=0,23×√14,7=0,88 м
Величина расчетной ГПГ
Однако полученное значение нормативной ГПГ не учитывает влияние теплового режима отапливаемого сооружения. А ведь в половине случаев загородная недвижимость используется и в зимнюю пору. Для расчета более точного значения ГПГ вводят соответствующий коэффициент, величина которого зависит от ряда факторов (см. таблицу ниже).
Тогда величина расчетной ГПГ будет определяться по следующей формуле:
d=k×d1
Обращаем ваше внимание, что для неотапливаемых зданий коэффициент k принимают равным 1,1. Это актуально для дачных построек и бань, которые используются только в теплую пору.
Глубина заложения фундамента в зависимости от УГВ и ГПГ
Глубина заложения фундаментов для наружных типов определяется от уровня планировки по таблице, представленной ниже. При этом учитывается значение расчетной ГПГ и УГВ.
В отдельных случаях, когда определено, что грунт на участке не отличается пучинистыми свойствами, например, на стройплощадке скальный или песчаный грунт, глубина заложения фундамента определяется исходя из проекта дома (с подвалом или без). В целом, даже для пучинистых грунтов можно обеспечить такие условия, что зимой почва под домом промерзать не будет и, соответственно, не будет никаких отрицательных последствий для сооружения.
То, на какую глубину «копать фундамент», зависит по большей части от характера грунта. На рисунке выше мы изобразили различные варианты заглубления, которые применяют на практике в индивидуальном строительстве. После того как выкопаете шурфы и исследуете грунт, сможете выбрать наиболее подходящий для вас вариант строительства основания дома, определить, какой будет высота и ширина фундамента.
Загрузка…Глубина заложения фундамента: расчет глубины
Возведение фундамента нередко съедает львиную долю общего бюджета строительства. И очень важно не потратить эти средства зря. Грамотно спроектированный базис обеспечит выстроенному дому долгую жизнь. Параметр глубины, на которую закладывают основание, является одним из важнейших в процессе проектирования.
Что такое глубина заложения фундамента?
Глубина заложения фундамента – это промежуток, на который опускается в грунт подземная честь базиса. Она находится в зависимости от целого комплекса факторов – качества грунта, уровня, на котором залегают потоки грунтовых вод, окружающих климатических условий и конструктивных особенностей постройки. Грамотный расчет глубины фундамента обеспечивает оптимальный расход материалов, надежность и прочность основания, а также его долговечность.
От чего зависит глубина заложения фундамента?
Определение глубины заложения фундамента – важнейший пункт на этапе проектирования будущего строительства. Закладка фундамента ниже необходимого уровня чревата двумя негативными последствиями:
- На возведение базиса потребуется больше стройматериалов, а это может существенно увеличить смету.
- Кроме того, увеличится поверхность, которая будет постоянно подвергаться воздействию подземных вод и морозному вспучиванию, что приведет к более быстрому изнашиванию основания.
Глубина заложения фундамента зависит от множества параметров. Но первое, на что следует обратить внимание, — это уровень, на котором промерзает почва. Склонность грунтов к морозному пучению приводит к образованию микротрещин внутри бетонных конструкций, деформации основания и просадке дома. Чтобы избежать подобных последствий, специалисты рекомендуют проектировать глубину залегания фундамента на 20см ниже уровня промерзания.
Данные о глубинах промерзания почв в различных регионах нашей страны можно найти в таблице. Причем следует отметить, что на этот параметр влияет не только температурные значения в зимний период, но и характер почвы.
Для расчета глубины заложения фундамента, безусловно, потребуется определить также тип грунта на стройплощадке. Для получения достоверных сведений следует обратиться к специалистам, которые произведут геологическое исследование и предоставят вам развернутые данные.
Помимо качества почвы, большое значение при расчетах также имеет нагрузка, оказываемая на фундаментную основу. Базис должен быть способен выдержать возведенное на нем здание и прослужить долгие годы.
Расчет глубины заложения фундамента по УГВ
Дать однозначный ответ на вопрос, какая, к примеру, требуется глубина фундамента для одноэтажного дома, невозможно. Расчет параметра осуществляют исходя из каждой конкретной ситуации.
Важным показателем при расчетах является отметка залегания подземных вод. Выяснить этот уровень можно самостоятельно, измерив расстояние от поверхности земли до уровня воды в колодце, расположенном вблизи стройки. Колодец должен быть максимально полным, брать из него воду перед измерением нельзя. Рекомендуется проводить данное исследование весной, когда вода находится наиболее высоко. При отсутствии колодца на территории можно также пробурить тестовую скважину.
Если говорить о том, какой глубины должен быть фундамент, отталкиваясь от таких измерений, то специалисты рекомендуют размещать базис выше разрушающих потоков подземных вод.
Нередки ситуации, когда противостоять силам пучения становится слишком затратно и бессмысленно. Тогда прибегают к обустройству мелкозаглубленного основания. Такой выбор оправдан в условиях песчаного грунта и уровня залегания подземных вод ближе 2м от поверхности.
В вопросе, на какую глубину копать фундамент, в этом случае рационально задуматься о мелкозаглубленной ленте или плите. Они «плавают» вместе со вспучивающимися грунтами, не подвергаясь разрушительному воздействию вод под землей.
Плитные фундаменты для одно- и двухэтажных зданий в таких условиях имеют толщину 0,3-0,35м.
Для большинства легких зданий из дерева и каркасных построек вполне достаточно ленты глубиной 0,6м. Однако если речь идет о тяжелой постройке из кирпичей, то такой опоры будет явно недостаточно. Потребуется либо углубить базис, либо сделать ленточное основание более широким, что не всегда рационально.
Если планируется возводить фундамент из пенобетонных или газобетонных блоков, то глубина фундамента даже для одноэтажного дома должна быть больше указанного выше параметра. Подвижный мелкозаглубленный базис может спровоцировать деформации, с которыми не справится данный материал.
Глубина заложения ленточного фундамента
Ленточный фундамент – один из самых популярных базисов в сфере частного строительства. Такие основания возводят на слабопучинистых грунтах однородного характера. Для переувлажненных почв такой тип фундамента не рекомендуется.
Ленточный фундамент по глубине заложения делится на мелкозаглубленный, средний и глубокого заложения.
- Предельная отметка глубины ленточного фундамента составляет 1,8м. Такие параметры используют в северных районах с суровым климатом.
- Минимальная глубина заложения фундамента – 0,5-0,6м – подходит для малопучинистого грунта.
- Далее в зависимости от разновидности грунта ленту заглубляют на 0,75-1,5м. Такими параметрами характеризуются средние и глубокозаглубленные фундаменты.
Если грунтовая вода в районе строительства располагаются глубже, чем промерзает почва, то это безусловный плюс. Допустим, в вашей местности почва промерзает на 150см, в данной ситуации минимальная глубина фундамента будет равна 75см.
Как рассчитать глубину фундамента столбчатого типа?
Столбчатые основания, как правило, используются в условиях почв с хорошими несущими свойствами. Возводимые на них постройки не должны быть массивными.
Определить глубину заложения фундамента на столбах можно, исходя из следующих правил:
В случае, когда грунт стабилен, кирпичное здание в один этаж можно возводить на столбах, заглубленных на 0,8м.
Если брать в расчет показатель промерзания грунта, то углублять опоры необходимо на 20-30см глубже данной отметки.
Основания свайного типа заглубляют как минимум на 130см.
Глубина фундамента для двухэтажного дома
Если говорить о том, как рассчитать глубину заложения фундамента в данной ситуации, то следует отметить, что на расчеты будут оказывать непосредственное влияние все указанные выше факторы. Такие здания относятся к малоэтажному строительству. В связи с этим при благоприятном климате и устойчивом типе грунта для них может подойти и базис мелкого заглубления.
Для ленточных оснований, расположенных на пучинистых грунтах, основание заглубляют обычно из расчета 0,8м на этаж.
Грубо глубина фундамента для двухэтажного дома рассчитывается следующим образом: N*0,8, где N – этажность постройки. Таким образом, фундамент следует заглубить на 160см.
Minium Depth of Foundation — по формуле Ренкина
Глубина фундамента — это самый важный расчет во всей конструкции. Всем известно, что в строительстве есть две основные категории фундаментов.
- Фундамент мелкого заложения
- Фундамент глубокий
Но знаете ли вы, чем метод фундамента отличается от других?
Все зависит от разных факторов. Здесь мы увидим
- Факторы, влияющие на глубину фундамента
- Формула минимальной глубины фундамента по Ренкина
- Какой угол срабатывания?
- Какая несущая способность грунта?
Факторы, влияющие на глубину фундамента
При проектировании глубины фундамента конструкции важную роль играют следующие факторы.
- Несущая способность грунта (выдерживающая нагрузка)
- Плотность почвы
- Уровень грунтовых вод
- Собственный вес конструкции (собственная нагрузка)
- Какая будет временная нагрузка? (Предположение)
- Ветровая нагрузка и сейсмическая нагрузка (землетрясение)
Минимальная глубина основания по формуле Ренкина
Формула минимальной глубины фундамента была изобретена Ренкином с учетом характеристик почвы.
Формула Ренкина
Df = P / γ (1-Sin Ⴔ / 1 + Sin Ⴔ) 2
Df — Минимальная глубина фундамента в метрах
П — Несущая способность грунта, кН / м 2
γ — Плотность грунта или удельный вес грунта в КН / м 3
Ⴔ — Угол естественного откоса грунта
Прежде, чем перейти к расчету примера.Давайте узнаем о несущей способности почвы и угле естественного откоса.
Что такое угол естественного откоса почвы?
Самый крутой угол по отношению к горизонтальной плоскости, под которым материал может складываться без оседания (как показано на рисунке ниже), известен как Угол откоса . Угол срабатывания должен находиться в диапазоне от 0 ° до 90 °.
Здесь мы перечислили различные типы угла естественного откоса почвы.
| # | ПОЧВА | УГОЛ ПОВОРОТА |
| 1 | Грязь | 0 ° |
| 2 | Мокрая глина | 15 ° |
| 3 | Мокрая Земля | 15 ° -17 ° |
| 4 | Сухая Земля | 20 ° -30 ° |
| 5 | Мокрый песок | 25 ° -26 ° |
| 6 | Консолидированная сухая земля | 30 ° |
| 7 | Сухой песок | 30 ° -35 ° |
| 8 | Глина сухая | 35 ° |
| 9 | Влажный песок и уплотненный сухой песок | 35 ° |
| 10 | Гравий | 40 ° |
| 11 | Щебень и влажная глина | 45 ° |
| 12 | Угольная зола | 40 ° -45 ° |
| 13 | Влага Земля | 45 ° -50 ° |
Какова несущая способность почвы?
Способность грунта выдерживать структурную нагрузку на грунт без разрушения при сдвиге или осадки называется безопасной несущей способностью грунта .
Здесь мы перечислили различные типы несущей способности грунта со значениями
| # | ТИП ПОЧВЫ | МОЩНОСТЬ кН / м² |
| 1 | Рыхлый гравий | 98 |
| 2 | Песок мелкий, рассыпчатый и сухой | 98 |
| 3 | Влажная глина | 147 |
| 4 | Глина средняя | 245 |
| 5 | Мелкий песок и ил | 245 |
| 6 | Мягкий рок | 441 |
| 7 | Гравийный песок | 441 |
| 8 | Крупный песок, компактный и сухой | 441 |
| 9 | Твердая глина | 451 |
| 10 | Остаточные отложения осколков и раздробленных коренных пород | 883 |
| 11 | Песок, известняк | 1618 |
| 12 | Твердый рок — Гранит, Дионит | 3236 |
Фактическая несущая способность и другие данные, относящиеся к почве, будут указаны в отчете исследования почвы.
Плотность почвенного списка приведена ниже
| # | ПОЧВА | ПЛОТНОСТЬ кг / м³ |
| 1 | Глина (сухая) | 1600 |
| 2 | Глина (влажная) | 1760 |
| 3 | Земля (сухая, рыхлая) | 1200 |
| 4 | Песок (сухой, рыхлый) | 1440-1700 |
| 5 | Гравий | 2000 |
| 6 | Ил | 2100 |
| 7 | Магматические породы (основные) | 3000 |
| 8 | Магматические породы (Felsic) | 2700 |
| 9 | Осадочные породы | 2600 |
| 10 | Метаморфические породы | 2700 |
| 11 | Грязь | 1600-1920 |
| 12 | Щебень | 1600-1750 |
Теперь давайте посмотрим на пример расчета глубины с использованием приведенного выше табличного значения.
Как рассчитать минимальную глубину, необходимую для фундамента в твердой глинистой почве?
Df = P / γ (1-SinΦ / 1 + SinΦ)
P- 451 кН / кв.м; γ — 1600 кг / м 3 ; Φ — 35
Глубина = (451 × 101/1600) x ((1-Sin35 °) / (1 + Sin35 °)) 2
= 2,10 м
Таким образом, нам потребовалась минимальная глубина 2,10 м для твердого скального грунта.
Это простой пример.При проектировании глубины фундамента необходимо учитывать следующие факторы.
- Статическая нагрузка, временная нагрузка и другие нагрузки (читайте о типах нагрузок)
- Если вам необходимо в будущем расширить здание, проектируйте соответственно.
- Соберите детали слоев почвы для точного расчета.
Счастливого обучения 🙂
Строительный кодекс Онтарио | Минимальная глубина фундаментов
9.12.2.2. Минимальная глубина фундаментов
(1) За исключением случаев, предусмотренных в предложениях (4) — (7), минимальная глубина фундаментов ниже готового уровня земли должна соответствовать таблице 9.12.2.2.
Таблица 9.12.2.2.
Минимальная глубина фундамента
, составляющая часть предложения 9.12.2.2. (1)
Элемент | Колонка 1 | Колонка 2 | Колонка 3 Колонка 3 | Колонна 5 | |
Тип грунта | Минимальная глубина фундамента Подогреваемый подвал или Подземное пространство (1) 4 Глубина | 9055 9055 Без обогреваемого помещения (2) ||||
Хороший почва дренаж | Плохая почва дренаж | Хорошая почва Хорошая дренаж | |||
1. | Порода | Без ограничений | Без ограничений | Без ограничений | Без ограничений |
2. | Без ограничений | Без ограничений | Без ограничений | Ниже глубины промерзания | |
3. | Ил | Без лимита | Без лимита | Ниже глубины промерзания (3) | Ниже глубины промерзания |
Глина или почвы четко не обозначены | 1,2 м (3) | 1.2 м | 1,2 м, но не менее глубины промерзания (3) | 1,2 м, но не менее глубины промерзания | |
Примечания к таблице 9.12.2.2 .:
(1) фундамент без теплоизоляции для уменьшения потерь тепла через опоры.
(2) Включая фундаменты , содержащие отапливаемые помещения, изолированные для уменьшения потерь тепла через фундаменты.
(3) Хороший грунт дренаж не менее глубины промерзания.
(2) Если фундамент изолирован таким образом, чтобы уменьшить тепловой поток к грунту под опорами, глубина фундамента должна соответствовать глубине, требуемой для фундамента без обогреваемого пространства .
(3) Минимальная глубина фундамента сек для наружных бетонных ступеней с более чем двумя стояками должна соответствовать Предложениям (1), (2) и (5).
(4) Бетонные ступени с 1 и 2 подступенками разрешается укладывать на уровне земли.
(5) Глубина фундамента , требуемая в Приложении (1), может быть уменьшена, если опыт работы с местными условиями грунта показывает, что меньшие глубины являются удовлетворительными, или если фундамент рассчитан на меньшую глубину.
(6) Фундамент Глубина , требуемая в предложении (1), не применяется к фундаменту сек для,
(a) зданий ,
(i), которые не являются каменными конструкция из облицовки каменной кладкой и
(ii), надстройка которой соответствует требованиям испытания на сопротивление деформации в CSA Z240.2.1, «Структурные требования к промышленным домам», или
(b) вспомогательные здания ,
(i) не из кирпичной кладки или облицовки из каменной кладки,
(ii) не более 1 этажей в строительной высоте ,
(iii) не более 55 м² на строительной площади и
(iv), где расстояние от готовой земли до нижней стороны балок перекрытия не более 600 мм.
(7) Фундамент Глубина , требуемая в предложении (1), не применяется к фундаментам для настилов и других доступных внешних платформ,
(a), которые имеют не более 1 этажей ,
(b) площадью не более 55 м²,
(c), если расстояние от готовой земли до нижней стороны балок перекрытия не превышает 600 мм,
(d), которые не поддерживают крыша и
(e), которые не прикреплены к другой конструкции, если не будет продемонстрировано, что дифференциальное движение не повлияет отрицательно на характеристики этой конструкции.
9.12.3. Засыпка
Обнаружение SNP посредством секвенирования следующего поколения и его приложений
Снижение стоимости наряду с быстрым прогрессом в секвенировании следующего поколения и связанных с ним вычислительных ресурсов биоинформатики облегчило крупномасштабное открытие SNP в различных модельных и немодельных видах растений. Большое количество и общегеномная доступность SNP делают их предпочтительным маркером в частично или полностью секвенированных геномах.Хотя были опубликованы отличные обзоры секвенирования следующего поколения, связанных с ним проблем биоинформатики и применения SNP в генетических исследованиях, необходим всеобъемлющий обзор, объединяющий эти три взаимосвязанные области исследований. Эта статья затрагивает различные аспекты открытия SNP, выделяя ключевые моменты в доступности и выборе подходящих платформ для секвенирования, конвейеров биоинформатики, критериев фильтрации SNP и применения SNP в генетическом анализе. Обсуждается использование методологий секвенирования следующего поколения для многих немодельных культур, что привело к открытию и внедрению SNP в различных генетических исследованиях.Разработка и улучшение программного обеспечения для биоинформатики с открытым исходным кодом и в свободном доступе ускорило обнаружение SNP при одновременном снижении связанных с этим затрат. Ключевые аспекты фильтрации SNP и связанных конвейеров обсуждаются в отдельных разделах. Список часто используемых программ и их источников составлен для легкого доступа и справки.
1. Введение
Молекулярные маркеры широко используются в генетических исследованиях и селекции растений. Полиморфизмы одиночных нуклеотидов (SNP) в настоящее время являются предпочтительным маркером из-за их большого количества практически во всех популяциях людей.Применение маркеров SNP было ясно продемонстрировано в геномике человека, где полное секвенирование генома человека привело к открытию нескольких миллионов SNP [1], и были разработаны технологии для анализа больших наборов SNP (до 1 миллиона). SNP применялись в самых разных областях, таких как судебная экспертиза [2] и диагностика [3], аквакультура [4], разведение молочного скота с помощью маркеров [5], улучшение урожая [6], сохранение [7] и управление ресурсами. в рыболовстве [8]. Функциональные геномные исследования основаны на SNP, локализованных в регуляторных генах, транскриптах и метках экспрессируемой последовательности (EST) [9, 10].До недавнего времени крупномасштабное открытие SNP у растений ограничивалось кукурузой, Arabidopsis и рисом [11–15]. Генетические приложения, такие как картирование сцеплений, структура популяции, исследования ассоциаций, клонирование на основе карт, селекция растений с помощью маркеров и функциональная геномика, по-прежнему становятся возможными благодаря доступу к большим коллекциям SNP. Arabidopsis thaliana был первым секвенированным геномом растения [16], вскоре за ним последовал рис [17, 18]. Только в 2011 году количество секвенированных геномов растений удвоилось по сравнению с числом секвенированных в предыдущее десятилетие, в результате чего в настоящее время имеется 31 секвенированный геном растений, публично обнародованный, если не считать этого, (http: // www.phytozome.net/). С постоянно увеличивающейся производительностью секвенирования следующего поколения (NGS), de novo , а также обнаружение и применение SNP на основе ссылок теперь возможно для многих видов растений.
Секвенирование относится к идентификации нуклеотидов в полимере нуклеиновых кислот, будь то ДНК или РНК. С момента своего создания в 1977 году секвенирование привело к возникновению области геномики и расширило наше понимание организации и состава геномов растений. Огромные улучшения в секвенировании привели к генерации большого количества информации о ДНК за очень короткий период времени [19].Анализ больших объемов данных, генерируемых с помощью различных платформ NGS, требует мощных компьютеров и сложных алгоритмов и привел к недавнему расширению области исследований в области биоинформатики. Эта глава книги посвящена открытию a priori SNP с помощью NGS, инструментам и ресурсам биоинформатики, а также различным последующим приложениям SNP.
2. История и развитие секвенирования Технологии
2.1. Изобретение секвенирования
В 1977 году были разработаны и опубликованы два метода секвенирования.Метод Сэнгера — это метод секвенирования путем синтеза (SBS), основанный на комбинации нуклеотидов-терминаторов цепи, меченных дезокси и дидезокси [20]. Первое полное секвенирование генома бактериофага phi X174 было выполнено в том же году с использованием этого новаторского метода [21]. Метод химической модификации с последующим расщеплением по определенным участкам, также опубликованный в 1977 году [22], быстро стал менее популярным из двух методов из-за его технических сложностей, использования опасных химических веществ и присущих ему трудностей в масштабировании.Напротив, метод Сэнгера, за который Фредерик Сэнгер был удостоен своей второй Нобелевской премии по химии в 1980 году, был быстро принят биотехнологической промышленностью, которая реализовала его с использованием широкого набора химических методов и методов обнаружения [19].
2.2. Технологии секвенирования
За последнее десятилетие новые технологии секвенирования превзошли секвенирование на основе Сэнгера по пропускной способности и общей стоимости, если не совсем по длине последовательности и частоте ошибок [23]. В этом разделе основное внимание будет уделено трем основным платформам NGS, а также двум основным платформам секвенирования третьего поколения (TGS), их пропускной способности и относительной стоимости.Мы приложили все усилия, чтобы обеспечить точность данных на момент отправки. Однако стоимость и пропускная способность этих платформ для секвенирования быстро меняются, и поэтому наш анализ представляет собой лишь моментальный снимок во времени. Поток инноваций в этой области требует постоянной оценки потенциала технологий и пересмотра исследовательских целей.
2.2.1. Roche (454) Sequencing
Пиросеквенирование было первой из новых высокопараллельных технологий секвенирования, появившихся на рынке [24].Его обычно называют секвенированием 454 по названию компании, которая первой выпустила его на рынок. Это метод SBS, при котором отдельные фрагменты ДНК гибридизуются с массивом улавливающих гранул, а гранулы эмульгируются с регентами, необходимыми для ПЦР-амплификации индивидуально связанной матрицы. Каждая гранула в эмульсии действует как независимая ПЦР, где производятся миллионы копий исходного шаблона и связываются с гранулами захвата, которые затем служат в качестве матрицы для последующей реакции секвенирования.Отдельные шарики помещаются в планшет для пикотитра вместе с ДНК-полимеразой, праймерами и ферментами, необходимыми для создания флуоресценции за счет потребления неорганического фосфата, образующегося во время секвенирования. Прибор промывает планшет для пикотитра по очереди каждым из оснований ДНК. Когда происходит специфичное для матрицы включение основания ДНК-полимеразой, образуется пирофосфат (PPi). Этот пирофосфат обнаруживается с помощью ферментативного люминометрического анализа неорганического пирофосфата (ELIDA) посредством генерации светового сигнала после превращения PPi в АТФ [25].Таким образом, лунки, в которые вводятся текущие нуклеотиды посредством реакции секвенирования, происходящей на шарике, излучают световой сигнал, пропорциональный количеству включенных нуклеотидов, тогда как лунки, в которые нуклеотиды не вводятся, не светятся. Прибор повторяет цикл последовательной промывки нуклеотидов сотни раз, чтобы удлинить последовательности. Платформа 454 GS FLX Titanium XL + в настоящее время генерирует до 700 МБ необработанных операций чтения 750 бит / с за 23 часа работы. Эта технология затрудняет количественное определение гомополимеров, приводящих к вставкам / удалениям, и имеет общий коэффициент ошибок около 1%.Стоимость реагентов составляет приблизительно 6200 долларов за цикл [26].
2.2.2. Секвенирование Illumina
Технология Illumina, приобретенная Illumina у Solexa, последовала за выпуском секвенирования 454. При таком подходе к секвенированию фрагменты ДНК гибридизуются с твердым субстратом, называемым проточной ячейкой. В процессе, называемом мостовой амплификацией, связанные фрагменты матрицы ДНК амплифицируются в изотермической реакции, при которой копии матрицы создаются в непосредственной близости от оригинала. В результате кластеры фрагментов ДНК на проточной кювете создают «лужайку» из связанных однонитевых молекул ДНК.Молекулы секвенируются путем заполнения проточной кюветы новым классом расщепляемых флуоресцентных нуклеотидов и реагентов, необходимых для полимеризации ДНК [27]. Комплементарная цепь каждой матрицы синтезируется по одному основанию за раз с использованием флуоресцентно меченных нуклеотидов. Флуоресцентная молекула возбуждается лазером и излучает свет, цвет которого различен для каждого из четырех оснований. Затем флуоресцентная метка отщепляется, и происходит новый цикл полимеризации. В отличие от секвенирования 454, все четыре основания присутствуют на стадии полимеризации, и только одна молекула включается за цикл.Флагманский прибор для секвенирования HiSeq2500 от Illumina может генерировать до 600 ГБ за цикл с длиной считывания 100 нт и коэффициентом ошибок 0,1%. Техника Illumina может генерировать последовательность из противоположных концов фрагмента ДНК, так называемые чтения с парным концом (PE). Стоимость реагентов составляет примерно 23 500 долларов США за цикл [26].
2.2.3. Applied Biosystems (SOLiD) Sequencing
Система SOLiD была совместно разработана Гарвардской медицинской школой и Медицинским институтом Говарда Хьюза [28]. Подготовка библиотеки в SOLiD очень похожа на Roche / 454, в которой популяции клональных шариков готовятся в микрореакторах, содержащих матрицу ДНК, шарики, праймеры и компоненты ПЦР.Гранулы, которые содержат продукты ПЦР, амплифицированные эмульсионной ПЦР, обогащаются запатентованным процессом. Матрицы ДНК на бусинах модифицированы на их 3′-конце, чтобы их можно было прикрепить к предметным стеклам. Праймер отжигают с адаптером на матрице ДНК, и смесь флуоресцентно меченных олигонуклеотидов закачивают в проточную ячейку. Когда олигонуклеотид совпадает с последовательностью матрицы, он лигируется с праймером, а не включенные нуклеотиды смываются. Камера устройства с заряженной парой (CCD) фиксирует различные цвета, прикрепленные к грунтовке.Каждая длина волны флуоресценции соответствует определенной комбинации динуклеотидов. После захвата изображения флуоресцентная метка удаляется, и новый набор олигонуклеотидов вводится в проточную ячейку, чтобы начать следующий раунд лигирования ДНК [19]. Этот метод секвенирования путем лигирования на платформе SOLiD-5500×1 генерирует до 1,410 миллионов считываний PE по nt каждое с частотой ошибок 0,01% и стоимостью реагента приблизительно 10 500 долларов США за цикл [26].
Несмотря на то, что платформы NGS широко распространены и используются, они страдают от смещений амплификации, вносимых ПЦР и дефазированием из-за различного расширения шаблонов.В технологиях TGS используется секвенирование одной молекулы, которое устраняет необходимость в предварительной амплификации ДНК, преодолевая ограничения, налагаемые NGS. Преимущества, предлагаемые технологией TGS: (i) более низкая стоимость, (ii) высокая пропускная способность, (iii) более быстрое выполнение и (iv) более длительное считывание [19, 29]. TGS можно в общих чертах разделить на три разные категории: (i) SBS, где отдельные нуклеотиды наблюдаются по мере их включения (Pacific Biosciences, одиночная молекула в реальном времени (SMART), истинное секвенирование одной молекулы Heliscope (tSMS) и Life Technologies / Starlight and Ion Torrent), (ii) секвенирование нанопор, при котором одиночные нуклеотиды обнаруживаются, когда они проходят через нанопору (Oxford / Nanopore), и (iii) прямое отображение отдельных молекул (IBM).
2.2.4. Helicos Biosciences Corporation (Heliscope) Секвенирование
Секвенирование Heliscope включает подготовку библиотеки ДНК и разрезание ДНК с последующим добавлением поли-А-хвоста к разрезанным фрагментам ДНК. Эти фрагменты ДНК с поли-A-хвостом прикрепляются к проточным клеткам через поли-Т-якоря. Секвенирование осуществляется путем удлинения ДНК с включением одного из 4 флуоресцентно меченных нуклеотидов с последующим обнаружением секвенатором Heliscope. Флуоресцентная метка на включенном нуклеотиде затем химически расщепляется, чтобы обеспечить последующее удлинение ДНК [30].Секвенсоры Heliscope могут генерировать до 28 ГБ данных последовательности за цикл (50 каналов) с максимальной длиной считывания 55 п.о. при 99% точности [31]. Стоимость одного запуска на канал составляет примерно 360 долларов.
2.2.5. Pacific Biosciences SMART Sequencing
Секвенсор Pacific Biosciences использует закрепленные на стеклянном якоре ДНК-полимеразы, которые размещены в нижней части волновода нулевого режима (ZMW). Фрагменты ДНК добавляются в камеру ZMW с заякоренной ДНК-полимеразой и нуклеотидами, каждый из которых помечен флуорофором разного цвета, и распространяются над ZMW.Поскольку нуклеотиды циркулируют через ZMW, только встроенные нуклеотиды остаются на дне ZMW, в то время как невключенные нуклеотиды диффундируют обратно над ZMW. Лазер, помещенный ниже ZMW, возбуждает только флуорофоры включенных нуклеотидов, поскольку ZMW улавливает свет и не позволяет ему достигнуть не включенных нуклеотидов выше [32]. Секвенсоры Pacific Biosciences могут генерировать до 140 МБ последовательностей за запуск (на каждую интеллектуальную ячейку) со скоростью чтения 2,5 Кбит / с при точности 85%.Стоимость одного запуска умной ячейки составляет примерно 600 долларов.
Среди технологий TGS, Pacific Biosciences SMART и Heliscope tSMS использовались для характеристики бактериальных геномов и в исследованиях, связанных с заболеваниями человека [31]; однако TGS еще предстоит использовать в геномах растений. Heliscope генерирует короткие считывания (55 п.н.), которые могут вызывать неоднозначное отображение считывания из-за наличия паралогичных последовательностей и повторяющихся элементов в геномах растений. Считывания Pacific Biosciences имеют высокий уровень ошибок, что ограничивает их прямое использование для обнаружения SNP.Однако их длинные чтения предлагают определенное преимущество для заполнения пробелов в геномных последовательностях и, по крайней мере, в бактериальных геномах, чтения NGS доказали свою способность «исправлять» ошибки вызова оснований этой технологии TGS [33–36]. Гибридные сборки, включающие короткие (Illumina, SOLiD), средние (454 / Roche) и длинные считывания (Pac-Bio), могут дать более качественные эталонные геномы и, как таковые, могут предоставить улучшенный инструмент для обнаружения SNP.
При выборе стратегии секвенирования необходимо учитывать цели исследования, способность хранить и анализировать данные, текущие изменения в параметрах производительности и стоимость платформ NGS / TGS.Некоторые ключевые соображения включают стоимость исходной базы, стоимость согласованной базы, исходную и согласованную точность баз, длину чтения, стоимость чтения и доступность PE или одностороннего чтения. Протоколы предварительной и постобработки, такие как создание библиотеки [37] и разработка и реализация конвейера для анализа данных [38], также важны.
2.3. РНК и ChIP Sequencing
Полногеномный анализ последовательностей РНК и их качественные и количественные измерения позволяют понять сложную природу регуляторных сетей.Секвенирование РНК было выполнено на ряде видов растений, включая Arabidopsis [39], сою [40], рис [41] и кукурузу [42] для профилирования транскриптов и обнаружения вариантов сплайсинга. Секвенирование РНК использовалось в сборках de novo с последующим открытием SNP на немодельных растениях, таких как Eucalyptus grandis [43], Brassica napus [44] и Medicago sativa [45].
Технологии глубокого секвенирования РНК, такие как цифровая экспрессия генов [46] и Illumina RNASeq [47], носят качественный и количественный характер и позволяют идентифицировать редкие транскрипты и варианты сплайсинга [48].Секвенирование РНК может быть выполнено после ее преобразования в кДНК, которая затем может быть секвенирована как таковая. Однако этот метод подвержен ошибкам из-за (i) неэффективной природы обратных транскриптаз (RT) [49], (ii) ДНК-зависимой ДНК-полимеразной активности RT, вызывающей ложную вторую цепь ДНК [50], и (iii) ) артефактный синтез кДНК из-за переключения матрицы [51]. Прямое секвенирование РНК (DRS), разработанное Helicos Biosciences Corporation, представляет собой высокопроизводительный и экономичный метод, который устраняет необходимость синтеза кДНК и лигирования / амплификации, что приводит к повышению точности [52].
Иммунопреципитация хроматина (ChIP) — это специализированный метод секвенирования, который был специально разработан для идентификации последовательностей ДНК, участвующих во взаимодействии in vivo белков с ДНК [53]. ChIP-секвенирование (ChIP-Seq) используется для картирования сайтов связывания факторов транскрипции и других сайтов связывания ДНК для белков, таких как гистоны. Таким образом, ChIP-Seq не способствует обнаружению SNP, но доступность данных SNP вместе с ChIP-Seq позволяет изучать аллель-специфические состояния организации хроматина.Глубокий охват последовательностей, приводящий к плотным картам SNP, позволяет идентифицировать сайты связывания транскрипционных факторов и гистон-опосредованные эпигенетические модификации [54]. ChIP-Seq может быть выполнен на основе серийного анализа тегов экспрессии генов (SAGE) или PE с использованием платформ Sanger, 454 и Illumina [55, 56].
Данные ДНК, РНК и ChIP-Seq анализируются с использованием эталонной последовательности, если таковая имеется, или, в случае отсутствия такой ссылки, требуется сборка de novo , все из которых выполняется с использованием специализированного программного обеспечения, алгоритмов, конвейеров, и оборудование.
3. Вычислительные ресурсы для сборки последовательностей
Платформы следующего поколения генерируют значительный объем данных, и влияние этого на хранение и время обработки данных можно не учитывать при разработке эксперимента. Исследования в области биоинформатики постоянно разрабатывают новое программное обеспечение и алгоритмы, подходы к хранению данных и даже новые компьютерные архитектуры, чтобы лучше соответствовать вычислительным требованиям для проектов, включающих NGS. В этой главе описывается современное состояние программного обеспечения для выравнивания и анализа NGS на момент написания.
3.1. Программное обеспечение для анализа последовательностей
Как коммерческое, так и некоммерческое программное обеспечение для анализа последовательностей доступно для операционных систем Windows, Macintosh и Linux. Компании NGS предлагают собственное программное обеспечение, такое как консенсусная оценка последовательности и вариации (Cassava) для данных Illumina и Newbler для данных 454. Такое программное обеспечение, как правило, оптимизировано для соответствующей платформы, но имеет ограниченную совместимость с другими. Веб-порталы, такие как Galaxy [57], приспособлены к множеству анализов, но требование передачи файлов многогигабайтных последовательностей через Интернет может ограничить их удобство использования небольшими наборами данных.Коммерчески доступное программное обеспечение, такое как CLC-Bio (http://www.clcbio.com/) и SeqMan NGen (http://www.dnastar.com/t-sub-products-genomics-seqman-ngen.aspx), обеспечивает удобный пользовательский интерфейс, совместимы с различными операционными системами, требуют минимальных компьютерных знаний и способны выполнять несколько последующих анализов. Однако они, как правило, относительно дороги, имеют узкую настраиваемость и требуют локально доступной высокой вычислительной мощности. Недавний обзор Wang et al. [58] рекомендует программы на базе Linux, потому что они часто бесплатны, не относятся к какой-либо платформе секвенирования, требуют меньше вычислительной мощности и, как следствие, имеют тенденцию работать быстрее.Гибкость выбора параметра для чтения сборки — еще одно важное преимущество. Однако большинство биологов незнакомы с операционными системами Linux, их структурой и командными строками, что требует значительного обучения для принятия. Программное обеспечение на базе Linux, такое как Bowtie [59], BWA [60] и SOAP2 / 3 [61], широко используется для анализа данных NGS. Другое программное обеспечение, возможно, не получило широкого распространения, но может иметь уникальные особенности, которые стоит отметить. Для обзоров программного обеспечения NGS см. Li and Homer [62], Wang et al.[58], а также Треанген и Зальцберг [63]. Характеристики наиболее распространенного программного обеспечения NGS и их атрибуты перечислены в таблице 1, а информацию об их загрузке можно найти в таблице 4.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коммерческое программное обеспечение. 2 Опция для сборки de novo и модули включены для вызова вариантов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Рекомендации по выбору программного обеспечения
При выборе программного обеспечения для анализа данных NGS необходимо учитывать, среди прочего, платформу секвенирования, доступность эталонного генома, необходимые вычислительные ресурсы и ресурсы хранения, а также имеющиеся знания в области биоинформатики. Алгоритмы, используемые для анализа последовательностей, значительно усовершенствовались, но все еще могут требовать вычислительной мощности, превышающей те, которые в настоящее время доступны в большинстве средств геномики, и / или длительного времени обработки.Например, при выравнивании 2 × 13326195 парных чтений (76 п.н.) из проекта Атлас генома рака (SRR018643) [64], SHRiMP [65] потребовалось 1065 часов с пиковым объемом памяти 12 гигабайт, чтобы достичь сопоставления 81 % считываний для эталона генома человека, тогда как Bowtie использовал 2,9 гигабайта памяти, время выполнения 2,2 часа, но достигал только 67% скорости отображения [58]. И время, и память становятся критическими при работе с очень большим набором данных NGS. Быстрое и эффективное отображение последовательности последовательностей, кажется, предпочтительнее более медленного, требовательного к памяти программного обеспечения, даже за счет снижения скорости отображения.Следует отметить, что более высокий процент отображенных считываний не является строгой мерой качества, потому что он может указывать на более высокий уровень несогласованных считываний или считываний, согласованных с повторяющимися элементами, что нежелательно [63].
В отсутствие эталонного генома сборка de novo генома растения достигается с использованием информации о последовательности, полученной с помощью комбинации клонов Сэнгера и / или NGS клонов бактериальной искусственной хромосомы (ВАС) или с помощью дробовика полногенома (WGS). ) с NGS [66].Сборки De novo отнимают много времени и требуют гораздо большей вычислительной мощности, чем чтение отображения на эталонный геном. Точность сборки частично зависит от длины и глубины считывания, а также от природы секвенированного генома. Геномы Arabidopsis thaliana [16], риса [67] и кукурузы [68] были созданы с использованием подхода BAC-by-BAC, в то время как геномные последовательности тополя [69], винограда [70] и сорго [71] были получен через WGS. Все секвенированные на сегодняшний день геномы фрагментированы в той или иной степени из-за неспособности технологий секвенирования и алгоритмов биоинформатики собрать с помощью высококонсервативных повторяющихся элементов.Список текущих проектов секвенирования генома растений, их стратегии секвенирования и статус от стандартного проекта до завершения можно найти в обзоре Feuillet et al. [72].
Для сборки de novo использовались такие программы, как Mira [73], SOAPdenovo [74], ABySS [75] и Velvet [76]. MIRA хорошо документирована и может быть легко настроена, но требует значительного объема вычислительной памяти и не подходит для больших сложных геномов. Из свободно доступных программ SOAPdenovo — одна из самых быстрых ассемблерных программ для чтения, и она использует сравнительно небольшой объем вычислительной памяти.Сборка, созданная SOAPdenovo, может быть использована для обнаружения SNP с использованием SOAPsnp, как это реализовано для генома яблока [77]. ABySS можно развернуть на компьютерном кластере. Он требует наименьшего объема памяти и может использоваться для больших геномов. Бархат требует наибольшего количества памяти. Он может использовать информацию о сопряженных парах для устранения и исправления ошибок сборки.
4. SNP Discovery
Наиболее частым применением NGS является обнаружение SNP, полезность которого для построения карт сцепления, анализа генетического разнообразия, ассоциативного картирования и селекции с помощью маркеров была продемонстрирована у нескольких видов [78].ОНП, происходящие из NGS, описаны у людей [79], Drosophila, [80], пшеницы [81, 82], баклажанов [83], риса [84–86], Arabidopsis [87, 88], ячменя [ 14, 89], сорго [90], хлопок [91], фасоль [78], соя [92], картофель [93], лен [94], Aegilops tauschii [95], люцерна [96], овес [97] и кукуруза [98] и многие другие.
Открытие SNP с использованием NGS легко достигается в геномах небольших растений, для которых доступны хорошие эталонные геномы, таких как рис и Arabidopsis [86, 99].Хотя открытие SNP в сложных геномах без эталонного генома, таких как пшеница [81, 82], ячмень [14, 89], овес [97] и бобы [78], может быть достигнуто с помощью NGS, некоторые проблемы остаются в других немоделях, но экономически важные культуры. Присутствие повторяющихся элементов, паралогов и неполных или неточных референсных последовательностей генома может создать неоднозначность в вызове SNP [63]. Отображение чтения NGS также может страдать от ошибки упорядочивания (ошибочный вызов базы) и неправильного чтения. В следующем разделе основное внимание уделяется программам, предназначенным для обнаружения SNP, и подчеркиваются некоторые меры предосторожности и соображения по минимизации ошибочного вызова SNP.
4.1. Программное обеспечение и конвейеры для обнаружения SNP
Теоретически SNP идентифицируется, когда нуклеотид из считанного образца отличается от эталонного генома в том же положении нуклеотида. В отсутствие эталонного генома это достигается путем сравнения считываний из разных генотипов с использованием стратегий сборки de novo [95]. Файлы сборки для чтения, созданные программами сопоставления, используются для выполнения вызова SNP. На практике для вызова SNP используются различные эмпирические и статистические критерии, такие как минимальное и максимальное количество считываний с учетом глубины чтения, показателя качества и базового отношения консенсуса для примеров [95].Пороги для этих критериев корректируются в зависимости от длины чтения и охвата генома, достигнутого данными NGS. В сгенерированных сборках, допускающих однонуклеотидные варианты и вставки / удаления (indels), создается список SNP и координат indel, а результаты сопоставления считывания могут быть визуализированы с помощью программ графического интерфейса пользователя, таких как Tablet [100] (рис. 1), SNP- VISTA [101] или Savant [102] (информацию для загрузки см. В Таблице 4). Планшет имеет удобный интерфейс и широко используется, поскольку он поддерживает широкий спектр широко используемых форматов файлов, таких как SAM, BAM, SOAP, ACE, FASTQ и FASTA, созданный различными ассемблерами чтения, такими как Bowtie, BWA, SOAP, MAQ. и SeqMan NGen.Он отображает обзор контигов, информацию о покрытии, считанные имена и позволяет искать определенные координаты на строительных лесах.
Широко используемое программное обеспечение для вызова SNP включает Samtools [103], SNVer [104] и SOAPsnp [74]. Samtools популярен благодаря своим различным модулям для преобразования файлов (SAM в BAM и наоборот), статистики сопоставления, вызова вариантов и визуализации сборки. В последнее время SOAPsnp приобрел популярность из-за его тесной интеграции с выравнивателем SOAP и другими модулями SOAP, которые постоянно обновляются и обеспечивают единое окно для непрерывного анализа последовательности.Алгоритмы вызова вариантов, такие как Samtools и SNVer, могут использоваться как автономные программы или встраиваться в конвейеры для вызова SNP. Опубликованы обзоры программ вызова SNP [63, 105]. Некоторые из основных функций текущего широко используемого программного обеспечения перечислены в таблице 2 (см. Таблицу 4 для информации о загрузке).

 Из-за этого земля прилегает к основанию и деформирует его.
Из-за этого земля прилегает к основанию и деформирует его.