Расход раствора на монтаж фбс: Норма расхода раствора на монтаж блоков фбс: пример расчета
Устройство фундамента ФБС, технологическая карта, план раскладки
Проектирование фундамента — обязательный процесс при возведении любого жилого, административного или промышленного сооружения. Без качественного и надежного основания невозможно гарантировать устойчивость конструкции, а значит и безопасность ее обитателей.
Сервис строительных расчетов и визуализации KALK.PRO, предоставляет возможность самому рассчитать все необходимые параметры и увидеть в режиме онлайн, как будет выглядеть ваш фундамент на чертежах и в виде 3D-модели.
Формулы для вычисления
Чтобы определить количество блоков ФБС для ленточного основания, необходимо разделить объем фундамента на объем одного блока.
- Для вычисления объема фундамента потребуется вначале рассчитать объем конструкции с учетом подвального помещения:
- V – общий объем;
- a – длина будущей постройки;
- b – ширина будущей постройки;
- h – высота фундамента.

Так, например, для дома 10м на 10м с высотой ленты 70 см расчеты будут выглядеть следующим образом:
2. Объем подвального помещения рассчитывается по той же схеме и вычитается из общего, чтобы получить значение для ленточного фундамента:
V фунд. = V общ. – V подв.
При Vподв. – 52 м3 будет получено следующее решение:
3. Определив V фундамента, можно рассчитать количество ФБС. Для этого необходимо Vфунд разделить на V одного изделия:
, где:
- K – количество ФБС;
- Vфунд – объем фундамента;
- Vбл. – объем одного изделия.
На примере это выглядит следующим образом:
18/0.3=60 блоков ФБС.
Если при расчетах получается дробное число, рекомендуется округлять его до целого в большую сторону. При наличии внутренних перегородок, их объемы вычисляются отдельно, т.к. в большинстве случаев для их возведения используются ФБС другой марки.
youtube.com/embed/-EJWRUqAQNs?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Особенности укладки
Укладывают изделия на бетонную смесь, толщина которой составляет 2 см. Чтобы качество швов получилось лучшим, раствор нужно выравнивать рейкой по периметру. Межблочные швы по вертикали и горизонтали заполняют раствором и расшивают с обеих сторон.
Стыки по вертикали во время монтажных работ заполняют бетоном, уплотнение производят методикой штыкования. Когда размеры длины фундаментных изделий не кратны длине сторон постройки, промежуточные зоны заполняют доборными элементами либо монолитными пломбами. При укладке, между блоками следует оставлять место для электропроводки и трубопровода.
В варианте, когда размер блока ленточного сборного фундамента тоньше, чем стена самого дома, по причине того, что надземная часть изготовлена из менее прочного стройматериала. По нормативам допустим свес стен постройки не больше 13 сантиметров.
Небольшие отклонения рекомендуется устранять, изделия передвигаются при помощи лома. Если блок установлен с отклонениями, которые превышают допустимую норму, его, следует выравнивать краном. Элемент поднимают, после отводят в сторону, основу выравнивают.
Установка фундаментных элементов на песок может привести в дальнейшем к проблемам, потому что песок подвержен размытию грунтовыми водами, что увеличивает риск возникновения перекоса постройки.
Инструкция к калькулятору
Исходные данные
Тип 1
Длина (L) — длина стены, которая будет набираться из блоков ФБС.
Ширина отверстий (K) — имеются в виду любые необходимые отверстия в стене. Например, продухи или отверстия для ввода коммуникаций. Здесь указывается общая их ширина.
Толщина блоков (t) — толщина используемых блоков. Индекс t означает в маркировке блока его толщину по схеме: если толщина блока равна 500 мм, то t=5.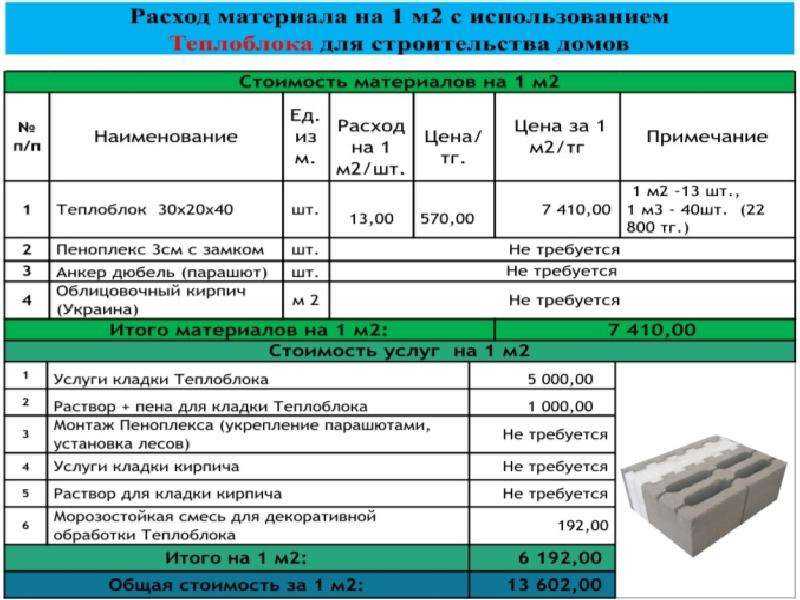
Марка блоков — размеры преобладающих по количеству блоков по формуле: длина — толщина — высота.
Цена за 1 шт — стоимость одного основного блока ФБС.
Доборные блоки — это блоки, которые применяются вместе с основными блоками с целью уменьшения кирпичной кладки.
Заделка отверстий — здесь отмечается, будет ли произведена заделка необходимых отверстий (отверстий шириной К) кирпичом.
Длина (А), ширина (В) и высота (Н) кирпича — размеры кирпича.
Цена за 1 шт — стоимость 1-го кирпича.
Тип 2
Здесь будет рассказано только о новых параметрах.
Наличие перевязки — имеется ли в данном ряду блоки, которые перевязываются со смежными стенами. Перевязывающие блоки показаны на рисунке крестиком.
Ширина отверстий (К1) и (К2) — общая ширина отверстий по первому и второму рядам.
Результат
Количество — требуемое количество основных блоков.
Стоимость — затраты на покупку основных фундаментных блоков ФБС.
Здесь тоже самое, что и про основные блоки.
Длина кладки (Р) — общая длина кирпичной кладки в ряду.
Общий объем (V) — общий объем кирпичной кладки.
Количество кирпичей — требуемое количество кирпичей вместе с раствором.
Стоимость кирпичей — затраты на покупку кирпичей.
Количество раствора — требуемое количество цементно-песчаного раствора на кирпичную кладку и монтаж блоков ФБС.
Общая стоимость — общие затраты на покупку рассматриваемых материалов.
Количество блоков
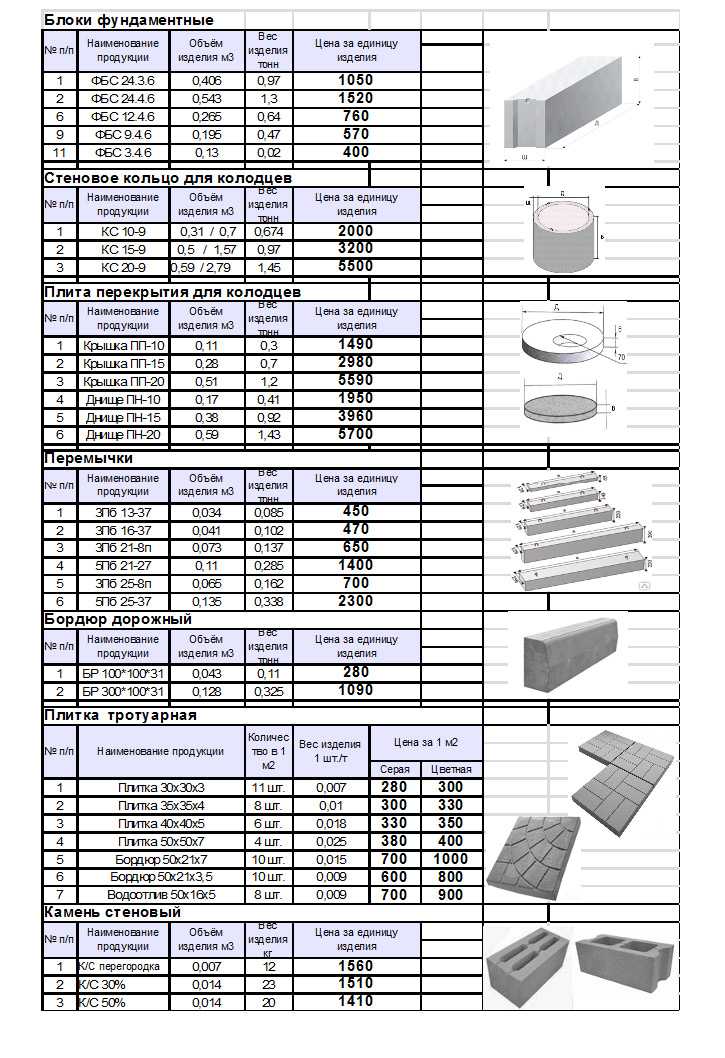
Расход фундаментных блоков зависит от их размеров.
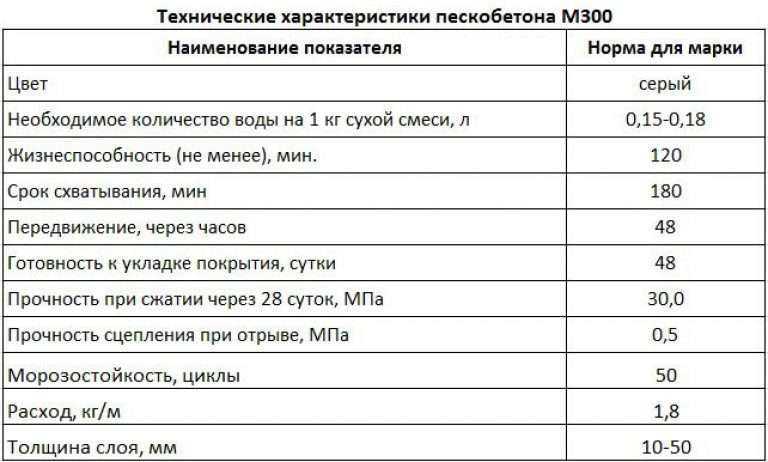
Итак, план утвержден и можно приступать к расчетам. Чтобы узнать, сколько нужно блоков для строительства, необходимо знать разновидности блоков. ФБС изготавливаются из песчано-цементного бетона марок М100 и М200, и ассортимент их достаточно велик, чтобы удовлетворить любые потребности. Их габариты, в зависимости от вида ФБС, указаны в таблице ниже. То, сколько уйдет блоков на постройку, зависит от габаритов отдельно взятого блока.
ФБС изготавливаются из песчано-цементного бетона марок М100 и М200, и ассортимент их достаточно велик, чтобы удовлетворить любые потребности. Их габариты, в зависимости от вида ФБС, указаны в таблице ниже. То, сколько уйдет блоков на постройку, зависит от габаритов отдельно взятого блока.
| Наименование ФБС | Длина, мм | Ширина, мм | Высота, мм | Масса, т | Объем, м3 |
| ФБС 24-3-6 | 2380 | 300 | 580 | 0,97 | 0,41 |
| ФБС 12-3-6 | 1180 | 300 | 580 | 0,49 | 0,21 |
| ФБС 9-3-6 | 880 | 300 | 580 | 0,35 | 0,15 |
| ФБС 24-4-6 | 2380 | 400 | 580 | 1,30 | 0,54 |
| ФБС 12-4-6 | 1180 | 400 | 580 | 0,64 | 0,27 |
| ФБС9-4-6 | 880 | 400 | 580 | 0,47 | 0,20 |
| ФБС 24-5-6 | 2380 | 500 | 580 | 1,63 | 0,68 |
| ФБС 12-5-6 | 1180 | 500 | 580 | 0,79 | 0,23 |
| ФБС 9-5-6 | 880 | 500 | 580 | 0,59 | 0,23 |
| ФБС 24-6-6 | 2380 | 600 | 580 | 1,96 | 0,82 |
| ФБС 12-6-6 | 1180 | 600 | 580 | 0,96 | 0,41 |
| ФБС 9-6-6 | 880 | 600 | 580 | 0,70 | 0,31 |
Чтобы расчитать, сколько блоков будет в фундаменте, нужно узнать его объем. Чтобы рассчитать объем кладки, достаточно длину всего фундамента умножить на его толщину и высоту. Итоговую цифру делят на объем одного блока, в результате чего получается количество блоков ФБС, необходимых для кладки. Если строительство предусматривает различную толщину кладки в разных ее отрезках, то необходимо произвести расчеты для каждого участка по предложенной формуле.
Чтобы рассчитать объем кладки, достаточно длину всего фундамента умножить на его толщину и высоту. Итоговую цифру делят на объем одного блока, в результате чего получается количество блоков ФБС, необходимых для кладки. Если строительство предусматривает различную толщину кладки в разных ее отрезках, то необходимо произвести расчеты для каждого участка по предложенной формуле.
Расход раствора на ФБС блоки:
V(раствора) = 0,07 х V (бет.) = 0,07х10,09м3 = 0,7м3;
m(раствора) =1,55m/м3 х 0,7м3 = 1,08 m;
до 0,5 т — 100 шт
ФГИС ЦС
Вход/Регистрация
Утверждены
Приказом Министерства строительства
и жилищно-коммунального хозяйства
Российской Федерации
от 26 декабря 2019 г.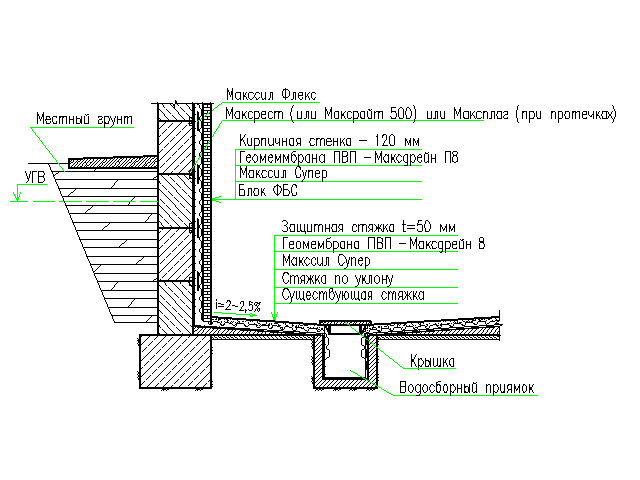 № 876/пр
№ 876/пр
Состав работ:
| 1. | Заполнение бетоном вертикальных каналов. |
| 2. | Промазка раствором вертикальных и горизонтальных швов. |
Ресурсы:
| Код | Наименование | К-во | Ед. |
|---|---|---|---|
| 1-100-32 | Затраты труда рабочих (Средний разряд — 3,2) | 47.6 | чел.-ч |
| 2 | Затраты труда машинистов | 19.24 | чел.-ч |
| 91.05.05-015 | Краны на автомобильном ходу, грузоподъемность 16 т | 2.41 | маш.-ч |
| 91.05.06-012 | Краны на гусеничном ходу, грузоподъемность до 16 т | 13.3 | маш.-ч |
| 91.14.02-001 | Автомобили бортовые, грузоподъемность до 5 т | 3.53 | |
| 04.3.01.09-0014 | Раствор готовый кладочный, цементный, М100 | 1.2 | м3 |
04. 1.02.05 1.02.05 | Смеси бетонные тяжелого бетона | 0.41 | м3 |
| 05.2.02.01 | Блоки бетонные для стен подвалов | 100 | шт |
Добавьте в избранное
Вы можете сравнивать 2 или 3 расценки из одной базы. Перейдите на страницу нужной расценки и нажмите кнопку «Добавить» — будет сформирована кнопка на страницу с результатом.
Все Расценки Таблицы
Таблица 07-05-001. Установка блоков стен подвалов
| Номер расценки | Наименование и характеристика работ и конструкций | чел./ч | маш./ч |
|---|---|---|---|
| ФЕР07-05-001-01 | Установка блоков стен подвалов массой: до 0,5 т — 100 шт | 47.6 | 19.24 |
| ФЕР07-05-001-02 | Установка блоков стен подвалов массой: до 1 т — 100 шт | 66.8 | 27.06 |
| ФЕР07-05-001-03 | Установка блоков стен подвалов массой: до 1,5 т — 100 шт | 93.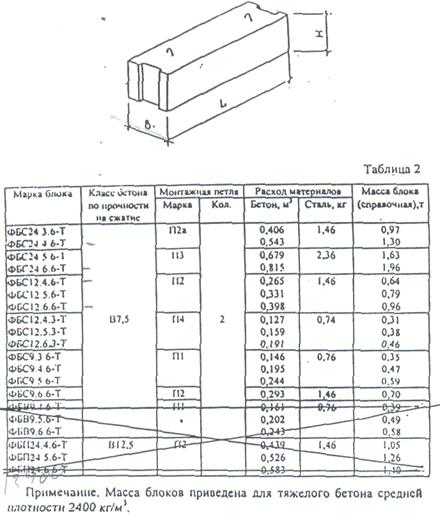 7 7 | 43.06 |
| ФЕР07-05-001-04 | Установка блоков стен подвалов массой: более 1,5 т — 100 шт | 118 | 65.44 |
| ФЕР07-05-001-05 | Установка блоков стен подвалов на растворе из сухой смеси массой: до 0,5 т — 100 шт | 49.3 | 19.75 |
| ФЕР07-05-001-06 | Установка блоков стен подвалов на растворе из сухой смеси массой: до 1 т — 100 шт | 69.13 | 27.74 |
| ФЕР07-05-001-07 | Установка блоков стен подвалов на растворе из сухой смеси массой: до 1,5 т — 100 шт | 97.88 | 44.28 |
| ФЕР07-05-001-08 | Установка блоков стен подвалов на растворе из сухой смеси массой: более 1,5 т — 100 шт | 123.9 | 67.17 |
| 91.14.02-001 | Автомобили бортовые, грузоподъемность до 5 т |
| 91.05.05-015 | Краны на автомобильном ходу, грузоподъемность 16 т |
91. 05.01-017 05.01-017 | Краны башенные, грузоподъемность 8 т |
| 91.01.01-035 | Бульдозеры, мощность 79 кВт (108 л.с.) |
| 91.06.06-048 | Подъемники одномачтовые, грузоподъемность до 500 кг, высота подъема 45 м |
| 01.7.04.01-0001 | Доводчик дверной DS 73 BC «Серия Premium», усилие закрывания EN2-5 |
| 20.3.03.07-0093 | Светильник потолочный GM: A40-16-31-CM-40-V с декоративной накладкой |
| 01.7.03.01-0001 | Вода |
| 04.3.01.12-0111 | Раствор готовый отделочный тяжелый, цементно-известковый, состав 1:1:6 |
| 14.5.01.10-0001 | Пена для изоляции № 4 (для изоляции 63-110 мм) |
Тестируем ФСНБ-2022
API расценок ФГИС ЦС
ФСНБ-2020 включая дополнение №9 (приказы Минстроя России от 20.12.2021 № 961/пр, 962/пр) действует с 01.02.2022
Нашли ошибку? Напишите в Техподдержку
Сельскохозяйственное программное обеспечение | Программное обеспечение для ферм
TransAction Plus
TransAction Plus
Используйте гибкую систему управленческой отчетности с полной главной бухгалтерской книгой, которая интегрируется с 16 другими модулями FBS.
УЗНАТЬ БОЛЬШЕ
Crop Audit Plus
Crop Audit Plus
Повысьте рентабельность с помощью этой комплексной системы управления растениеводством, которая включает управление запасами, производственные записи и анализ с эффективными функциями ввода данных.
УЗНАТЬ БОЛЬШЕ
Smart Feeder
Smart Feeder
Отслеживайте поголовье животных и отслеживайте движение корма по рациону между стадиями, локациями и группами. Включает контроль запасов кормов/скота, анализ производства и планирование.
УЗНАТЬ БОЛЬШЕ
Бюджет жизненного цикла
Бюджет жизненного цикла
Быстро создавайте прогнозы с помощью этой интерактивной программы базы данных, которая позволяет планировать и отслеживать производительность. Разработан для тесной интеграции с пакетом управляющей информации FBS.
УЗНАТЬ БОЛЬШЕ
Внутрифирменные данные/отчеты
Внутрифирменные данные/отчеты
Создание компенсирующих записей A/P и A/R между файлами данных FBS, ведение «главного» плана счетов, печать консолидированных данных отчеты о прибылях и убытках и балансы с колонками исключений.
УЗНАТЬ БОЛЬШЕ
Чеки и конверты
Чеки и конверты
Получите чеки с высокой степенью защиты и многоцелевые средние чеки, а также конверты различных стилей, все в одном месте.
УЗНАТЬ БОЛЬШЕ
Дебиторская задолженность
Дебиторская задолженность
Создавайте профессиональные счета и отчеты для ваших клиентов и арендодателей. Как и модуль AP, AR позволяет создавать отчеты как по наличным деньгам, так и по методу начисления.
УЗНАТЬ БОЛЬШЕ
TransAction Lite
TransAction Lite
Перейдите на экономичную систему сельскохозяйственного учета, предназначенную для менее сложных операций.
УЗНАТЬ БОЛЬШЕ
E Оплата
E Payment
(ACH Banking)
Создавайте онлайн-платежи через ACH и будьте экологичными, отказавшись от чеков, конвертов и марок.
УЗНАТЬ БОЛЬШЕ
Кредиторская задолженность
Кредиторская задолженность
Планирование платежей, пакетная печать чеков и создание отчетов по начислению без ущерба для налоговой отчетности по кассовому методу.
УЗНАТЬ БОЛЬШЕ
Заработная плата
Заработная плата
Отслеживайте сдельную работу, сверхурочные, бонусы, накопленные дни отпуска, пенсионные планы и многое другое с помощью самого гибкого пакета расчета заработной платы для сельского хозяйства на рынке.
УЗНАТЬ БОЛЬШЕ
Инвентарный реестр
Инвентарный реестр
Удобство ведения баланса TransAction Plus путем регистрации активов и запасов с помощью вспомогательных графиков, а не бухгалтерских проводок.
УЗНАТЬ БОЛЬШЕ
Контракты
Контракты
Отслеживайте состояние денежных средств или будущих контрактов для сельскохозяйственных культур, домашнего скота и ресурсов с помощью системы, которая легко интегрируется с покупками/продажами TransAction Plus и создает отчеты о позициях в Crop Audit, Smart Feeder и многом другом.
УЗНАТЬ БОЛЬШЕ
Отсканированные документы
Отсканированные документы
Легко сканируйте и связывайте PDF-документы с учетными переходами для быстрого заполнения и мгновенного вызова.
УЗНАТЬ БОЛЬШЕ
Генератор отчетов
Генератор отчетов
Создавайте пользовательские отчеты вместе с запросами к базе данных из TransAction Plus.
УЗНАТЬ БОЛЬШЕ
e.CLIPSE Управленческий учет
e.CLIPSE Управленческий учет
Знайте свои истинные затраты и финансовое положение в каждом сегменте вашего бизнеса с помощью автоматизированного расчета затрат на основе деятельности и корректировок незавершенного производства с версиями как для растениеводства, так и для животноводства.
УЗНАТЬ БОЛЬШЕ
Монитор стандартной стоимости/поставщика
Монитор стандартной стоимости/поставщика
Создайте инструмент для быстрого и всестороннего просмотра и корректировки распределений E.CLIPSE. Упаковано с отчетом об изменении запасов незавершенного производства.
УЗНАТЬ БОЛЬШЕ
Изменение запасов незавершенного производства
Изменение запасов незавершенного производства
С помощью этого модуля, который поставляется в комплекте с отчетом «Стандартная стоимость/Контроль поставщиков», создайте подробный поддерживающий балансовый график для готовой продукции, незавершенного производства и запасов сырья.
УЗНАТЬ БОЛЬШЕ
Ниже себестоимости/рынка
Ниже себестоимости/рынка
Пост-рыночная стоимость Корректировка запасов E.CLIPSE, а также вычисление и проводка минимальной стоимости/рынка.
УЗНАТЬ БОЛЬШЕ
Управляющий фермой/доверительным фондом
Управляющий фермой/доверительным фондом
Включает в себя специализированные бухгалтерские отчеты и отчеты для клиентов профессиональных фирм по управлению фермами и отделов банковских ферм.
УЗНАТЬ БОЛЬШЕ
MaCH 2.0 Precision Farming Interface
MaCH 2.0 Precision Farming Interface
Преобразование точных полевых данных в точные финансовые отчеты. MACH 2.0 экономит время, избегая двойного ввода данных, создает исчерпывающую историю полевых работ и многое другое.
УЗНАТЬ БОЛЬШЕ
Мобильный ввод данных
Мобильный ввод данных
Запись производственной деятельности прямо в поле через мобильное приложение Conservis. Храните все свои активы в одном месте, интегрируя финансовые и инвентарные записи FBS.
Храните все свои активы в одном месте, интегрируя финансовые и инвентарные записи FBS.
УЗНАТЬ БОЛЬШЕ
Интерфейсы заявок на зерно
Интерфейсы заявок на зерно
Упорядочивайте и импортируйте заявки на зерно из электронных продаж и электронных таблиц Excel с помощью этого удобного интерфейса.
УЗНАТЬ БОЛЬШЕ
Отслеживание группы
Отслеживание группы
Отслеживание важных производственных деталей с групповой идентификацией, учетом и отчетностью. Этот интерфейс имеет возможность полной интеграции с Smart Feeder и TransAction Plus.
УЗНАТЬ БОЛЬШЕ
Пользовательские отчеты о закрытии
Пользовательские отчеты о закрытии
Создавайте пользовательские отчеты о закрытии Smart Feeder с 500 предварительно рассчитанными измерениями, разработанными специально для аспектов финансового и производственного бизнеса.
УЗНАТЬ БОЛЬШЕ
Интерфейсы комбикормового завода
Интерфейсы комбикормового завода
Передача сведений о билетах на корм напрямую в TransAction Plus Accounts Payable и/или создание счетов к получению для продажи кормов, а также передача перемолотых кормов в Smart Feeder .
УЗНАТЬ БОЛЬШЕ
Интерфейсы упаковщиков
Интерфейсы упаковщиков
Создание и передача данных о продажах листов убоя, характеристиках туш и данных о распределении нагрузки из 10 форматов упаковщиков мяса в TransAction Plus.
УЗНАТЬ БОЛЬШЕ
Бюджет корма/доставки/прогноз продаж
Бюджет корма/доставка/прогноз продаж
Планируйте поставки кормов, отслеживайте бюджеты кормления групп и проектные продажи животных.
УЗНАТЬ БОЛЬШЕ
Smart Breeder
Smart Breeder
Предоставление полных генетических данных, данных о здоровье и репродуктивной истории отдельных свиноматок, хряков и пометов с помощью стандартных отраслевых отчетов.
УЗНАТЬ БОЛЬШЕ
Система финансового анализа Ferguson
Система финансового анализа Ferguson
Адаптация к проверенным показателям эффективности, используемым в других отраслях промышленности, для сельскохозяйственного производства. Автоматически рассчитывает 28 коэффициентов и индексов, включая запатентованную «Общую операционную выгоду».
Автоматически рассчитывает 28 коэффициентов и индексов, включая запатентованную «Общую операционную выгоду».
УЗНАТЬ БОЛЬШЕ
Коэффициенты финансовых стандартов ферм
Коэффициенты финансовых стандартов ферм
С легкостью создавайте коэффициенты и индексы «Sweet Sixteen» Совета по финансовым стандартам ферм.0005
УЗНАТЬ БОЛЬШЕ
Пакетные отчеты
Пакетные отчеты
Автоматически создавать отчеты, которые могут быть мгновенно доступны в репозитории и могут быть легко открыты в Excel или веб-браузере.
УЗНАТЬ БОЛЬШЕ
Информационная панель Pork Profit Center
Информационная панель Pork Profit Center
Обеспечьте «облачный» доступ в режиме реального времени к комплексным показателям производства, финансовой деятельности и продаж — не требуется настройка, обучение или ввод данных.
УЗНАТЬ БОЛЬШЕ
Импорт-экспорт
Импорт-экспорт
Импорт или преобразование из других программ, импорт счетов-фактур от поставщиков или периодических пакетных операций. Импортируйте учетные данные, поставщиков и записи об урожае из электронных таблиц или текстовых файлов.
Импортируйте учетные данные, поставщиков и записи об урожае из электронных таблиц или текстовых файлов.
УЗНАТЬ БОЛЬШЕ
Налоговые формы
Налоговые формы
Получите налоговые формы для форм W-2 и 1099 и даже подайте формы 1099 в электронном виде.
УЗНАТЬ БОЛЬШЕ
Альтернатива FBS в культуре клеток животных – обзор и перспективы
1. Лейст М., Бремер С., Брундин П., Хешелер Дж., Киркеби А., Краузе К.Х., Перцген П., Пуцеат М., Шмидт М., Шраттенхольц А., Зак Н.Б., Хенце Х. биологические и этические основы использования эмбриональных стволовых клеток человека для тест-систем in vitro или клеточной терапии. АЛЬТЕКС. 2008; 25: 163–190. [PubMed] [Google Scholar]
2. Пак Д.-Х., Ева Д.Дж. Регенеративная медицина: достижения в новых методах и технологиях. Мед. науч. Монит. Междунар. Мед. Дж. Эксп. клин. Рез. 2009; 15:RA233–R251. [Академия Google]
3. Yao T., Asayama Y. Среды для культивирования эмбрионов человека перед имплантацией: прошлое, настоящее и будущее.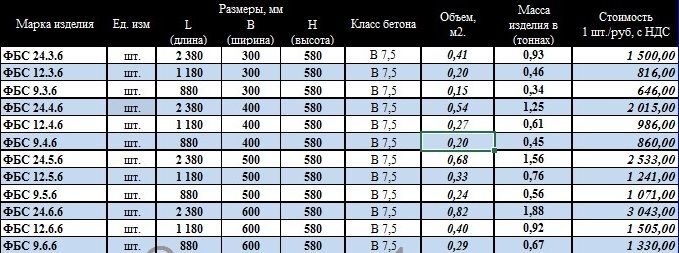 Дж. Мамм. Ова Рез. 2016; 33:17–34. [Google Scholar]
Дж. Мамм. Ова Рез. 2016; 33:17–34. [Google Scholar]
4. Puck T.T., Cieciura Steven J. Генетика соматических клеток млекопитающих∗ iii. Длительное культивирование эуплоидных клеток человека и животных. Дж. Эксп. Мед. 1958; 108: 945–956. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Фишер Гарольд В., Пак Теодор Т. Требования к молекулярному росту одиночных клеток млекопитающих: действие фетуина на прикрепление клеток к стеклу. проц. Натл. акад. науч. США 1958;44:4–10. [Статья бесплатно PMC] [PubMed] [Google Scholar]
6. Маурер Х.Р. На пути к бессывороточной среде с определенным химическим составом для культуры клеток млекопитающих. Аним. Культ Клетки. 1986: 13–31. https://ci.nii.ac.jp/naid/10027323360/en/ [Google Scholar]
7. Brunner D., Frank Jürgen, Appl Helmut, Schöffl Harald. Культура клеток без сыворотки: интерактивная онлайн-база данных без сыворотки. ALTEX-Альт. Аним. Эксп. 2010; 27:53–62. [PubMed] [Google Scholar]
8. Гстраунталер Г. , Линдл Т., Ван Дер Валк Дж. Призыв уменьшить или заменить эмбриональную бычью сыворотку в средах для культивирования клеток. Цитотехнология. 2013;65:791–793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Линдл Т., Ван Дер Валк Дж. Призыв уменьшить или заменить эмбриональную бычью сыворотку в средах для культивирования клеток. Цитотехнология. 2013;65:791–793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Андерсон Н.Л., Полански М., Пипер Р., Гатлин Т., Тирумалай Р.С., Конрадс Т.П., Веенстра Т.Д., Адкинс Дж.Н., Паундс Дж.Г., Фаган Р., Лобли А. Протеом плазмы человека. Мол. Клетка. Протеомика. 2004; 3: 311–326. [PubMed] [Google Scholar]
10. Андерсон Н.Л., Андерсон Н.Г. Протеом плазмы человека: история, характер и перспективы диагностики. Мол. Клетка. Протеомика. 2002; 1: 845–867. [PubMed] [Google Scholar]
11. Психогиос Н., Хау Д.Д., Пэн Дж., Го А.С., Мандал Р., Буатра С., Синельников И., Кришнамурти Р., Эйснер Р., Гаутам Б., Янг Н., Ся Дж., Нокс С., Донг Э., Хуанг П., Холландер З., Педерсен Т.Л., Смит С.Р., Бамфорт Ф., Грейнер Р., Макманус Б., Ньюман Дж.В., Гудфренд Т., Уишарт Д.С. Метаболом сыворотки человека. PloS Один. 2011;6 [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Yao T., Asayama Y. Среды для культивирования клеток животных: история, характеристики и современные проблемы. Воспр. Мед. биол. 2017;16:99–117. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Yao T., Asayama Y. Среды для культивирования клеток животных: история, характеристики и современные проблемы. Воспр. Мед. биол. 2017;16:99–117. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Ван Дер Валк Дж., Меллор Д., Брэндс Р., Фишер Р., Грубер Ф., Гстраунталер Г., Хеллебрекерс Л., Хилльнер Дж., Йонкер Ф.Х., Прието П., Тален М., Бауманс В. Гуманный сбор эмбриональной бычьей сыворотки и возможности для бессывороточных культур клеток и тканей. Токсикол. Витро. 2004; 18:1–12. [PubMed] [Академия Google]
14. Ван дер Валк Дж., Бруннер Д., Де Смет К., Фекс Свеннингсен О., Онеггер П., Кнудсен Л.Е., Линдл Т., Нораберг Дж., Прайс А., Скарино М.Л., Гстраунталер Г. Оптимизация среды для культивирования клеток с определенным химическим составом — замена эмбриональной бычьей сыворотки в методах in vitro для млекопитающих. Токсикол. Витро. 2010; 24:1053–1063. [PubMed] [Google Scholar]
15. Бриндли Д.А., Дэви Н.Л., Калм-Сеймур Э.Дж., Мейсон К., Смит Д.В., Роули Дж.А. Пиковая сыворотка: последствия поставок сыворотки для производства клеточной терапии. Реген. Мед. 2012;7:7–13. [PubMed] [Академия Google]
Пиковая сыворотка: последствия поставок сыворотки для производства клеточной терапии. Реген. Мед. 2012;7:7–13. [PubMed] [Академия Google]
16. Харрисон Р.Г., Гринман М.Дж., Молл Ф.П., Джексон К.М. Наблюдения за живым развивающимся нервным волокном. Анат. Рек. 1907; 1: 116–128. [Google Scholar]
17. Берроуз М.Т. Культивирование тканей куриного эмбриона вне организма. Варенье. Мед. доц. 1910; 55: 2057–2058. [Google Scholar]
18. Каррел А. Искусственная активация роста соединительной ткани in vitro. Дж. Эксп. Мед. 1913 г., 1 января; 17 (1): 14–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Эбелинг А. Х. Десятилетний штамм фибробластов. Дж. Эксп. Мед. 1922; 35: 755–759. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Eagle H. Питательные потребности клеток млекопитающих в культуре тканей. Наука. 1955 г., 16 сентября; 122 (3168): 501–504. [PubMed] [Google Scholar]
21. Waymouth C. Growth, Nutr. Метаб. Культ клеток. Эльзевир; 1972. Создание сред для культивирования тканей; стр. 11–47. [Google Scholar]
Создание сред для культивирования тканей; стр. 11–47. [Google Scholar]
22. Райан Дж.А. 2008. Введение в культуру клеток животных. Corning.http://catalog2.corning.com/lifesciences/media/pdf/intro_animal_cell_culture.pdf [Интернет]. Доступная форма: [Дата обращения: 01 мая 2016 г.] [Google Scholar]
23. Программа базы данных 3Rs Центра наук о жизни 3RS в Утрехте. https://fcs-free.org/fcs-%20database
24. Хаяси И., Сато Г.Х. Замена сыворотки гормонами обеспечивает рост клеток в определенной среде. Природа. 1976; 259: 132–134. [PubMed] [Google Scholar]
25. Филипик Б., Шехата М., Тот С., Шварцмайер Дж., Корен С. Новый заменитель сыворотки на основе бычьей глазной жидкости: полезный инструмент для культивирования различных животных клеток in vitro . АЛЬТЕКС Альтерн. Zu Tierexperimenten. 2002;19: 15–20. [PubMed] [Google Scholar]
26. Rathore G., Sood N., Swaminathan R. Первичная культура клеток из жабр и почек рыб с использованием рыбьей сыворотки. Индийский J.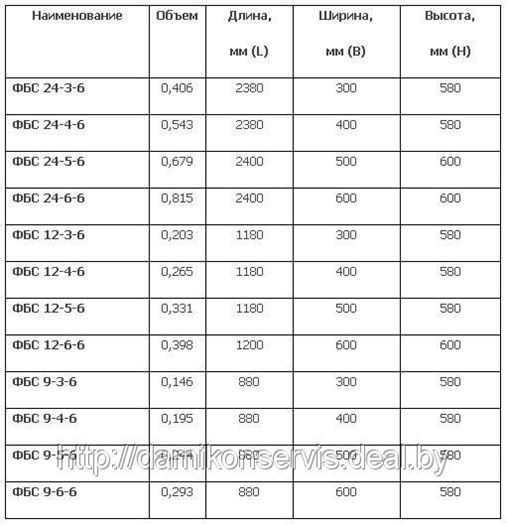 Exp. биол. 2001; 39: 936–938. [PubMed] [Google Scholar]
Exp. биол. 2001; 39: 936–938. [PubMed] [Google Scholar]
27. Пазос П., Бовери М., Дженнари А., Касадо Дж., Фернандес Ф., Прието П. Культивирование клеток без сыворотки: уроки, полученные с использованием молекул растительного происхождения. АЛЬТЕКС. 2004; 21: 67–72. [PubMed] [Google Scholar]
28. Liu L., Wang J., Duan S., Chen L., Xiang H., Dong Y., Wang W. Систематическая оценка белка серицина в качестве заменителя эмбриональной бычьей сыворотки в культуре клеток. науч. Отчет 2016; 6: 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Hartung A., Pazos T., Gennari P. Использование среды с добавлением молекул растительного происхождения для культивирования эпителиальных клеток. ALTEX-Альт. Аним. Эксп. 2003; 20: 175–176. [Google Scholar]
30. Челатурай Васанта Н., Раджагопалан К., Селван Кристирай Дж.Д., Суббиаханадар Челадурай К., Ганесан М., Ажагесан А., Раджаян Пушпабай Р., Мохан М., Селван Кристирадж Дж.Р.С. Инактивированная нагреванием целомическая жидкость дождевого червя Perionyx excavatus является возможным альтернативным источником эмбриональной бычьей сыворотки в культуре клеток животных. Биотехнолог. прог. 2019;35:1–6. [PubMed] [Google Scholar]
Биотехнолог. прог. 2019;35:1–6. [PubMed] [Google Scholar]
31. Freshney RI Cult. Аним. Клетки. Американское онкологическое общество; 2005. Бессывороточная среда. [Google Scholar]
32. Бродель С.Е., Папчак С.М. Случай бессывороточных сред. Биофарм Инт. 2003; 1:56–58. [Google Scholar]
33. Webster L., Stanbury R.M., Chignell A.H., Limb G.A. Молекула межклеточной адгезии стекловидного тела 1 при увеите, осложненном отслойкой сетчатки. бр. Дж. Офтальмол. 1998; 82: 438–443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Миллер Дж.В., Адамис А.П., Шима Д.Т., Д’Амор П.А., Моултон Р.С., О’Рейли М.С., Фолкман Дж., Дворак Х.Ф., Браун Л.Ф., Берс Б., Йео Т.К., Йео К.Т. Фактор роста эндотелия сосудов/фактор проницаемости сосудов во времени и пространстве коррелирует с глазным ангиогенезом в модели приматов. Являюсь. Дж. Патол. 1994; 145: 574–584. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Camiña J.P., Casabiell X.A., Pérez F.R., Lage M., Casanueva F. F. Выделение биоактивного Са2+-мобилизующего сложного липида из стекловидного тела крупного рогатого скота. Биохим. Биофиз. Рез. коммун. 1998;244:696–700. [PubMed] [Google Scholar]
F. Выделение биоактивного Са2+-мобилизующего сложного липида из стекловидного тела крупного рогатого скота. Биохим. Биофиз. Рез. коммун. 1998;244:696–700. [PubMed] [Google Scholar]
36. Варма В.П., Деви Л., Венна Н.К., Мурти С.Л.Н., Идрис М.М., Гоэл С. Глазная жидкость как замена сыворотке в средах для криоконсервации клеток. PloS Один. 2015; 10:1–17. [PMC free article] [PubMed] [Google Scholar]
37. Pothana L., Devi L., Venna N.K., Pentakota N., Varma VP, Jose J., Goel S. Замена сыворотки глазной жидкостью для криоконсервации незрелые яички. Криобиология. 2016;73:356–366. [PubMed] [Академия Google]
38. Пауль Дж. Вальтер де Грюйтер ГмбХ и Ко КГ; 2019. Zell-und Gewebekulturen. [Google Scholar]
39. Терада С., Нисимура Т., Сасаки М., Ямада Х., Мики М. Серицин, белок, полученный из шелковичных червей, ускоряет пролиферацию нескольких клеточных линий млекопитающих, включая гибридому. Цитотехнология. 2002; 40:3–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Мартинес-Мора К., Мровец А., Гарсия-Вискайно Э.М., Алькарас А., Сенис Дж.Л., Николас Ф.Дж. Фиброин и серицин из шелка Bombyx mori стимулируют миграцию клеток посредством активации и фосфорилирования c-Jun. PloS Один. 2012;7 [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мартинес-Мора К., Мровец А., Гарсия-Вискайно Э.М., Алькарас А., Сенис Дж.Л., Николас Ф.Дж. Фиброин и серицин из шелка Bombyx mori стимулируют миграцию клеток посредством активации и фосфорилирования c-Jun. PloS Один. 2012;7 [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Наяк С., Дей Т., Наскар Д., Кунду С.С. Стимулирование остеоинтеграции титановых поверхностей путем покрытия протеином шелка серицином. Биоматериалы. 2013; 34: 2855–2864. [PubMed] [Google Scholar]
42. Цубоучи К., Игараси Ю., Такасу Ю., Ямада Х. Серицин усиливает прикрепление культивируемых фибробластов кожи человека. Бионауч. Биотехнолог. Биохим. 2005; 69: 403–405. [PubMed] [Google Scholar]
43. Minoura N., Aiba S.I., Gotoh Y., Tsukada M., Imai Y. Прикрепление и рост культивируемых фибробластных клеток на матрицах белков шелка. Дж. Биомед. Матер. Рез. 1995;29:1215–1221. [PubMed] [Google Scholar]
44. Арамвит П., Канокпанонт С., Де-Экнамкул В., Камей К., Сричана Т. Влияние серицина с переменным содержанием аминокислот из разных штаммов шелка на производство коллаген и оксид азота. Дж. Биоматер. науч. Полим. Эд. 2009;20:1295–1306. [PubMed] [Google Scholar]
Дж. Биоматер. науч. Полим. Эд. 2009;20:1295–1306. [PubMed] [Google Scholar]
45. Арамвит П., Канокпанонт С., Накфенг Т., Шричана Т. Влияние серицина из различных методов экстракции на жизнеспособность клеток и выработку коллагена. Междунар. Дж. Мол. науч. 2010;11:2200–2211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Цао Т.Т., Чжан Ю.К. Жизнеспособность и пролиферация L929, опухолевых и гибридомных клеток в культуральной среде, содержащей белок серицин в качестве добавки или заменителя сыворотки. заявл. микробиол. Биотехнолог. 2015;99:7219–7228. [PubMed] [Google Scholar]
47. Такахаси М., Цудзимото К., Ямада Х., Такаги Х., Накамори С. Белок шелка, серицин, защищает от гибели клеток, вызванной острой депривацией сыворотки в культуре клеток насекомых. Биотехнолог. лат. 2003; 25:1805–1809. [PubMed] [Академия Google]
48. Williamson M.B., Fromm H.J. Влияние цистина и метионина на заживление экспериментальных ран. проц. соц. Эксп. биол. Мед. 1952; 80: 623–626. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
49. Верданова М., Пытлик Р., Калбакова М.Х. Оценка серицина в качестве криопротектора, замещающего фетальную бычью сыворотку, при замораживании мезенхимальных стромальных клеток человека и остеобластоподобных клеток человека. Биоконсерв. Биобанк. 2014;12:99–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Вепари С., Каплан Д.Л. Шелк как биоматериал. прог. Полим. науч. 2007;32:991–1007. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Икеда К., Оуми Ю., Огава А., Сасаки М., Ямада Х., Терада С. Клетки и культуры. Культ клеток. 2010: 10–13. [Google Scholar]
52. Ха С.Дж., Ким Б.Г., Ли Ю.А., Ким Ю.Х., Ким Б.Дж., Юнг С.Е., Пан М.Г., Рю Б.Ю. Влияние антиоксидантов и ингибиторов апоптоза на криоконсервацию мышиных половых клеток, обогащенных сперматогониальными стволовыми клетками. PloS Один. 2016; 11:1–16. [Статья бесплатно PMC] [PubMed] [Google Scholar]
53. Burnouf T., Strunk D., Koh MBC, Schallmoser K. Лизат тромбоцитов человека: замена эмбриональной бычьей сыворотки в качестве золотого стандарта для размножения клеток человека? Биоматериалы. 2016;76:371–387. [PubMed] [Академия Google]
2016;76:371–387. [PubMed] [Академия Google]
54. Semple J.W., Italiano J.E., Freedman J. Тромбоциты и иммунный континуум. Нац. Преподобный Иммунол. 2011; 11: 264–274. [PubMed] [Google Scholar]
55. Rauch C., Feifel E., Amann E.-M., Spötl H.P., Schennach H., Pfaller W., Gstraunthaler G. Альтернативы использованию эмбриональной бычьей сыворотки: человек лизаты тромбоцитов в качестве заменителя сыворотки в средах для культивирования клеток. АЛЬТЕКС-Альтерн. Аним. Эксп. 2011;28:305–316. [PubMed] [Google Scholar]
56. van der Valk J., Bieback K., Buta C., Cochrane B., Dirks W.G., Fu J., Hickman J.J., Hohensee C., Kolar R., Liebsch M. , Пистоллато Ф., Шульц М., Тиме Д., Вебер Т., Вист Дж., Винклер С., Гстраунталер Г. Фетальная бычья сыворотка (ФБС): прошлое – настоящее – будущее. АЛЬТЕКС. 2018;35:99–118. [PubMed] [Google Scholar]
57. Йоханссон Л., Клинт Дж., Холмквист О., Олсон С. Лизат тромбоцитов: замена эмбриональной бычьей сыворотке в культуре клеток животных? Цитотехнология. 2003; 42: 67–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2003; 42: 67–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Astori G., Amati E., Bambi F., Bernardi M., Chieregato K., Schäfer R., Sella S., Rodeghiero F. Лизат тромбоцитов как заменитель сыворотки животных для расширения ex-vivo мезенхимальных стволовых/стромальных клеток: настоящее и будущее. Стволовые клетки Res. тер. 2016;7:1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Радтке С., Гибель Б., Вагнер В., Хорн П.А. Лизаты тромбоцитов и их роль в клеточной терапии. ИСБТ науч. сер. 2014;9:193–197. [Google Scholar]
60. Canestrari E., Steidinger H.R., McSwain B., Charlebois S.J., Dann C.T. Добавка среды лизата тромбоцитов человека поддерживает лентивирусную трансдукцию и экспансию Т-лимфоцитов человека, сохраняя при этом фенотип памяти. Дж. Иммунол. Рез. 2019;2019 [PMC free article] [PubMed] [Google Scholar]
Объединенный лизат тромбоцитов человека по сравнению с эмбриональной бычьей сывороткой — исследование скорости пролиферации, стабильности хромосом и ангиогенного потенциала стволовых клеток, полученных из жировой ткани человека, предназначенных для клинического использования. Цитотерапия. 2013; 15:1086–109.7. [PubMed] [Google Scholar]
Цитотерапия. 2013; 15:1086–109.7. [PubMed] [Google Scholar]
62. Tylek T., Schilling T., Schlegelmilch K., Ries M., Rudert M., Jakob F., Groll J. Лизат тромбоцитов превосходит FCS и сыворотку человека по ко- культура первичных макрофагов человека и чМСК. науч. Отчет 2019; 9: 1–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Мохамед Х.Е., Аскер М.Е., Котб Н.С., Эль Хабаб А.М. Эффективность лизата тромбоцитов человека, стабильность и оптимальная концентрация гепарина, необходимые в культуре клеток млекопитающих. Кровь Рез. 2020;55:35–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Ветвицка В. 1994. Иммунология кольчатых червей. [Google Scholar]
65. Патил С.Р., Бирадар П.М. Целомическая жидкость дождевых червей: добыча и значение. Междунар. Дж. Адв. науч. Рез. 2017; 2:1–4. [Google Scholar]
66. Griffith C.M., Williams P.B., Tinoco L.W., Dinges M.M., Wang Y., Larive C.K. Метаболическое профилирование 1H ЯМР целомической жидкости, целомоцитов и тканей дождевого червя ( Eisenia fetida ): идентификация нового метаболита — малилглутамата. J. Proteome Res. 2017;16:3407–3418. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J. Proteome Res. 2017;16:3407–3418. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Камемото Ф.И., Сполдинг А.Е., Кейстер С.М. Ионный баланс в крови и целомической жидкости дождевых червей. биол. Бык. 1962 г., апрель; 122 (2): 228–231. [Google Scholar]
68. Субраманиан Э.Р., Судалаймани Д.К., Селван Кристирадж Дж.Р.С., Рамамурти К., Гопи Дейзи Н., Селван Кристирадж Дж.Д., Ренганатан К., Кришнан С., Сивасубраманиам С. Исследования органогенеза во время регенерации у дождевых червей , Eudrilus eugeniae , в поддержку симбиотической ассоциации с Bacillus endophyticus. Турецкий J. Biol. 2017;41:113–126. [Академия Google]
69. Плитыч Б., Бигай Дж., Фалнёвски А., Морган А.Дж. Неожиданные результаты и открытые вопросы экспериментов по регенерации люмбрицид. Инвертебр. Выжить. Дж. 2016; 13:315–325. [Google Scholar]
70. Плытыч Б., Хома Ю., Козиол Б., Розановска М., Морган А.Ю. Содержание рибофлавина в аутофлуоресцентных целомоцитах дождевых червей видоспецифично. Фолиа гистохим. Цитобиол. 2006; 44: 275–280. [PubMed] [Google Scholar]
Фолиа гистохим. Цитобиол. 2006; 44: 275–280. [PubMed] [Google Scholar]
71. Морган Дж.Ф., Мортон Х.Дж., Паркер Р.К. Питание животных клеток в культуре тканей. I. Начальные исследования на синтетической среде. проц. соц. Эксп. биол. Мед. 1950 января; 73 (1): 1–8. [PubMed] [Google Scholar]
72. Накано Э., Муштак С., Хит П.Р., Ли Э.С., Бери Дж.П., Райли С.А., Пауэрс Х.Дж., Корф Б.М. Истощение рибофлавина нарушает пролиферацию клеток в двенадцатиперстной кишке взрослого человека: идентификация потенциальных эффекторов. Копать. Дис. науч. 2011;56:1007–1019. [PubMed] [Google Scholar]
73. Даниелян К.Э. Подкомпоненты комплекса витаминов группы В регулируют рост и развитие клеток головного мозга человека. Являюсь. Дж. Биомед. Рез. 2013; 1:28–34. [Академия Google]
74. Hirano K., Namihira M. Приток FAD усиливает нейрональную дифференцировку нервных стволовых клеток человека, способствуя ядерной локализации LSD1. Открытая биография ФЭБС. 2017; 7: 1932–1942. [Статья бесплатно PMC] [PubMed] [Google Scholar]
75. Кашьяп С., Капур Н., Кале Р.Д. Coscinium fenestratum: каллус и суспензионная клеточная культура исчезающего лекарственного растения с использованием экстракта биогумуса и целомической жидкости в качестве среды для культивирования тканей растений . Являюсь. Дж. Растениевод. 2016;7(6):899. [Академия Google]
Кашьяп С., Капур Н., Кале Р.Д. Coscinium fenestratum: каллус и суспензионная клеточная культура исчезающего лекарственного растения с использованием экстракта биогумуса и целомической жидкости в качестве среды для культивирования тканей растений . Являюсь. Дж. Растениевод. 2016;7(6):899. [Академия Google]
76. Войдани А., Штейн Э.А., Альфред Л.Дж., Купер Э.Л. Митогенный эффект дождевого червя (Lumbricus terrestris) целомической жидкости на лимфоциты мыши и человека. Иммунобиология. 1984; 166: 157–167. [PubMed] [Google Scholar]
77. Hanušová R., Bilej M., Brys L., De-Baetselier P., Beschin A. Идентификация целомического митогенного фактора у дождевых червей Eisenia foetida. Иммунол. лат. 1999; 65: 203–211. [PubMed] [Google Scholar]
78. Чжао Дж., Ци С.П., У Дж., Ли Л., Хе Р.К. Фибринолитический фермент дождевых червей. Стад. Нац. Произв. хим. 2005; 30: 825–847. [Академия Google]
79. Fazzina R., Iudicone P., Mariotti A., Fioravanti D., Procoli A., Cicchetti E. , Scambia G., Bonanno G., Pierelli L. Культура клеточных линий человека инактивированным патогеном человеком лизат тромбоцитов. Цитотехнология. 2016;68:1185–1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Scambia G., Bonanno G., Pierelli L. Культура клеточных линий человека инактивированным патогеном человеком лизат тромбоцитов. Цитотехнология. 2016;68:1185–1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Бибак К., Фернандес-Муньос Б., Пати С., Шефер Р. Пробелы в знаниях о лизате тромбоцитов человека в качестве добавки клеточной культуры для клеточной терапии: совместная публикация AABB и Международного общества клеточной и генной терапии. Цитотерапия. 2019;21:911–924. [PubMed] [Google Scholar]
81. Сетулакшми К., Лакшми Р. Антибактериальная активность целомической жидкости местных дождевых червей в отношении болезнетворных микроорганизмов. Азиатский Дж. Биол. 2018;5:1–7. [Google Scholar]
82. Rajesh C., Rajamanikkam K., Nadana G., Vadivu R. Целомическая жидкость дождевого червя, Eudrilus eugeniae , ингибирует рост грибковых гиф, in vitro. Междунар. Дж. Инж. Доп. Технол. 2019; 9: 792–796. [Google Scholar]
83. John S.A., Packialakshmi N. , Sundhararajan A. Исследование клеточной активности в целомической жидкости дождевого червя ( Perionyx excavatus Perrier) Asian J. Microbiol. Биотехнолог. Окружающая среда. науч. 2009; 11: 335–338. [Google Scholar]
, Sundhararajan A. Исследование клеточной активности в целомической жидкости дождевого червя ( Perionyx excavatus Perrier) Asian J. Microbiol. Биотехнолог. Окружающая среда. науч. 2009; 11: 335–338. [Google Scholar]
84. Гейтс Г.Э. Бирманские дождевые черви: введение в систематику и биологию мегадрильных олигохет с особым упором на Юго-Восточную Азию. Транс. Являюсь. Филос. соц. 1972; 62: 1–326. [Google Scholar]
85. Рейнеке А.Дж., Вильджоен С.А., Саайман Р.Дж. Пригодность Eudrilus eugeniae, Perionyx excavatus и Eisenia fetida (Oligochaeta) для вермикомпостирования в южной части Африки с точки зрения их требований к температуре. Почвенная биол. Биохим. 1992;24:1295–1307. [Google Scholar]
86. Чан Р.К., Лю П., Лью Д.-Х., Ибрагим С.И., Срей Р., Валери К.Р., Хехтман Х.Б., Оргилл Д.П. Жидкие консервированные тромбоциты с истекшим сроком годности сохраняют пролиферативную активность1. Дж. Сург. Рез. 2005; 126:55–58. [PubMed] [Google Scholar]
87. Фолмсби М., Ховард Г., Макалистер М. Влияние питательных сред на размер клеток микоплазмы и их удаление фильтрацией. Биопрепараты. 2010; 38: 214–217. [PubMed] [Google Scholar]
Фолмсби М., Ховард Г., Макалистер М. Влияние питательных сред на размер клеток микоплазмы и их удаление фильтрацией. Биопрепараты. 2010; 38: 214–217. [PubMed] [Google Scholar]
88. Организация W.H. Руководство по процедурам инактивации и удаления вирусов, предназначенным для обеспечения вирусной безопасности продуктов плазмы крови человека. ВОЗ Тех. Респ. сер. 2004;924:150–224. [Google Scholar]
89. Клейн Х. Г. Технология инактивации патогенов: очистка кровоснабжения. Дж. Стажер. Мед. 2005; 257: 224–237. [PubMed] [Google Scholar]
90. Shih DT, Chen J., Chen W., Kuo Y., Su C., Burnouf T. Экспансия мезенхимальных стромальных предшественников жировой ткани в бессывороточной среде с добавлением вирусно-инактивированной аллогенной лизат тромбоцитов человека. Переливание. 2011;51:770–778. [PubMed] [Google Scholar]
91. Hemeda H., Giebel B., Wagner W. Оценка лизата тромбоцитов человека по сравнению с эмбриональной бычьей сывороткой для культуры мезенхимальных стромальных клеток. Цитотерапия. 2014;16:170–180. [PubMed] [Академия Google]
Цитотерапия. 2014;16:170–180. [PubMed] [Академия Google]
92. Oeller M., Laner-plamberger S., Krisch L., Rohde E., Strunk D., Schallmoser K. Лизат тромбоцитов человека для производства клеток в соответствии с надлежащей производственной практикой. Междунар. Дж. Мол. науч. 2021;22 [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Reports Reportsn. 2016. Рынок клеточных культур по оборудованию (биореактор, сосуды для культивирования (многолуночные чашки, чашки Петри)), расходным материалам (FBS, ABS, среды, реагенты), применению (терапия, стволовые клетки), конечным пользователям (фармацевтика и биотехнология, исследования) — Прогноз до 2020 г. http://www.reportsnreports.com/market-research/biotechnology/ Доступно по адресу: [Google Scholar]
94. Карниели О., Фриднер О.М., Алликсон Дж.Г., Чжан Н., Юнг С., Фиорентини Д., Абрахам Э., Икер С.С., Йонг Т.К., Чан А., Гриффитс С., Когда А.К., О С. , Карниели О. Консенсусное введение в заменители сыворотки и бессывороточные среды для клеточной терапии. Цитотерапия. 2017;19:155–169. [PubMed] [Google Scholar]
Цитотерапия. 2017;19:155–169. [PubMed] [Google Scholar]
95. Gstraunthaler G. Альтернативы использованию эмбриональной бычьей сыворотки: культура клеток без сыворотки. АЛЬТЕКС Альтерн. Zu Tierexperimenten. 2003; 20: 275–281. [PubMed] [Академия Google]
96. Бейкер М. Воспроизводимость: уважайте свои клетки! Природа. 2016; 537: 433–435. [PubMed] [Google Scholar]
97. Гстраунталер Г., Линдл Т., Ван Дер Валк Дж. Серьезный случай мошеннического смешивания эмбриональной бычьей сыворотки усиливает аргументы в пользу применения бессывороточных культур клеток и тканей. АТЛА Альт. лаборатория Аним. 2014;42:207–209. [PubMed] [Google Scholar]
98. RMBIO . 2016. Fetal Bovine Serum: предложение и спрос на FBS в США. https://www.rmbio.com/fetal-bovine-serum-supply-and-demand-for-us-fbs [Google Scholar]
99. Chou M.L., Bailey A., Avory T., Tanimoto J., Burnouf T. Удаление приона трансмиссивной губчатой энцефалопатии из больших объемов сред для культивирования клеток, дополненных эмбриональной бычьей сывороткой, с помощью анионообменной мембранной хроматографии с полыми волокнами. PloS Один. 2015; 10:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
PloS Один. 2015; 10:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Kirikae T., Tamura H., Hashizume M., Kirikae F., Uemura Y., Tanaka S., Yokochi T., Nakano M. Заражение эндотоксинами в эмбриональная бычья сыворотка и ее влияние на продукцию фактора некроза опухоли макрофагоподобными клетками J774. 1 культивируют в присутствии сыворотки. Междунар. J. Иммунофармакол. 1997 1 мая; 19 (5): 255–262. [PubMed] [Google Scholar]
101. Hawkes P.W. Фетальная бычья сыворотка: географическое происхождение и нормативное значение вирусного заражения. Биоресурс. Биопроцесс. 2015;2 [Google Scholar]
102. Jochems C.E.A., Van der Valk J.B.F., Stafleu F.R., Baumans V. Использование эмбриональной бычьей сыворотки: этическая или научная проблема? АТЛА Альт. лаборатория Аним. 2002; 30: 219–227. [PubMed] [Google Scholar]
103. Clavey V., Copin C., Mariotte M.C., Baugé E., Chinetti G., Fruchart J., Fruchart J.C., Dallongeville J., Staels B. Условия клеточной культуры определяют аполипопротеин CIII секреция и регуляция фибратами в клетках гепатомы человека hepG2. Клетка. Физиол. Биохим. 1999;9:139–149. [PubMed] [Google Scholar]
Клетка. Физиол. Биохим. 1999;9:139–149. [PubMed] [Google Scholar]
104. Groothuis F.A., Heringa M.B., Nicol B., Hermens J.L.M., Blaauboer B.J., Kramer N.I. Рассмотрение метрики дозы в анализах in vitro для улучшения количественной экстраполяции дозы in vitro-in vivo. Токсикология. 2015; 332:30–40. [PubMed] [Google Scholar]
105. Крамер Н.И., Херменс Дж.Л.М., Ширмер К. Влияние способов действия и физико-химических свойств химических веществ на корреляцию между данными in vitro и острой токсичностью для рыб. Токсикол. Витро. 2009 г.;23:1372–1379. [PubMed] [Google Scholar]
106. Taylor R.E., Gregg CJ, Padler-Karavani V., Ghaderi D., Yu H., Huang S., Sorensen R.U., Chen X., Inostroza J., Nizet V., Варки А. Новый механизм образования человеческих ксено-аутоантител против нечеловеческой сиаловой кислоты N-гликолилнейраминовой кислоты. Дж. Эксп. Мед. 2010; 207:1637–1646. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Мартин М.Дж., Муотри А., Гейдж Ф., Варки А. Эмбриональные стволовые клетки человека экспрессируют иммуногенную нечеловеческую сиаловую кислоту. Нац. Мед. 2005; 11: 228–232. [PubMed] [Академия Google]
Эмбриональные стволовые клетки человека экспрессируют иммуногенную нечеловеческую сиаловую кислоту. Нац. Мед. 2005; 11: 228–232. [PubMed] [Академия Google]
108. Билей М., Брис Л., Бещин А., Лукас Р., Веркаутерен Э., Ханушова Р., Де Бетселье П. Идентификация цитолитического белка в целомической жидкости дождевых червей Eisenia foetida. Иммунол. лат. 1995; 45: 123–128. [PubMed] [Google Scholar]
109. Milochau A., Lassègues M., Valembois P. Очистка, характеристика и активность двух гемолитических и антибактериальных белков из целомической жидкости кольчатых червей Eisenia fetida andrei. Биохим. Биофиз. Acta Protein Struct. Мол. фермент. 1997;1337:123–132. [PubMed] [Google Scholar]
110. Фиолка М.Ю., Чаплевская П., Макур К., Бухвальд Т., Кутковская Ю., Падух Р., Качиньский З., Выдрых Ю., Урбаник-Сыпневская Т. Anti-Candida albicans действие белково-углеводной фракции, полученной из целомической жидкости дождевого червя Dendrobaena veneta. PloS Один. 2019; 14:1–30. [PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
111. Шанский Ю.Д., Сергеева Н.С., Свиридова И.К., Киракозов М.С., Кирсанова В.А., Ахмедова С.А., Антохин А.И., Чиссов В.И. Лизат тромбоцитов человека как перспективная ростостимулирующая добавка для культивирования стволовых и других типов клеток. Бык. Эксп. биол. Мед. 2013; 156: 146–151. [PubMed] [Академия Google]
112. Valembois P., Seymour J., Roch P. Доказательства и клеточная локализация окислительной активности в целомической жидкости дождевого червя Eisenia fetida andrei . Дж. Инвертебр. Патол. 1991; 57: 177–183. [Google Scholar]
113. Уэда М., Нода К., Наказава М., Миятаке К., Оки С., Сакагути М., Иноуэ К. Новый вирусный белок против растений из целомической жидкости дождевого червя Eisenia foetida : очистка, характеристика и идентификация сериновой протеазы. Комп. Биохим. Физиол. Б Биохим. Мол. биол. 2008; 151:381–385. [PubMed] [Академия Google]
114. Надана Г.Р.В., Раджеш С., Кавита А., Сивакумар П.

