Расход на 1 м3 раствора: Сколько смеси в 1 куб м раствора (кг в м3)
Норма расхода цемента на 1м3 бетона
Главная » Статьи » Норма расхода цемента на 1м3 бетона
Расход цемента на куб раствора
Для того, что бы правильно рассчитать расход цемента на 1м3 раствора необходимо, прежде всего, учесть некоторые особенности. К ним относятся такие важные вещи, как предназначение раствора, нагрузки, воздействующие на него, наряду с климатическими условиями и, конечно, его состав.
Назначение раствора
Для того, что бы учесть правильно расход цемента для приготовления раствора необходимо определиться с составом смеси, это с учетом того что уже определено предназначение раствора. Как правило, в составляющие вещества входят цемент, известь, цементно-известковые и цементно-глиняные добавки.
Обычно составы раствора включают одно вяжущее вещество, и такой раствор называется простым, но бывают и смешанные растворы, в которые может добавляться несколько вяжущих веществ. Также стоит уделить внимание и заполнителям, входящим в состав раствора.
Если раствор будет изготавливаться с добавлением песка, то мы получим тяжелый раствор, что в свою очередь будет определять его назначение и в ту же самую очередь определит расход цемента, необходимого для приготовления 1м3 раствора.
Особенностью тяжелых растворов является то, что они обладают большим объемным весом около 1700-2200 кг на куб раствора, в то время как в легких растворах объемный вес составляет менее 1700 кг на куб раствора. Это достигается тем, что в легкие смеси добавляют вместо песка шлак.
Состав раствора
В зависимости от назначения раствора и марки цемента определяется его механическая прочность. Она бывает марки № 2, 4, 10, 25 и т. д.
Таким образом, выбирая более высокую марку цемента при приготовлении, мы сможем уменьшить расход цемента на один кубический метр раствора той же прочности. В основном для приготовления строительных смесей применяют цемент марки М400 и М500, а сами же растворы, например для кладки, наиболее распространенны, такие как М25 и М50. Так, например, для приготовления марки М25 смешивается цемент в соотношении песка 5:1, а в марке М50 в соотношении 4:1.
Так, например, для приготовления марки М25 смешивается цемент в соотношении песка 5:1, а в марке М50 в соотношении 4:1.
В общем, для грамотного расчета необходимого количества цемента на одни куб раствора нужно рассчитать правильно пропорцию, в которую входит цемент, песок, примеси и вода.
Расход цемента
И так определим расход цемента при приготовлении, например, куба бетона. Как известно, расход будет зависеть от его плотности, его вязкости, схватывания и других важных характеристик, которые должны обязательно учитываться для получения качественного раствора.
Для получения качественного и долговечного раствора нужно учитывать, какой раствор нужен, легкий или тяжелый, а также соблюдать нормы при приготовлении данных растворов. Нужно грамотно рассчитать расход песка и цемента, в зависимости от его марки, на 1м3. Приведем несколько примеров норм расхода цемента:
- На раствор, в котором применяется цемент марки м600 , необходимо придерживаться следующей пропорции 1:3, а при использовании распространенной в строительстве марки цемента м400 придерживаться пропорции 1:2.
 То есть, таким образом, один килограмм цемента необходимо смешивать с тремя килограммами песка или других примесей, при использовании цемента марки М600 и соответственно при использовании марки М400 на один килограмм необходимо два килограмма песка;
То есть, таким образом, один килограмм цемента необходимо смешивать с тремя килограммами песка или других примесей, при использовании цемента марки М600 и соответственно при использовании марки М400 на один килограмм необходимо два килограмма песка; - При расчете необходимого количества цемента для приготовления бетона необходимо весь объём умножить на коэффициент 1,3, так как при добавлении воды объём раствора уменьшается по отношению к объёму сухой смеси;
- При использовании цемента для приготовления раствора накладку на 1м3 необходимо использовать приблизительно восемь мешков цемента, которые должны весить по 50 кг;
- Для строительства фундамента обычно применяют цемент марки М100, М150, М200, М250 и М300. Для фундамента необходим раствор с хорошей прочностью и сопротивлением к сжатию. И поэтому, существует следующий расход цемента, так для марки М100 это 170 кг/м3, для М150 – 200 кг/м3, для М200 – 240 кг/м3, для М250 это 300 кг/м3 ну и для марки М300 на один куб раствора нам понадобиться около 320 кг цемента;
- В случае если нам нужна штукатурка толщиной не более 10 мм, то нам понадобиться примерно на 1м3 около 1,5 кг цемента;
- Для приготовления нужного раствора для кладки шлакоблоков потребуется, как и раньше в зависимости от марки цемента, следующие пропорции: для марки М150 около 230 кг/м3, для М200 – 185 кг/м3, для марки М300 понадобиться 120 кг на м3 и используя марку цемента М400 понадобиться приблизительно 90 кг/м3;
- Цемент, имеющий высокую марку, такую как М500 расходуется в зависимости от его предназначения.

- Используется данный вид цемента для возведения фундамента, так как обладает высокой прочностью, долговечностью и малой эластичностью, что хорошо подходит для данного вида строительства. Также его часто применяют при строительстве различных перекрытий, балок и плит. К характеристикам данного цемента также можно отнести хорошую морозоустойчивость и водостойкость, а также он обладает отличной антикоррозийной способностью и поэтому часто применяется при проведении аварийных работах.
Для приготовления растворов высоких марок, таких как М150 и М200 соотношение цемента М500 и песка – 1:4, марки М400 – 1:3, а для марки М300 – 1:2,5. Таким образом, раствор можно приготовить по разной пропорции в зависимости от предназначения. При этом раствор будет содержать разное количество цемента, что зависит и от марки самого цемента. Поэтому рассчитать, сколько цемента нужно на куб раствора можно только в том случае, если точно известна пропорция, по которой этот раствора будет изготавливаться.
yegorka.com
Норма расхода цемента на 1м3 бетона различных классов
В специальных строительных институтах опытным путем были установлены марки раствора и классы бетона, также соответствующие прочности материала на сжатие.
Классы бетона и марки строительных растворов зависят от марки цемента, а также от количества используемой воды.
Поэтому еще одной из важнейших характеристик при изготовлении является водоцементное соотношение, то есть пропорция воды и цемента, требуемая для получения того или иного класса бетона или марки раствора.
Марки цемента и классы бетона
Портландцемент
Товарный цемент подразделяется на марки, соответствующие прочности цементного камня на сжатие.
Самые распространенные марки цемента – М400 и М500.
При строительном проектировании количество необходимого бетона, а также строительного раствора рассчитывается в кубических метрах.
А учитывая то, что для выполнения работ разной степени ответственности и назначения требуются разные классы бетона и марки раствора, для правильного определения цены строительства всегда нужно знать, какое количество компонентов содержится в одном кубическом метре такого материала.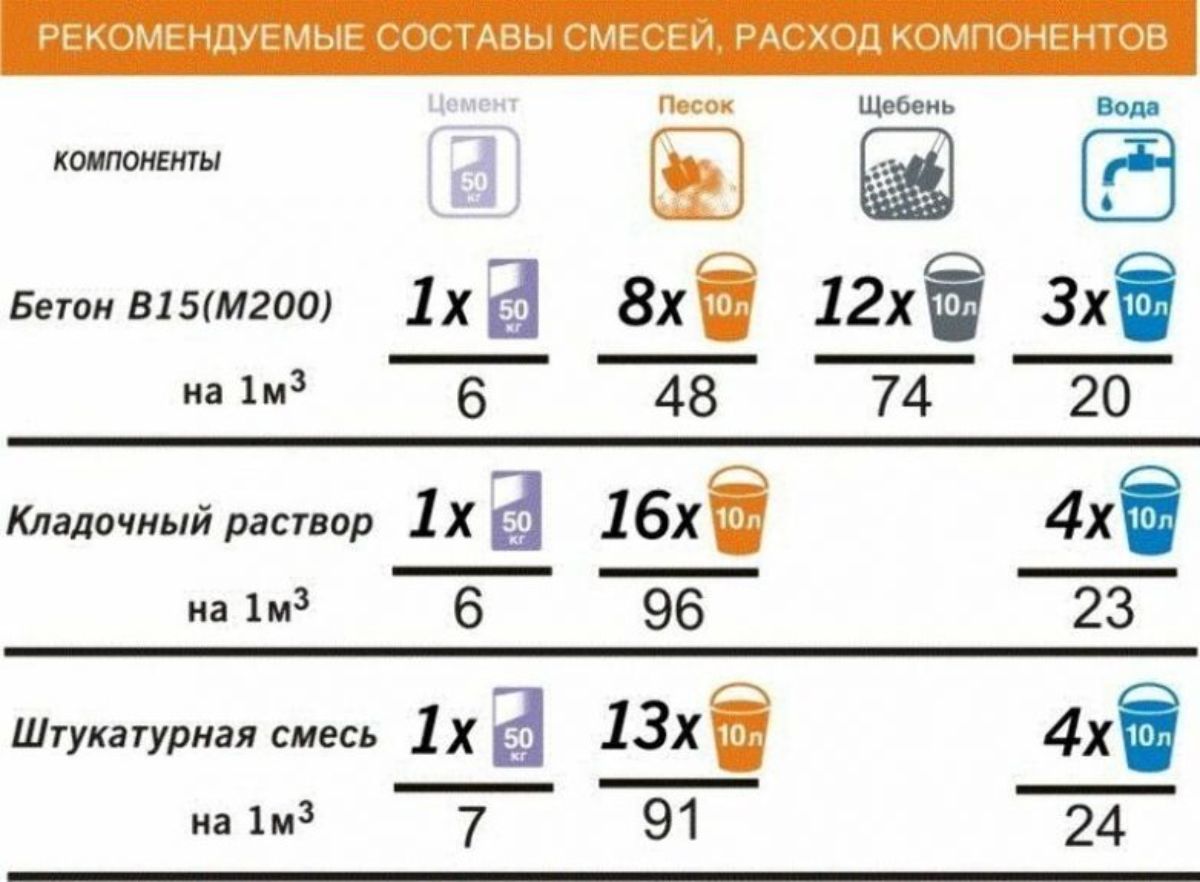
Особенно это относится к цементу. Если песок и щебень, добываемые карьерным способом, чаще всего находятся вблизи мест строительства, а их добыча малозатратна, то цена изготовления цемента и его доставки на объект, наоборот, может составлять большую часть стоимости готового изделия.
Норма расхода цемента на 1м3 бетона
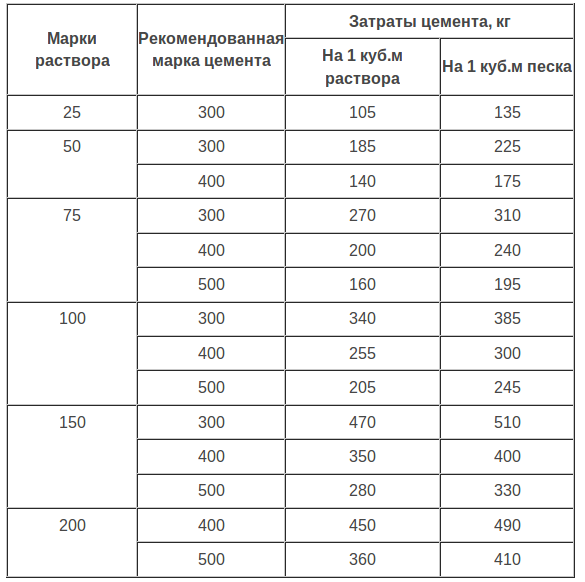
Самые распространенные строительные растворы – это цементно-песчаный, а также цементно-известковый (тот же цементно-песчаный, но с добавлением гидратной извести). Марки строительного цементно-песчаного раствора по прочности и их рецептура приведены в таблице:
Таблица 1
Область применения раствора разных марок
Строительные растворы на портландцементе применяются в строительстве достаточно широко. Так, например, используются растворы с маркой:
- М50…М75 используются для кирпичной кладки и обычной штукатурки
- М100…М300 для стяжек полов, а также для высокопрочной штукатурки бетонных конструкций или наружных поверхностей кирпичной и каменной кладки, для замоноличивания стыков сборных конструкций
Норма расхода цемента на 1 м3 бетона марки 400 и др
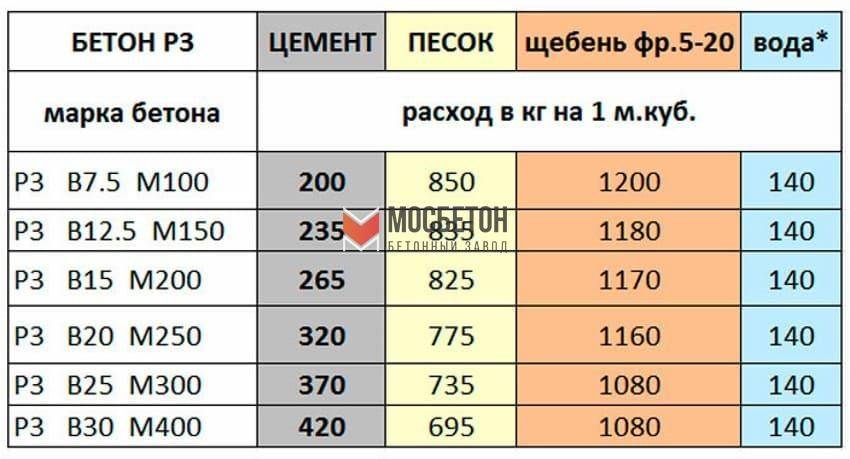
Прочность бетона определяется его классом. Класс также определяет цели, в которых будет использоваться бетон того или иного состава. Наиболее распространенные классы и соответствующий им состав бетонной смеси (норма расхода цемента на 1м3 бетона) приведены в таблице:
Класс также определяет цели, в которых будет использоваться бетон того или иного состава. Наиболее распространенные классы и соответствующий им состав бетонной смеси (норма расхода цемента на 1м3 бетона) приведены в таблице:
Таблица 2
Цементный раствор
Раньше прочность бетона, также, как и раствора определялась его маркой, значение марки соответствовало сжимающей нагрузке в килограммах, действующих на 1 см2, при которой образец, изготовленный из такого бетона, начинал разрушаться.
Действующие в настоящее время Строительные нормы и правила заменили марки бетона на классы.
Так, классу В15 соответствовала старая марка М200, классу В22.5 – марка М300, классу В30 – марка М400.
Например, норма расхода цемента на 1м3 бетона марки 400 (класса В30), который не слишком распространен в строительстве, составляет при марке цемента М500 – около 410 кг.
Область применения бетона разных марок
Применение бетона по классам:
- В7.5…В12.5 — для стяжек и выравнивания полов
- В15…В22.
 5 — для фундаментов, монолитных стен, перекрытий, колонн, балок и ригелей, армирующих поясов в каменных стенах
5 — для фундаментов, монолитных стен, перекрытий, колонн, балок и ригелей, армирующих поясов в каменных стенах - В25…В30 для фундаментов и перекрытий, работающих в условиях динамических нагрузок, а также для авиационных взлетных полос
Так, например, норма расхода цемента на 1м3 бетона для фундамента при его бетонировании составит от 400 до 450 кг в зависимости от марки используемого цемента.
Бетон для фундамента
Изготовление бетона и раствора вручную является, хотя и простым, но достаточно трудоемким процессом, упростить который поможет использование бетономешалки.
Еще лучше при индивидуальном строительстве воспользоваться услугами специальных организаций, производящих бетоны и растворы различных марок и классов, доставляющих его прямо на строительную площадку.
При самостоятельном изготовлении бетона или строительного раствора следует тщательно следить за проектными рекомендациями по его прочности, а также соблюдать рецептуру и пропорции.
Не рекомендуется выполнение работ при минимальной суточной температуре ниже 5 градусов по Цельсию.
Иначе составы на основе цемента могут не достигнуть заданной прочности, получатся рыхлыми и неустойчивыми к нагрузкам и атмосферным воздействиям, а работа потребует переделки или дорогостоящего усиления несущей способности изготовленной строительной конструкции.
Как рассчитать бетон — на видео:
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
foxremont.com
Расход цемента на 1 куб раствора: как правильно выполнить расчет
Таблица определения количества цемента в кубометре раствора
С одной стороны, может показаться, что приготовить цементный раствор – самое простое, с чем приходится сталкиваться при проведении строительных и отделочных работ. Но это глубокое заблуждение, ведь не имея достаточного опыта, и не зная чётко технологии (в том числе пропорции, нормы, расход цемента на 1 куб раствора), – проблем не избежать. Слишком густая консистенция приведёт к плохому застыванию и пористости массы в затвердевшем состоянии, а чрезмерно жидкая – к ухудшению прочностных характеристик (бетонный состав будет крошиться, растрескиваться под воздействием любых внешних факторов). В обоих случаях некачественный раствор станет причиной значительного сокращения срока службы сооружения.
В обоих случаях некачественный раствор станет причиной значительного сокращения срока службы сооружения.
| Расчетная марка бетона | Марка используемого цемента | Ориентировочная масса цемента на 1 куб.м. бетона | Количество мешков 50 кг на 1 куб.м. бетона, шт. |
| М150 | М300 | 260 | 5,2 |
| М200 | М300 | 290 | 5,8 |
| М400 | 250 | 5 | |
| М500 | 220 | 5,4 | |
| М250 | М300 | 340 | 6,8 |
| М400 | 300 | 6 | |
| М500 | 250 | 5 | |
| М300 | М400 | 350 | 7 |
| М500 | 300 | 6 | |
| М400 | М400 | 400 | 8 |
| М500 | 330 | 6,6 |
Для каких бы целей ни понадобилось приготовить цементный раствор (для кладки, бетонирования поверхности, заливки фундамента, штукатурных работ), важно строго соблюдать установленные пропорции компонентов, тогда и результат работы сможет вас порадовать.
Бетон, его состав и особенности компонентов
В строительстве наиболее распространенным раствором является бетон. Он представляет собой искусственный по происхождению материал, образующийся вследствие отвердевания смеси определённых минеральных компонентов. Под классическим бетонным раствором понимают состав, включающий:
| Цемент | Это связующий компонент, который, затвердевая, превращает массу в монолит |
| Заполнители | К ним относятся песок и щебень. Их задача — заполнить пустоты и создать прочный структурный каркас, они дешевле цемента, благодаря чему удешевляют себестоимость полученного бетона |
| Вода | она, соединяясь с цементом, играет роль клея в получаемой смеси |
Современные строители для приготовления бетона стали применять специальные добавки — пластификаторы. Эти дополнительные компоненты, уменьшая количество воды, они позволяют получить пластичный и текучий раствор, который можно применить для нанесения смеси тонким слоем. В качестве них могут быть использованы: известь, армирующие добавки.
В качестве них могут быть использованы: известь, армирующие добавки.
Важно! Заполнители (песок, щебень) используются только чистыми, в них не должно оказаться примесей, мусора, инородных включений.
Как видите, состав несложный – всего 4 основных компонента и возможное добавление пластификатора, но самое главное – определенные пропорции (расход цемента и песка на 1м3 раствора, щебня).
Классическим соотношением компонентов в бетоне считается 1:3:5, в котором:
- одна часть – это цемент;
- три – песок;
- пять – щебень.
Это условный вариант, очень важно учитывать для каких именно целей готовится раствор, если, например, для внутренних работ – классическое соотношение подходит на все сто процентов. Но всегда для разных видов работ рекомендуется использование различных марок бетона, а это уже зависит от марки расходуемого на 1 куб раствора цемента.
Марки материала и особенности их учета
Главные качества хорошего бетона – прочность, плотность, водонепроницаемость, устойчивость к агрессивным воздействиям окружающей среды. Качественные показатели определяются его маркой (М100, М150 и так далее), чем выше указана цифра в маркировке, тем большие нагрузки сможет выдерживать бетон и выше качество использованного для его приготовления связующего компонента.
Качественные показатели определяются его маркой (М100, М150 и так далее), чем выше указана цифра в маркировке, тем большие нагрузки сможет выдерживать бетон и выше качество использованного для его приготовления связующего компонента.
Чтобы приготовить раствор нужной концентрации, необходимо для него использовать марку цемента в два раза выше:
- для получения М100 – берется в расход на 1м3 раствора цемент минимум М200;
- для М200 – соответственно, М400 и так далее.
Марка связующего компонента отражается и на себестоимости, более низкие значения приводят к удешевлению, при этом снижая прочностные характеристики. Поэтому для многих случаев предусмотрено увеличение нормы расхода цемента на 1м3 раствора при использовании связующего компонента более низкого качества. Например, вместо М400 использован М300. В этом случае расход цемента на 1 куб увеличится на 30% для достижения той прочности, которую обеспечивает более высокая марка.
Несколько рекомендаций опытных специалистов
Правильным соотношением при приготовлении кладочного раствора будет использование на 1 куб раствора 1 куба песка и трети куба цемента
Опытные строители далеко не всегда используют калькулятор для того, чтобы рассчитать нужное количество материалов для получения бетонного состава заданной концентрации. Сухие компоненты поступают в продажу в мешках по 50 кг, что значительно облегчает измерения и приготовление.
Сухие компоненты поступают в продажу в мешках по 50 кг, что значительно облегчает измерения и приготовление.
Например:
- для получения бетонного раствора М100 расход цемента на куб составляет 166 кг (т. е. это три мешка плюс 16 килограмм). Полученную массу можно применять для кладки плит, заливки дорожек на участке, бордюров;
- для М200 необходимо 240 кг (это почти пять мешков). Такой состав используется для строительства зданий;
- для раствора М250 расход цемента на 1 куб составляет 300 кг связующего компонента (шесть мешков). Состав подходит для обустройства монолитных перекрытий, лестниц, фундаментов.
| Марка раствора | Рекомендуемые марки вяжущего | Расход цемента и цементной пыли, кг/м³ песка влажностью 3 — 7% при активности пыли, кгс/см² | |||||
| 25 | 50 | 75 | |||||
| цемент | цементная пыль | цемент | цементная пыль | цемент | цементная пыль | ||
| 200 | 500 | 355 | 90 | 350 | 90 | 345 | 90 |
| 400 | 445 | 50 | 440 | 50 | 435 | 50 | |
| 150 | 500 | 275 | 90 | 270 | 90 | 265 | 90 |
| 400 | 345 | 90 | 340 | 90 | 330 | 90 | |
| 300 | 465 | 50 | 460 | 50 | 455 | 50 | |
| 100 | 500 | 200 | 105 | 195 | 105 | 185 | 105 |
| 400 | 250 | 105 | 240 | 105 | 230 | 105 | |
| 300 | 335 | 85 | 325 | 85 | 320 | 85 | |
| 75 | 500 | 155 | 125 | 145 | 125 | 140 | 125 |
| 400 | 195 | 100 | 190 | 100 | 180 | 100 | |
| 300 | 260 | 85 | 250 | 85 | 245 | 85 | |
| 200 | 395 | 45 | 385 | 45 | 380 | 45 | |
| 50 | 400 | 130 | 135 | 120 | 135 | 105 | 135 |
| 300 | 175 | 110 | 170 | 110 | 160 | 110 | |
| 200 | 270 | 85 | 260 | 85 | 250 | 85 | |
| 25 | 300 | 95 | 140 | 85 | 140 | 75 | 140 |
| 200 | 140 | 125 | 130 | 125 | 120 | 125 |
vseovanne. ru
ru
Раствор М150 | Цена на цементный раствор марки М-150 за куб с доставкой
Карта бетонных заводов, с которых осуществляется продажа раствора М150
- Загрузка указателей бетонных заводов может занять некоторое время (от пары секунд до 1 минуты при медленном соединении).
- Для изменения масштаба пользуйтесь кнопками «+» и «-» в правом нижнем углу.
Цены на раствор М150 за 1 м3
Уточнить текущую цену на самовывоз и стоимость доставки можно при обращении к менеджерам системы.
ВНИМАНИЕ! В течение 2021-2022 года существенно повысились цены на бетон и раствор. Смотреть подробнее
Ниже приведены РОЗНИЧНЫЕ цены за 1 м3 бетона и раствора от 01 февраля 2023 г. для указанного региона, с НДС в рублях за м3, БЕЗ УЧЕТА СТОИМОСТИ ДОСТАВКИ
Характеристики цементного раствора М150
Основным отличием раствора м-150 от бетона марки м150 является отсутствие щебня или какого-либо другого крупного заполнителя в составе смеси.
В цементном растворе м-150 значительно больше содержится песка и цемента, нежели в бетоне марки м150 (что более подробно рассмотрено в специальном исследовании).
Раствор м-150 имеет несколько названий:
- цементный раствор;
- строительный раствор;
- кладочный раствор;
- штукатурный раствор.

Раствор с крупными фракциями песка подходит для стяжек, но не для кладочных работ. Поэтому при заказе мелкозернистого раствора уточняйте, что нужен именно он! Если требуется мелкозернистый раствор, отдельное внимание должно быть уделено промывке БСУ и автобетоносмесителя (АБС), чтобы исключить наличие щебня в готовой смеси.
Согласно ГОСТ 28013-98, характеристиками затвердевшего раствора являются:
- прочность, для которой используются марки (а не классы, как для бетонов),
- морозостойкость (по этому показателю и бетоны нормируются марками).
Данный документ не дает четкого предписания, как правильно обозначать растворы. Поэтому приходится ориентироваться на практику реальных сертификаций. А она показывает, что в сертификатах пишут РКЦ М150 П
- аббревиатура РКЦ означает «раствор кладочный цементный»,
- показатель Пк — погружение конуса, специальную меру удобоукладываемости, применяемую для растворов.
 Она аналогична подвижности П, применяемой для бетонов, но всё же немного отличается — поэтому и показатель используется другой.
Она аналогична подвижности П, применяемой для бетонов, но всё же немного отличается — поэтому и показатель используется другой.
Применение цементного раствора м-150
- для проведения штукатурных и кладочных работ (мелкозернистый раствор) при влажном режиме помещения (согласно ГОСТ 28013-98 «Растворы строительные», Приложение Г, в этом режиме минимально необходимая норма расхода цемента на 1 м3 песка составляет 125 кг, что не позволяет использовать раствор М-100).
- для работ по созданию цементных стяжек полов (крупнозернистый, монтажный раствор).
Не всегда можно добиться прокачки раствора М150 Пк4 через насос, когда владельцы бетононасосов требуют повысить марку по прочности до М200. В таком случае можно использовать растворонасос, у него ограничений по минимальной марке нет. Но эта техника встречается реже, чем бетононасос, и при прокачке с ее помощью потребуется дополнительно оплачивать простой машин на объекте, потому что для полных машин низкая скорость прокачки растворонасоса не позволяет уложиться во включенное в стоимость доставки время на разгрузку.
4.5: Концентрация растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- 21718
Цели обучения
- Количественно описать концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: of\: растворенное вещество}{литры\: of\: раствора} = \dfrac{mmoles \: of\: раствор} {миллилитров\: of\: раствор} \label{4.5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right) = ммоль \label{4.5.3} \]
На рисунке \(\PageIndex{1}\) показано использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3}\).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей гидроксида натрия (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4. 5.2}, либо уравнение \ref{ 4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
5.2}, либо уравнение \ref{ 4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланин.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube(opens in new window) [youtu.be]
Концентрации также часто указываются в пересчете на массу (м/м) или на основе массы на объем (м/об), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в Части на миллион ( ч / млн ), которые составляют граммы растворенного вещества на 10 6 г решения, или в частях на миллиард ( ч / млн ), которые представляют собой граммы растворенного. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в Части на миллион ( ч / млн ), которые составляют граммы растворенного вещества на 10 6 г решения, или в частях на миллиард ( ч / млн ), которые представляют собой граммы растворенного. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти число молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0,500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 901 76 дюймов достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\(V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества.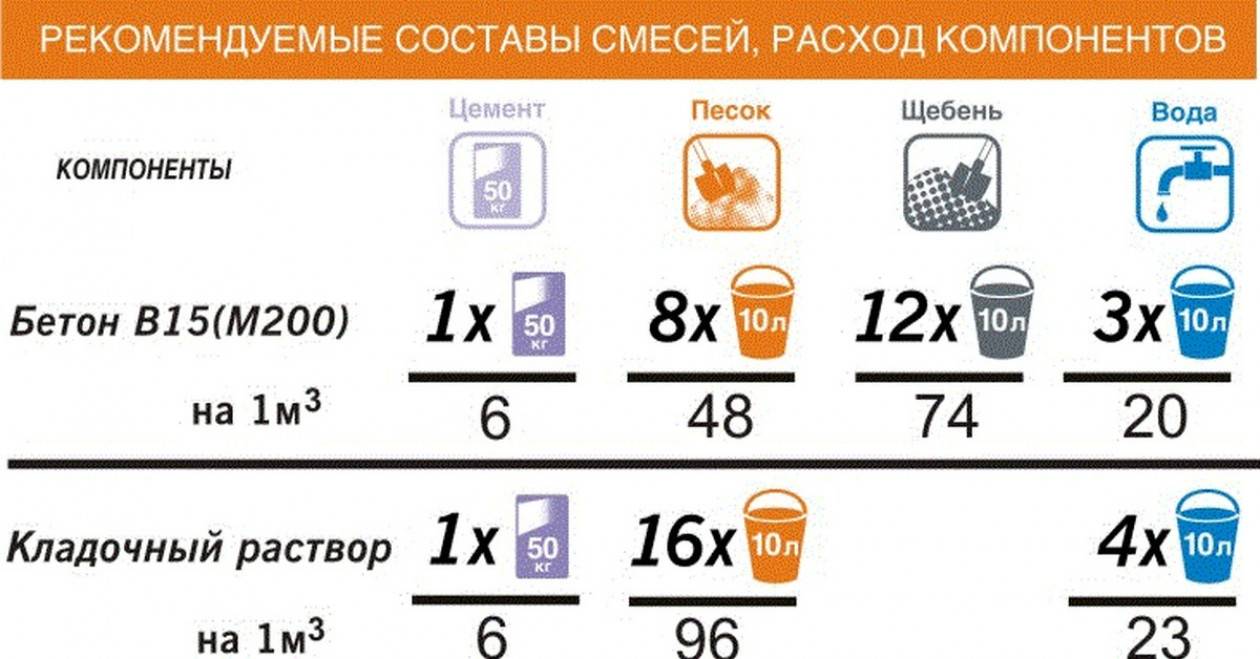 Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0036
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0036
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, путем умножения объем раствор по его молярности.
- Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 . 775\: моль\: глюкоза \номер \]
775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М исходного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \номер\]
При определении необходимого объема исходного раствора мы должны были разделить желаемое количество молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).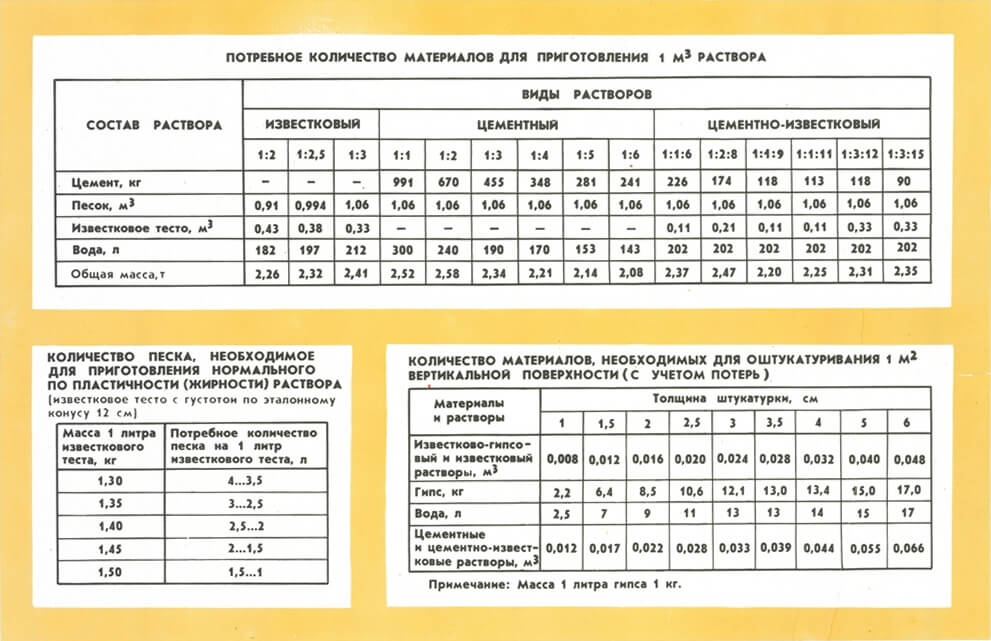
Мы также могли решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г бихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
рисунок \(\PageIndex{4}\)).
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2 − 901 05 также должно быть 1,43 М, потому что есть один Cr 2 O 7 2 − ион на формульную единицу. Однако существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионы составляет 2 × 1,43 М = 2,86 М. Поскольку единица формулы (NH 4 ) М. 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 90 104 2 − ), общая концентрация ионов в растворе 3 × 1,43 M = 4,29 M.
Однако существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионы составляет 2 × 1,43 М = 2,86 М. Поскольку единица формулы (NH 4 ) М. 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 90 104 2 − ), общая концентрация ионов в растворе 3 × 1,43 M = 4,29 M.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3 + и три иона NO 3 − , поэтому 0,032 М В (№ 3 ) 3 раствор содержит 0,032 М In 3 + и 3 × 0,032 М = 0,096 М NO 3 – — то есть [In 3 901 04 + ] = 0,032 М и [NO 3 − ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер\]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0033 ) до желаемого конечного объема.
Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0033 ) до желаемого конечного объема.
Авторы и авторство
4.5: Concentration of Solutions распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- концентрация
- молярность
- частей на миллиард
- Частей на миллион
- базовый раствор
ChemTeam: Стехиометрия: Объем (газа) Примеры
ChemTeam: Стехиометрия: Объем (газа) ПримерыСтехиометрия
Объем-объем Примеры
(объем газа, а не раствора)
Датчики №1–10
Вернуться в меню стехиометрии
Краткое введение: Ключевым моментом, на который следует обратить внимание, являются условия температуры и давления. Если они остаются постоянными, вы можете обращаться с объемами так же, как с родинками. Это связано с тем, что в условиях постоянных Т и Р объемы прямо пропорциональны молям. Это обсуждается в нескольких решениях проблем ниже.
Это обсуждается в нескольких решениях проблем ниже.
Хотя подавляющее большинство задач стехиометрии на основе объема сформулированы в терминах постоянных T и P, это не обязательно. Вы можете увидеть это в задачах 1b и 9 чуть ниже. Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
(1) Преобразовать объем в моли, используя PV = nRT и начальный набор T и P
(2) Используйте отношение и пропорцию для определения молей другого вещества, связанного с проблемой.
(3) Используйте PV = nRT с новыми T и P, а также молями вещества из шага 2. Вы рассчитаете новый объем.
Будьте готовы! Ваш учитель может показать ситуацию, когда T и P не меняются, а затем проверить ситуацию, когда T и P меняются.
Пример №1: Уравнение сгорания метана:
CH 4 + 2O 2 —> 2H 2 O + CO 2
(a) Если на СТП сжечь 50,0 л метана, какой объем углекислого газа получится на СТП?
(b) Если сжечь 50,0 л метана на НТП, какой объем газообразной воды получится на НТП?
Решение (а):
Поскольку все происходит в STP, объемы прямо пропорциональны молям используемого реагента и полученного продукта. Почему? Рассмотрим PV = nRT. Перепишите это как:
Почему? Рассмотрим PV = nRT. Перепишите это как:
н/В = П/РТВсе в правой части постоянно, поэтому отношение n:V также должно быть постоянным. Это означает, что объем прямо пропорционален количеству молей газа.
Так как существует молярное соотношение 1:1 между CH 4 и CO 2 , ответ 50,0 л
Решение (б):
1) Используйте PV = nRT для определения молей метана:
(1,00 атм) (50,0 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 2,044665 моль
Примечание: в этой задаче я принимаю комнатную температуру равной 25,0 °C, поскольку RTP означает комнатную температуру и давление.
2) Используйте молярное соотношение метан:вода:
1 к 2 как 2,044665 моль к хx = 4,08933 моль произведенной воды
3) Используйте PV = nRT для расчета объема водяного пара при нормальных условиях:
(1,00 атм) (V) = (4,08933 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 91,6 л (до трех знаков фиг.
)
Пример #2: Учитывая следующее уравнение:
C(s) + 2H 2 (g) —> CH 4 (g)
Сколько литров водорода необходимо для производства 20,0 л метана?
Решение:
1) P и T не являются частью этой задачи:
Это потому, что в задаче вообще не упоминаются Т или Р. Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
2) Сформулируйте гипотезу Авогадро (используя моли, а не молекулы):
Равные объемы газа при одинаковых температуре и давлении содержат одинаковое число молей
3) Укажите молярное соотношение водорода и метана:
2:1
4) Используйте отношение и пропорцию:
2 моля водорода соответствует 1 молю метана, так как x литров водорода соответствует 20,0 л метанах = 40,0 л водорода
Пример №3: 2,35 л газообразного кислорода реагирует с 3,72 л газообразного водорода с образованием воды. Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Решение:
1) Сбалансированное химическое уравнение:
2H 2 + O 2 —> 2H 2 O
2) Определите лимитирующий реагент:
кислород: 2,35/1 = 2,35
водорода: 3,72/2 = 1,86Водород является лимитирующим реагентом.
Обратите внимание, что в задаче не упоминается ни температура, ни давление. Это означает, что все происходит при неизменной температуре и давлении. Следовательно, эти два значения остаются постоянными и выпадают из рассмотрения. Нам не нужны моли, потому что в ситуации постоянной температуры и давления объемы прямо пропорциональны количеству молей.
Кроме того, мы даже не можем вычислить моли, так как не знаем ни температуры, ни давления.
3) Использовать H 2 :O 2 молярное соотношение:
2 равно 1, как 3,72 равно xИспользуется 1,86 л кислорода.
2,35 − 1,86 = 0,49 л непрореагировавшего кислорода остается
4) Выход в процентах:
Производится 3,72 л воды.2,50 / 3,72 = 67,2%
Пример #4: Сколько воздуха необходимо (в м 3 , при 25,0 °C, 1,00 атм) для полного сжигания 10,0 молей пропана (C 3 H 8 ). Предположим, что воздух состоит из 21,0% O 2 .
Решение:
1) Сжигание пропана:
C 3 H 8 + 5O 2 —> 3CO 2 + 4H 2 O
2) Определить количество молей чистого кислорода, необходимое для сжигания 10,0 моль пропана:
1 соответствует 5, как 10,0 соответствует хx = требуется 50,0 моль кислорода
3) Используйте PV = nRT для перевода молей кислорода в литры кислорода при условиях, указанных в задаче:
(1,00 атм) (V) = (50,0 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (298 К)В = 1222,694 л
4) Преобразовать в требуемый объем воздуха:
1222,694 л / 0,21 = 5822,35 л
5) Перевести в кубические метры:
5822,35 L = 5822,35 дм 31 м 3 = 1000 дм 3
(5822,35 дм 3 ) (1 м 3 / 1000 дм 3 ) = 5,82 м 3 (до трех знаков инжир)
Пример #5: Пропан (C 3 H 8 ) сгорает в кислороде с образованием углекислого газа и водяного пара. Какой объем углекислого газа образуется при потреблении 2,80 л кислорода.
Какой объем углекислого газа образуется при потреблении 2,80 л кислорода.
Решение:
Поскольку T или P не указаны, мы предполагаем, что реакция происходит при постоянной температуре и давлении.Это означает, что коэффициенты сбалансированного уравнения представляют объемное соотношение, в котором реагируют вещества.
5 объемов O 2 произведут 3 объема CO 2
Отсюда находим:
5/3 равно 2,8/xх = 1,68 л
Если бы мы предположили, что Т и Р изменились в результате реакции, мы не смогли бы решить задачу. Однако не делайте этого предположения. Ваш учитель был бы недоволен.
Пример №6: Метан горит по следующему уравнению:
CH 4 + 2O 2 —> CO 2 + 2H 2 O
Рассчитайте объем воздуха, необходимый для сжигания 10,0 л метана, когда они имеют одинаковые температуру и давление. Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Решение:
Коэффициенты дают молярное соотношение, при котором реагируют метан и кислород при одинаковых T и P.1 соответствует 2, как 10,0 соответствует х
x = требуется 20,0 л чистого кислорода.
20,0 л / 0,20 = требуется 100,0 л воздуха.
Пример №7: Монооксид азота реагирует с кислородом в соответствии с приведенным ниже уравнением:
2NO(г) + O 2 (г) —> NO 2 (г)
Сколько литров NO (реагирующего с избытком кислорода) требуется для получения 3,0 литров NO 2 ?
Решение:
1) Указать соответствующее соотношение объемов:
2:1
2) Напишите соотношение и пропорцию:
2 соответствует 1, поскольку x соответствует 3,0 лx = 6,0 л NO требуется
К настоящему времени вы должны знать, что означает отсутствие упоминания о температуре или давлении для решения проблемы. (Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
(Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
Пример #8: Если стехиометрические количества X и Y поместить в герметичный гибкий контейнер с начальным объемом 30,0 л при нормальных условиях, какой объем Z будет произведен? (X, Y и Z находятся в газообразном состоянии)
2X + Y —> Z
Решение:
Поскольку все они являются газами, молярное отношение равно объемному отношению:
2X + Y = 30,0 лX : Y = 2 : 1 = 20 л : 10 л
n(Y) = n(Z)
, следовательно, v(Y) = v(Z) = 10,0 л произведенного Z.
Пример #9: 200,0 литров H 2 , реагирующих при 25,0 °C и 751,0 торр, сколько потребуется литров O 2 при стандартной температуре?
Решение:
1) Уравнение:
2H 2 (ж) + O 2 (ж) —> 2H 2 O(л)
2) Используйте PV = nRT для расчета молей водорода:
(751,0 торр / 760,0 торр/атм) (200,0 л = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 8,0818 моль
3) Используйте H 2 : O 2 молярное соотношение:
2 к 1 как 8,0818 мл к хx = 4,0409 моль O 2 требуется
4) Используйте PV = nRT для расчета необходимого объема O 2 при SPT:
(1,00 атм) (V) = (4,0409 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 90,52 л
Пример № 10: Готовят смесь, используя 12,0 л NH 3 и 12,0 л Cl 2 , измеренные при одинаковых условиях. Эти вещества реагируют по следующему уравнению:
Эти вещества реагируют по следующему уравнению:
2 NH 3 (г) + 3 Cl 2 (г) —> N 2 (г) + 6 HCl(г)
Когда реакция завершится, каков объем каждого газа (NH 3 , Cl 2 , N 2 и HCl соответственно)? Предположим, что конечные объемы измеряются в идентичных условиях.
Решение:
1) Нужен лимитирующий реагент:
аммиак: 12/2 = 6
хлор: 12 / 3 = 4У нас есть победитель! хлор.
Помните, я могу обращаться с томами так же, как с кротами. Это связано с тем, что при постоянных T и P объемы прямо пропорциональны количеству молей.
2) Конечный объем аммиака:
2 равно 3, а x соответствует 12x = 8,0 л использованного аммиака
Остаточный объем: 12,0 л − 8,0 л = 4,0 л
3) Конечный объем хлора:
Ноль!
4) Конечный объем азота:
3 соответствует 1, как 12 соответствует хх = 4,0 л
5) Конечный объем HCl:
3 соответствует 6, как 12 соответствует хх = 24,0 л
Бонус Пример: Сколько литров O 2 производятся (в СТП), когда достаточное количество KO 2 реагирует с 75,0 л диоксида углерода при -25,0 °C и 215 кПа?
4KO 2 (s) + 2CO 2 (g) —> 2K 2 CO 3 (s) + 3O 2 (g)
Решение №1:
1) Определить, сколько молей СО 2 присутствует:
PV = нРТ(215 кПа) (75,0 л) = (n) (8,31447 л кПа/моль К) (248 К)
n = 7,820121 моль
2) Определить количество молей полученного O 2 :
2 7,820121 моль ––– = –––––––––– 3 х х = 11,73018 моль
3) Определить объем на STP:
PV = нРТ(101,325 кПа) (В) = (11,73018 моль) (8,31447 л кПа/моль К) (273 К)
В = 263 л (до трех знаков фиг.
)
Решение №2:
1) Определить объем CO 2 на СТП (используя комбинированный газовый закон):
П 1 В 1 П 2 В 2 ––––– = ––––– Т 1 T 2
(215 кПа) (75,0 л) (101,325 кПа) (В 2 ) ––––––––––––––– = –––––––––––––––– 248 К 273 К В 2 = 175,1838 Д
2) Определить объем O 2 , произведенный на СТП:
2 175.

 То есть, таким образом, один килограмм цемента необходимо смешивать с тремя килограммами песка или других примесей, при использовании цемента марки М600 и соответственно при использовании марки М400 на один килограмм необходимо два килограмма песка;
То есть, таким образом, один килограмм цемента необходимо смешивать с тремя килограммами песка или других примесей, при использовании цемента марки М600 и соответственно при использовании марки М400 на один килограмм необходимо два килограмма песка;
 5 — для фундаментов, монолитных стен, перекрытий, колонн, балок и ригелей, армирующих поясов в каменных стенах
5 — для фундаментов, монолитных стен, перекрытий, колонн, балок и ригелей, армирующих поясов в каменных стенах
 Она аналогична подвижности П, применяемой для бетонов, но всё же немного отличается — поэтому и показатель используется другой.
Она аналогична подвижности П, применяемой для бетонов, но всё же немного отличается — поэтому и показатель используется другой.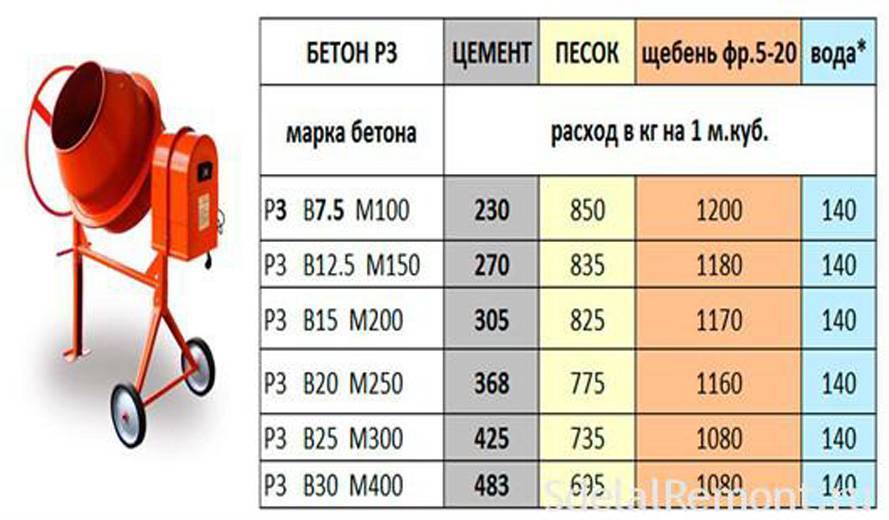
 )
)
 )
)