Правильное устройство: Устройство правильное — Словарь терминов | ПластЭксперт
ProTech УПМ-650 — Правильное устройство
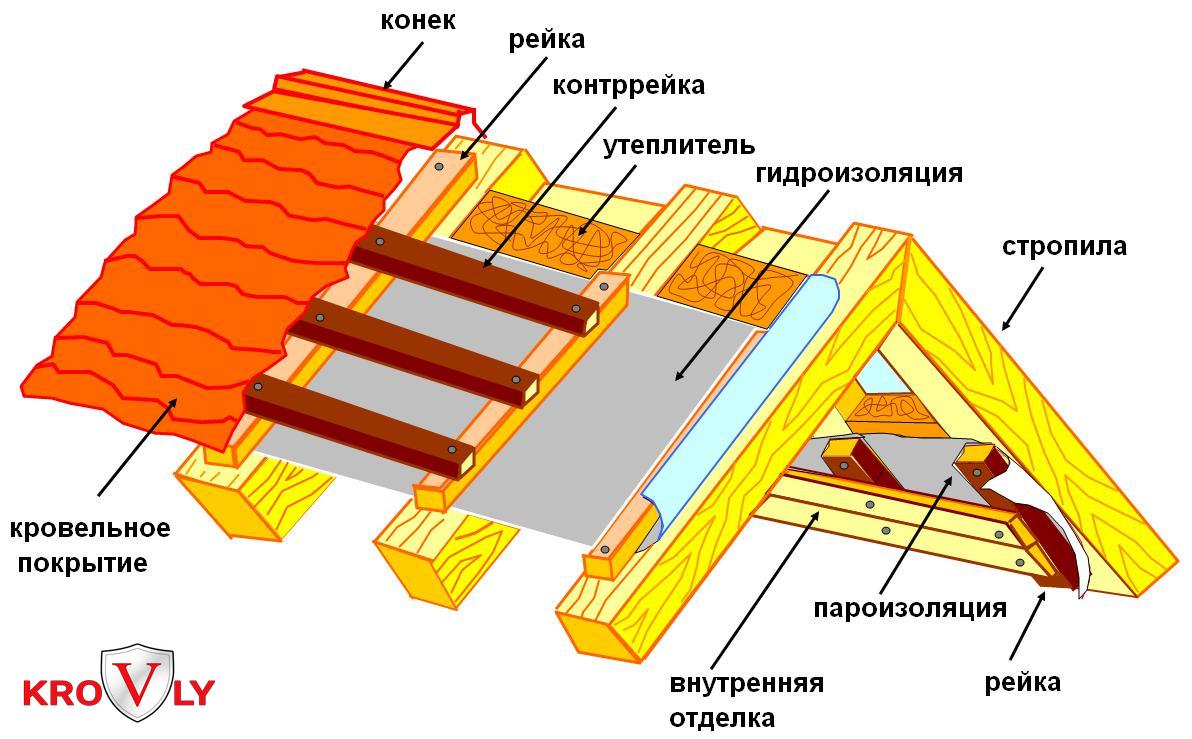
Правильные устройства предназначены для правки листового материала, подаваемого в зону штамповки кузнечно-прессового оборудования, оснащенного подающими устройствами различного типа.
Лизинг и кредит
Технические
характеристики
Правильные устройства предназначены для правки ленты на входе в подающее устройство. Для правки ленты используются 7 правильных и 2 пары подающих валков. Частотный преобразователь и датчики слежения за расходом ленты позволяют плавно производить размотку и правку ленты со штрипса со скоростью от 0,1 до 40 м/мин.
Характеристики
| Толщина материала, мм | 0.7 – 4.0 |
| Максимальная ширина листа, мм | 650 |
| Минимальная ширина листа, мм | 50 |
| Диаметр правящих валков, мм | 60-100 |
Кол-во правящих валков, шт.
| 7 |
| Регулировка скорости | Плавная, автоматическая |
Комплектация
Стандартная комплектация
7 правящих валков
электропривод с плавной регулировкой скорости
пульт управления
пневматический прижим подающих валков
контроль наличия петли по электромагнитному или оптическому датчику
Опциональные комплектующие
регулятор скорости вращения валков на пульте управления
выносной мобильный пульт управления
Производитель
Российская компания «ПроТехнологии» специализируется на поставках металлообрабатывающего оборудования для различных отраслей промышленности, а также монтаже, гарантийном и постгарантийном сервисном обслуживании поставляемых станков.
РоссияЧто нужно знать о ProTech?
Сервисное
обслуживание
Гарантийное обслуживание станка ProTech УПМ-650
Мы проводим техническое обслуживание станка ProTech, приобретенного в нашей компании, а также, по согласованию, оборудования других поставщиков.
Гарантийное обслуживание осуществляется силами сервисной службы ПроТехнологии.
Постгарантийное обслуживание Вашего станка
о сервисной службе
Много лет оказываем сервисную поддержку, а именно, диагностику, ремонт, модернизацию металлообрабатывающего оборудования.
Вам может быть
интересно
Если вы не можете изменить время или часовой пояс на своем устройстве Apple
В настройках даты и времени на устройстве можно задать автоматическую корректировку при смене часового пояса и переходе на летнее время. Узнайте, что делать, если устройство неверно отображает дату, время или часовой пояс либо не выполняет переход на летнее время автоматически.
Автоматическая установка даты и времени
Функция автоматической установки даты и времени может быть недоступна для вашего устройства. * Выполните следующие действия, чтобы убедиться, что ваше устройство может автоматически устанавливать время и часовой пояс.
* Выполните следующие действия, чтобы убедиться, что ваше устройство может автоматически устанавливать время и часовой пояс.
На устройстве iPhone или iPad
- Убедитесь, что на устройстве установлена последняя версия ОС iOS или iPadOS.
- Включите функцию «Автоматически» в меню «Настройки» > «Основные» > «Дата и время». Эта функция автоматически устанавливает дату и время в соответствии с часовым поясом. Этот параметр неактивен?
- Если появляется сообщение о том, что доступна обновленная информация о часовых поясах, перезапустите устройство и все объединенные с ним в пару часы Apple Watch.
- Разрешите устройству использовать текущее местоположение для определения часового пояса. Для этого выберите «Настройки» > «Конфиденциальность и безопасность» > «Службы геолокации» > «Системные службы» и включите параметр «Установка часового пояса».
- Проверьте, правильно ли отображается часовой пояс на устройстве. Для этого выберите «Настройки» > «Основные» > «Дата и время» > «Часовой пояс».

На компьютере Mac
- Убедитесь, что компьютер Mac подключен к Интернету.
- Откройте настройки «Службы геолокации» и убедитесь, что «Службы геолокации» включены. Прокрутите список приложений и сервисов до конца, затем нажмите кнопку «Подробнее» рядом с пунктом «Системные службы». Убедитесь, что включен параметр «Часовой пояс и настройка параметров системы».
- Откройте настройки «Дата и время» и убедитесь, что включены параметры автоматической установки времени и даты, а также автоматической установки часового пояса.
- Перезапустите компьютер Mac.
На Apple TV
Для выполнения этих шагов на устройстве Apple TV HD или Apple TV 4K должна быть установлена tvOS 10 или более поздней версии. Если у вас более старая версия tvOS или более старая модель Apple TV, вы можете установить часовой пояс вручную.
- Убедитесь, что устройство Apple TV подключено к Интернету.
- Выберите «Настройки» > «Основные» > «Часовой пояс».
 Если появляется сообщение о том, что доступна обновленная информация о часовых поясах, перезапустите Apple TV, чтобы получить обновление.
Если появляется сообщение о том, что доступна обновленная информация о часовых поясах, перезапустите Apple TV, чтобы получить обновление. - Если такое сообщение не появляется, нажмите и удерживайте кнопку «Назад» или кнопку «Меню» на пульте дистанционного управления Apple TV, чтобы перейти на экран «Домой». Подождите несколько минут, затем вернитесь к экрану «Настройки» > «Основные» > «Часовой пояс». Если на этот раз сообщение отображается, перезапустите устройство, чтобы получить обновление.
Установка даты и времени вручную
Если устройство по-прежнему отображает неверную дату, время или часовой пояс, то вместо использования функции «Автоматически» введите каждый параметр вручную. Допустим, на устройстве установлена iOS 9 или более ранней версии, а правительство страны или региона приняло решение о смене часового пояса или переходе на летнее время.
На устройстве iPhone или iPad
- Выберите «Настройки» > «Основные» > «Дата и время».

- Отключите функцию «Автоматически». Этот параметр неактивен?
- Установите часовой пояс или дату и время:
- Нажмите «Часовой пояс» и выберите город с нужным часовым поясом.
- Или же нажмите дату, чтобы изменить дату и время.
На компьютере Mac
Откройте настройки «Дата и время» и выключите параметры автоматической установки времени и даты, а также автоматической установки часового пояса. Теперь можно установить время, дату и часовой пояс вручную.
На Apple TV
- Выберите «Настройки» > «Основные» > «Часовой пояс».
- Убедитесь, что функция «Автоматически» выключена, затем выберите часовой пояс.
Подробнее о настройках времени
- Если после синхронизации с компьютером на устройстве отображается неправильное время, то убедитесь что параметр «Дата и время» правильно настроен на компьютере Mac.
- Не рекомендуется вручную корректировать настройки времени для изменения поведения программ (например, таймеров в играх).

- Узнайте о настройках времени Apple Watch, в том числе о том, как настроить на устройстве 24-часовой формат и установить на циферблате более позднее время.
* Возможность включения или выключения автоматической установки может быть доступна не для всех операторов или не во всех странах и регионах. Если на устройстве используется код-пароль для функции «Экранное время» или установлен корпоративный профиль с ограничением функциональных возможностей устройства, то переключатель функции «Автоматически» будет затемнен или заблокирован.
Дата публикации:
Как изучить и продать свое устройство
Как изучить и продать свое устройство
Медицинские устройства, продаваемые в США, подпадают под регулирующий контроль в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах (Закон FD&C) и положениями в Раздел 21- Свод федеральных правил (21 CFR), части 1-58, 800-1299. Регуляторный контроль и пути сбыта основаны на риске устройства. Регуляторный контроль необходим для обеспечения разумной гарантии безопасности и эффективности. Маркетинговые пути включают: Предпродажное уведомление (510(k)), Запрос на классификацию De Novo, Освобождение, Предпродажное одобрение (PMA), Протокол разработки продукта (PDP), Исключение для гуманитарного использования (HDE) и Заявка на получение лицензии на биопрепараты (BLA).
Регуляторный контроль и пути сбыта основаны на риске устройства. Регуляторный контроль необходим для обеспечения разумной гарантии безопасности и эффективности. Маркетинговые пути включают: Предпродажное уведомление (510(k)), Запрос на классификацию De Novo, Освобождение, Предпродажное одобрение (PMA), Протокол разработки продукта (PDP), Исключение для гуманитарного использования (HDE) и Заявка на получение лицензии на биопрепараты (BLA).
Предпродажные требования
Вывод устройства на рынок США может показаться сложным. Выполнение этих четырех шагов может помочь вам ориентироваться в этом процессе.
Четыре шага для вывода устройства на рынок:
- Шаг первый: Классифицируйте свое устройство и изучите применимые нормативные меры
- Шаг второй: Выберите и подготовьте правильное предпродажное представление
- Шаг третий: Отправьте предпродажную заявку в FDA и взаимодействуйте с персоналом FDA во время проверки
- Шаг четвертый: Соблюдение применимых нормативных требований, включая регистрацию учреждения и список устройств
Шаг первый: классифицируйте свое устройство и ознакомьтесь с применимыми мерами контроля
Первым шагом в подготовке устройства к продаже в США является определение того, как FDA классифицировало ваше устройство.
Медицинские устройства относятся к одному из трех классов (I, II или III) в зависимости от степени риска, который они представляют. По мере того, как класс устройств увеличивается с класса I до класса II и класса III, регулирующий контроль также увеличивается, при этом устройства класса I подлежат наименьшему нормативному контролю, а устройства класса III подлежат наиболее строгому нормативному контролю. Классы устройств, нормативный контроль и типы подачи сведены в таблицу:
| Класс | Риск | Потенциальный вред | Регуляторный контроль | Тип представления или освобождение |
|---|---|---|---|---|
| Я | Самый низкий | Присутствует минимальный потенциал вреда | Общий | 510(к) 510(к) Освобожден |
| II | Умеренный | Более высокий риск, чем устройства класса I | 510(к) 510(к) Освобожден | |
| III | Самый высокий | Поддерживают или поддерживают жизнь, имплантированы или представляют потенциальный необоснованный риск заболевания или травмы | Общий и PMA | ПМА |
Для получения дополнительной информации о нормативном контроле (общем и специальном), который может быть применим к вашему устройству, посетите веб-страницу нормативного контроля.
Следующие ресурсы могут помочь вам в определении классификации вашего устройства:
- База данных классификации продуктов FDA
- Панели классификации устройств
- Классифицируйте свое медицинское устройство
- Принадлежности для медицинских устройств
Если ваше медицинское устройство также является электронным продуктом, излучающим радиацию, оно также должно соответствовать применимым нормам 21 CFR, части 1000-1050.
Примечания:
- Если ваш продукт Комбинированный продукт — медицинское устройство плюс другой продукт, регулируемый FDA (например, лекарство, биологические препараты и т. д.), вам следует обратиться в Управление комбинированных продуктов (OCP) FDA по электронной почте по адресу: [email protected]. Основываясь на основном способе действия вашего продукта, OCP сообщит вам, в какой центр FDA вам нужно обратиться, чтобы продать ваш продукт.
- Даже если для вашего медицинского устройства не требуется предпродажная подача, вы все равно должны определить правильную классификацию вашего устройства, чтобы понимать и соблюдать применимые нормативные требования.

Шаг второй: выберите и подготовьте правильное предпродажное представление
Вам следует выбрать и подготовить соответствующее предпродажное представление, если оно требуется для классификации вашего конкретного продукта. Для большинства медицинских устройств соответствующий тип представления указывается в классификации продуктов, которую можно получить из общедоступной базы данных классификации продуктов. Обратите внимание, что для некоторых типов устройств предварительная отправка не требуется. Для получения дополнительной информации см. веб-страницу исключений класса I/II. Если вы определили, что для вашего устройства не требуется предпродажная подготовка, вы можете пропустить второй и третий шаги и перейти к четвертому шагу. К наиболее распространенным типам предпродажной подачи относятся:
- 510(k) (предпродажное уведомление)
- PMA (предпродажное одобрение)
- Запрос на классификацию De Novo
- HDE (освобождение от гуманитарных устройств)
510(k)
Для некоторых устройств класса I и большинства устройств класса II требуется 510(k). В 510(k) спонсор должен продемонстрировать, что новое устройство «по существу эквивалентно» предикатному устройству с точки зрения предполагаемого использования, технологических характеристик и тестирования производительности, если это необходимо. Информацию о том, как подготовить и отправить форму 510(k), см. в Предпродажном уведомлении Device Advice [510(k)].
В 510(k) спонсор должен продемонстрировать, что новое устройство «по существу эквивалентно» предикатному устройству с точки зрения предполагаемого использования, технологических характеристик и тестирования производительности, если это необходимо. Информацию о том, как подготовить и отправить форму 510(k), см. в Предпродажном уведомлении Device Advice [510(k)].
Некоторые устройства класса I и класса II освобождаются от требования об уведомлении 510(k), если они не превышают ограничения освобождения, указанные в 21 CFR xxx.9, где xxx относится к 21CFR 862-892. Например, эластичный бинт, классифицированный в соответствии с 21CFR 880.5075, освобождается от предпродажного уведомления при условии, что он не превышает ограничений, указанных в 21CFR 880.9.
PMA
Для устройств класса III требуется PMA. PMA является наиболее строгим типом подачи заявки на предпродажу. Прежде чем FDA одобрит PMA, спонсор должен предоставить действительные научные доказательства, демонстрирующие разумные гарантии безопасности и эффективности устройства по назначению.
Сведения о том, как подготовить и отправить PMA, см. в разделе Предпродажное одобрение рекомендаций по использованию устройств (PMA).
Запрос на классификацию De Novo
Процесс De Novo обеспечивает путь к классификации новых медицинских изделий, для которых только общие средства контроля или общие и специальные средства контроля обеспечивают достаточную уверенность в безопасности и эффективности для предполагаемого использования, но для которых нет предикатное устройство, продаваемое на законных основаниях. Для получения информации о том, как подготовить и подать запрос De Novo, обратитесь к следующим ресурсам:
- Закон FD&C, раздел 513(f)(2)
- Запрос на классификацию DeNovo (процесс De Novo)
- Оценка автоматического обозначения класса III (процесс De Novo) Резюме
HDE
HDE обеспечивает регуляторный путь для устройств класса III, предназначенных для пациентов с редкими заболеваниями или состояниями. Чтобы устройство имело право на HDE, спонсор должен сначала получить обозначение устройства для гуманитарного использования (HUD), которое предоставляется через заявку в Управление FDA по разработке продуктов для сирот (OOPD).
Информацию о том, как запросить разрешение на использование в гуманитарных целях, см. в разделе Назначение устройства для гуманитарного использования (HUD).
Для получения информации о том, как подготовить и подать заявку HDE, см. следующие ресурсы:
- 21CFR 814, подраздел H
- Исключение для гуманитарных устройств
- Руководство по программе освобождения от использования гуманитарных устройств (HDE)
Дополнительные ресурсы для помощи в подготовке предпродажной документации
FDA разработало несколько различных типов ресурсов, которые помогут вам подготовить предпродажную документацию. К ним относятся следующие:
- Отправка и отслеживание предпродажных заявок на медицинские устройства онлайн: зарегистрируйте учетную запись на портале CDRH для отправки предпродажных заявок CDRH eCopy или eSTAR онлайн
- CDRH Learn: серия обучающих модулей, семинаров и записанных веб-семинаров на основе видео, которые охватывают различные меры политики и руководства.

- CDRH’s Q-Submission Program: Потенциальные заявители будущих предрыночных заявок могут запросить отзыв в FDA через предварительную заявку, которая является частью программы Q-Submission. Мы рекомендуем вам ознакомиться с нашей онлайн-информацией и другими доступными ресурсами, прежде чем отправлять какие-либо запросы на обратную связь.
- CDRH Breakthrough Devices Program: Эта добровольная программа помогает пациентам получить более своевременный доступ к определенным медицинским устройствам, которые лечат или диагностируют опасные для жизни или необратимо изнурительные состояния, ускоряя их разработку, оценку и рассмотрение. Устройства, на которые распространяются заявки на предварительное одобрение (PMA), предварительные уведомления [510(k)] или запросы на классификацию De Novo, могут иметь право на участие. Спонсоры могут в любое время отправить запрос на обозначение прорыва для своего устройства до отправки маркетинговой заявки на устройство.
Информация, которую следует учитывать при подготовке предпродажной документации
Средства контроля конструкции:
Устройства класса II и класса III должны разрабатываться в соответствии с средствами контроля конструкции в соответствии с Регламентом о системе качества (21 CFR 820. 30). Большинство устройств класса I не подпадают под действие Контроля за проектированием. Дополнительную информацию о средствах контроля конструкции см. в Руководстве по контролю конструкции для производителей медицинских устройств.
30). Большинство устройств класса I не подпадают под действие Контроля за проектированием. Дополнительную информацию о средствах контроля конструкции см. в Руководстве по контролю конструкции для производителей медицинских устройств.
Доклинические испытания: Типы информации и испытаний, необходимых для продажи вашего устройства, определяются многими факторами, включая классификацию устройства, принципы работы, технологические характеристики и маркировку. Доклинические испытания, проводимые в поддержку подачи заявки на допродажу медицинского изделия, должны соответствовать Надлежащим лабораторным практикам (GLP) в 21 CFR 58. Для получения дополнительной информации см. Рекомендуемое содержание и формат полных отчетов о тестировании для неклинических лабораторных испытаний производительности на допродаже. Материалы.
Стандарты консенсуса: FDA поощряет использование признанных FDA стандартов консенсуса при подаче заявок на продажу. Неотъемлемой частью наименее обременительного подхода к обзору устройств является опора на международные согласованные стандарты. Соответствие является добровольным, если только стандарт не включен посредством ссылки в нормативные акты (см. Документы Федерального реестра стандартов медицинских устройств). Руководство, Надлежащее использование стандартов добровольного консенсуса в предпродажных представлениях медицинских изделий , объясняет, как использовать стандарты при отправке устройств, и описывает документацию, необходимую для поддержки их использования, включая декларации о соответствии и отчеты об испытаниях. По вопросам, касающимся надлежащего использования согласованных стандартов, вы можете обращаться по электронной почте по адресу [email protected].
Соответствие является добровольным, если только стандарт не включен посредством ссылки в нормативные акты (см. Документы Федерального реестра стандартов медицинских устройств). Руководство, Надлежащее использование стандартов добровольного консенсуса в предпродажных представлениях медицинских изделий , объясняет, как использовать стандарты при отправке устройств, и описывает документацию, необходимую для поддержки их использования, включая декларации о соответствии и отчеты об испытаниях. По вопросам, касающимся надлежащего использования согласованных стандартов, вы можете обращаться по электронной почте по адресу [email protected].
FDA рекомендует производителям рассмотреть возможность участия в программе добровольной схемы аккредитации для оценки соответствия (ASCA). Эта добровольная пилотная программа предназначена для уменьшения нагрузки, связанной с отдельными предпродажными заявками, за счет повышения последовательности и предсказуемости в подходе FDA к оценке соответствия стандартам ASCA в предпродажных проверках медицинских устройств. FDA выпустило три окончательных руководящих документа, касающихся добровольной программы ASCA, которые можно загрузить с веб-страницы ASCA. По вопросам, касающимся добровольной программы ASCA, вы можете обращаться по адресу [email protected].
FDA выпустило три окончательных руководящих документа, касающихся добровольной программы ASCA, которые можно загрузить с веб-страницы ASCA. По вопросам, касающимся добровольной программы ASCA, вы можете обращаться по адресу [email protected].
Клинические доказательства: PMA, HDE и некоторые 510(k)s и запросы на классификацию De Novo требуют клинических доказательств. Перед началом клинического исследования спонсору исследования может потребоваться получить разрешение FDA на получение разрешения на использование исследовательского устройства (IDE). Исследование также должно быть одобрено соответствующим Институциональным наблюдательным советом (IRB). Клинические исследования должны соответствовать всем применимым правилам IDE и надлежащей клинической практике (GCP). Для получения дополнительной информации о правилах IDE и GCP см. Исключение для исследовательских устройств (IDE).
Маркировка: Маркировка устройства должна быть написана в соответствии с правилами маркировки и включена в предпродажную заявку.
Для получения информации о маркировке устройств см. следующие ресурсы:
- Маркировка 21 CFR 801
- Система маркировки устройств и уникальная система идентификации устройств (UDI)
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) создало уникальную систему идентификации устройств (UDI) для надлежащей идентификации медицинских устройств при их распространении и использовании. Правило UDI стало окончательным в сентябре 2013 года, и в течение нескольких лет оно будет вводиться поэтапно, главным образом на основе классификации устройств. После полного внедрения система UDI предложит ряд преимуществ для промышленности, FDA, потребителей, поставщиков медицинских услуг и систем здравоохранения, включая повышение безопасности пациентов и послепродажный надзор. Дополнительные сведения о требованиях к UDI см. в следующих источниках:
- Уникальный идентификатор устройства (UDI)
- Глобальная база данных UDI (GUDID)
- CDRH Learn (модули UDI)
Шаг третий: подготовьте соответствующую информацию для предпродажной подачи
После того, как вы подготовили соответствующую предпродажную заявку для вашего устройства, вам необходимо отправить ее в FDA и взаимодействовать с персоналом FDA во время ее рассмотрения. Прежде чем отправить заявку в FDA, вы должны знать следующее:
Прежде чем отправить заявку в FDA, вы должны знать следующее:
- Плата за использование медицинского устройства: Существует плата за использование, связанная с отправкой определенных маркетинговых приложений. Информацию о том, какие приложения подлежат оплате с пользователей, а также о сборах за использование этих приложений, см. в разделе Сборы с пользователей медицинских устройств.
- Программа определения малого бизнеса (SBD): Предприятие, которое квалифицировано и сертифицировано как «малое предприятие», имеет право на существенное снижение большинства этих сборов с пользователей. Дополнительную информацию о программе SBD см. в документе «Сниженная плата за пользование медицинскими устройствами: программа определения малого бизнеса (SBD)».
- Электронная копия: Для получения подробной информации о том, как подготовить электронную копию, см. Программу электронной копии для подачи заявок на медицинское оборудование.

- eSTAR: eSTAR — это интерактивная форма в формате PDF, которая помогает заявителям в процессе подготовки комплексной заявки на медицинское устройство. Для получения дополнительной информации см.: Добровольная программа eSTAR.
После того, как ваше заявление будет получено FDA, вы должны знать следующее:
- Административная проверка: После получения предпродажной заявки FDA проводит административную проверку, чтобы оценить, является ли заявка достаточно полной, чтобы ее можно было принять для рассмотрения по существу. Пожалуйста, ознакомьтесь с Политикой отказа в принятии для 510 (k) s, Проверками приема и подачи заявок на допродажное утверждение (PMA) или Проверка приемлемости для запросов на классификацию De Novo и программы освобождения от гуманитарных устройств (HDE): Руководство для промышленности и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов. Персонал.
- Интерактивное рассмотрение: Пока заявка находится на рассмотрении, сотрудники FDA общаются с заявителями, чтобы повысить эффективность процесса рассмотрения.
 См.: Типы коммуникаций во время рассмотрения заявок на медицинское оборудование.
См.: Типы коммуникаций во время рассмотрения заявок на медицинское оборудование. - Отправка и отслеживание предпродажных заявок на медицинские устройства в Интернете: Портал CDRH. простой, лаконичный формат.
Шаг четвертый: Соблюдение применимых нормативных требований, включая регистрацию предприятий и список устройств
Регулятивные меры — это требования, основанные на оценке рисков, которые применяются к медицинским устройствам и обеспечивают надзор FDA для обеспечения разумной безопасности и эффективности медицинских устройств.
Устройства всех трех классов (класс I, II и III) подлежат общему контролю, если только они не освобождены от правил, которые частично требуют, чтобы предприятия по производству устройств: (1) регистрировали свои предприятия и составляли список медицинских устройств, которые они продают с FDA; (2) производить свои устройства в соответствии с Надлежащей производственной практикой; (3) маркировать свои устройства в соответствии с правилами маркировки; и (4) нельзя фальсифицировать или неправильно маркировать. Если устройство освобождено от одного из общих мер контроля, такое освобождение указано в правилах классификации для этого устройства.
Если устройство освобождено от одного из общих мер контроля, такое освобождение указано в правилах классификации для этого устройства.
Предприятие по производству устройств должно зарегистрировать свое предприятие и перечислить свои устройства в FDA. Информацию о том, как зарегистрироваться и составить список, можно найти на странице Регистрация и список устройств.
Если устройство требует предварительной подачи на рынок до выхода на рынок (т. е. медицинское устройство не является исключением), предприятия по производству устройств должны дождаться получения разрешения или одобрения FDA, прежде чем регистрировать и вносить в список.
Регистрация предприятия по производству устройств, присвоение регистрационного номера или внесение медицинского устройства в список никоим образом не означает разрешения или одобрения предприятия или его продукции FDA.
Драйвер устройства не установлен или аппаратное устройство не работает должным образом после установки пакета обновления для Windows Vista
Эта статья предназначена для пользователей компьютеров начального и среднего уровня.
Симптомы
После установки пакета обновления для Windows Vista на компьютер под управлением Windows Vista аппаратное устройство работает неправильно. Кроме того, если вы откроете Диспетчер устройств, вы можете увидеть восклицательный знак рядом с именем аппаратного устройства.
Разрешение
Возможно, драйвер устройства не установлен или установлен неправильно. Выполните следующие действия, чтобы определить, может ли диспетчер устройств найти устройство и при необходимости установить или переустановить драйвер устройства:
Шаг 1. Определите, найден ли драйвер устройства в диспетчере устройств
Нажмите Start , введите Диспетчер устройств в поле Start Search и нажмите ENTER.

Нажмите Продолжить . Отображается диалоговое окно Диспетчер устройств .
Если появится запрос на ввод пароля администратора или подтверждение, введите пароль или нажмите Продолжить .В списке типов устройств щелкните тип устройства, а затем найдите конкретное устройство, которое не работает.
Если рядом с именем неработающего устройства появляется восклицательный знак, диспетчер устройств не может найти драйвер устройства. Перейдите к шагу 3, «Используйте Центр обновления Windows, чтобы найти драйвер устройства».
org/ListItem»>
Если рядом с именем устройства, которое работает неправильно, не отображается восклицательный знак, перейдите к шагу 2, «Удалите и переустановите драйверы устройств».
Закрыть Диспетчер устройств .
Шаг 2. Удалите и переустановите драйверы устройств
Если рядом с именем устройства нет восклицательного знака и устройство работает неправильно, вручную удалите и переустановите драйверы устройств. Для этого выполните следующие действия:
Нажмите Start , введите Диспетчер устройств в поле Start Search и нажмите ENTER.

Нажмите Продолжить . Отображается диалоговое окно Диспетчер устройств .
Если появится запрос на ввод пароля администратора или подтверждение, введите пароль или нажмите Продолжить .В списке типов устройств выберите тип устройства, а затем найдите конкретное устройство, которое не работает.
Щелкните устройство правой кнопкой мыши и выберите Свойства .
Перейдите на вкладку Драйвер .

Щелкните Удалить .
Щелкните OK .
В диалоговом окне Диспетчер устройств щелкните меню Действие , а затем щелкните Сканировать аппаратные изменения .
Вы можете получить сообщение о том, что Windows должна установить драйвер для вашего неизвестного устройства. Если вы получили это сообщение, нажмите Найдите и установите программное обеспечение драйвера (рекомендуется) .
org/ListItem»>
Вы также можете получить сообщение о том, что аппаратное устройство устанавливается и что удаленное устройство теперь присутствует в диспетчере устройств.
Примечание. Если вы не получили сообщение или аппаратное устройство не установлено, перейдите к шагу 3 «Используйте Центр обновления Windows, чтобы найти драйвер устройства».
Если устройство установлено правильно и работает правильно, вы устранили проблему и все готово. Если устройство установлено, но по-прежнему не работает должным образом, перейдите к разделу «Дальнейшие действия».
Шаг 3. Используйте Центр обновления Windows, чтобы найти драйвер устройства
Примечание. Чтобы использовать Центр обновления Windows, необходимо войти на компьютер в качестве администратора. Чтобы убедиться, что вы вошли в систему Windows с учетной записью администратора компьютера, посетите следующий веб-сайт Microsoft:
http://support. microsoft.com/gp/admin
Выполните следующие действия, чтобы использовать Центр обновления Windows для поиска драйвера устройства:
microsoft.com/gp/admin
Выполните следующие действия, чтобы использовать Центр обновления Windows для поиска драйвера устройства:
Щелкните Пуск , щелкните Все программы , а затем щелкните Центр обновления Windows .
Если появится запрос на ввод пароля администратора или подтверждение, введите пароль или нажмите Продолжить .Щелкните Проверить наличие обновлений .
Чтобы определить, доступны ли обновленные драйверы, щелкните Просмотр доступных обновлений .

Если доступны обновления, щелкните драйвер, который требуется установить, а затем щелкните Установить .
Если вас попросят ввести пароль администратора или подтвердить, введите пароль или нажмите 9.0306 Продолжить .
Если Центр обновления Windows не может найти требуемый драйвер устройства, обратитесь к производителю устройства, чтобы загрузить последнюю версию драйвера устройства для Windows Vista. Сведения о том, как это сделать, см. в разделе «Дополнительная информация».
Если эти методы не помогли решить проблему, перейдите к разделу «Дальнейшие действия».
СЛЕДУЮЩИЕ ШАГИ
Если эти шаги не помогли решить вашу проблему, вы можете обратиться за помощью к кому-то из своих знакомых или к производителю устройства. Вы также можете использовать веб-сайт службы поддержки клиентов Microsoft, чтобы найти другие решения вашей проблемы. Некоторые услуги, предоставляемые веб-сайтом службы поддержки клиентов Майкрософт, включают следующее:
- org/ListItem»>
Центры решений: просмотрите часто задаваемые вопросы по конкретным продуктам и информацию о поддержке.
Другие варианты поддержки: используйте Интернет, чтобы задать вопрос, связаться со службой поддержки клиентов Майкрософт или оставить отзыв.
База знаний с возможностью поиска: поиск информации о технической поддержке и средств самопомощи для продуктов Microsoft.
Если у вас по-прежнему возникают проблемы после использования этих веб-сайтов Microsoft или если вы не можете найти решение проблемы на веб-сайте службы поддержки Microsoft, щелкните следующую ссылку, чтобы связаться со службой поддержки.
http://support.

 Если появляется сообщение о том, что доступна обновленная информация о часовых поясах, перезапустите Apple TV, чтобы получить обновление.
Если появляется сообщение о том, что доступна обновленная информация о часовых поясах, перезапустите Apple TV, чтобы получить обновление.

 См.: Типы коммуникаций во время рассмотрения заявок на медицинское оборудование.
См.: Типы коммуникаций во время рассмотрения заявок на медицинское оборудование.