Какой раствор нужен для: Раствор для кладки печи из кирпича своими руками – основные составы и пропорции
Раствор для кладки печи из кирпича своими руками – основные составы и пропорции
Важный этап в постройке печки для деревенского дома или бани – приготовление надежного кладочного раствора.
Правильно замешанный раствор для кладки печи влияет на герметичность, долговечность, термостойкость и безопасность готовой конструкции.
Хорошая смесь для кладки печи устойчива к высоким температурным режимам, механическим повреждением и растрескиванию.
Содержание статьи
Особенности выбора материала
Процесс возведения современных печей разделен на несколько этапов:
- Первый этап – обустройство печного фундамента при помощи бетонного состава;
- Второй этап – кладка печи из огнеупорного кирпича с использованием кладочной соединительной массы на основе глины;
- Третий этап – облицовка печи штукатурным составом.

Наиболее важным является этап непосредственной кладки и приготовление надежной основы, которая должна обладать высокими эксплуатационными характеристиками – жаростойкостью, адгезией, водонепроницаемостью, прочностью и долговечностью.
Для обустройства современных печей применяется несколько вариантов кладочных растворов: глиняный, известковый и цементный.
Кладочные растворы бывают простыми и сложными. Простые состоят из одного вида вяжущего компонента и заполнителя; сложные смеси включают от двух и более вяжущих материалов и несколько заполнителей. Вяжущие компоненты – известь, глина и цемент.
Чтобы приготовить раствор для выполнения кирпичной кладки потребуются следующие инструменты:
- Миксер;
- Емкость для замеса;
- Сито;
- Кельма;
- Мастерок;
- Пластиковый шпатель;
- Строительный термометр;
- Весы.
На основе глины
Один из самых дешевых и доступных типов соединительных печных смесей. Глиняный раствор для кладки печей характеризуется повышенной жирностью, которая определяет степень пластичность, жаростойкости и прочности готового материала.
Глиняный раствор для кладки печей характеризуется повышенной жирностью, которая определяет степень пластичность, жаростойкости и прочности готового материала.
Раствор для печи из натуральной глины бывает:
- Жирный – отличается пластичностью, прочностью, но быстрым появлением трещин после высыхания;
- Нормальный – достаточно пластичен и устойчив к растрескиванию, дает небольшой процент усадки после сушки. Способен выдерживать высокие температуры до 110 градусов;
- Тощий – непластичен и недолговечен, восприимчив к быстрому расслаиванию и крошению.
Огнеупорный раствор из глины готовится на основании трех компонентов: глины, песка и воды. Подобный состав устойчив к растрескиванию и пересыханию, обеспечивает надежное обустройство печи из кирпича.
Чтобы построить печник, рекомендуется использовать жирные и нормальные составы, которые обладают повышенной прочностью, пластичностью и устойчивостью к расслаиванию.
Качество глины определяет количество песка, необходимого для замеса раствора. Для работ используется глина и очищенная вода с низким содержанием примесей. Для кладки 100 кирпичей в среднем используется до 20 литров чистой воды.
Для работ используется глина и очищенная вода с низким содержанием примесей. Для кладки 100 кирпичей в среднем используется до 20 литров чистой воды.
Для приготовления раствора используется карьерный или речной песок мелкой фракции без дополнительных примесей. Перед использованием его обязательно просеивают через мелкоячеистое сито. Если в нем имеются примеси гравия, тогда рекомендуется использовать сито с размером ячеек до 10 мм. Для мелкофракционного материала подойдет сито с 2 мм ячейками.
Перед добавлением других компонентов глиняную основу рекомендуется проверить на пластичность. Как сделать подобную проверку? Для этого небольшую доску следует опустить в полученную смесь для кладки печи и определить ее толщину. Она должна быть в меру густой и тягучей. Если имеется лишняя жидкость, тогда стоит добавить немного вяжущего компонента, периодически размешивая и тестируя смесь на пластичность.
Оптимальная толщина соединительного материала – 2 мм, что свидетельствует о правильном соблюдении пропорций всех компонентов.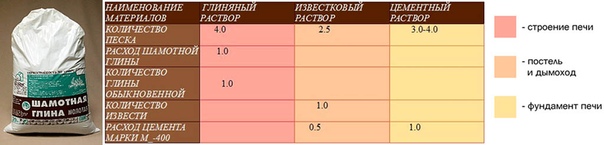 Готовая кладочная масса получается тягучей и не очень плотной.
Готовая кладочная масса получается тягучей и не очень плотной.
Подходящая плотность раствора для кладки зависит от соотношения основных компонентов в ней – глины и песка соответственно:
- Жирная масса – 1:2;
- Нормальная масса – 1:1;
- Тощая масса – 2:1.
Способы приготовления глиняного состава
Как приготовить качественную соединительную массу на основе глины? Существует несколько проверенных способов.
Способ №1
Нужный объем глины замачивается на 24 часа, добавляется вода для получения густой массы. Полученный материал аккуратно процеживается, затем в него добавляется песок и еще раз замешивается. Важно избегать образования глинистых луж, которые можно устранить небольшой порцией вяжущего компонента.
Способ №2
В емкости соединяется шамотный песок и глина в равных пропорциях, добавляется очищенная вода (1/4 часть от объема глины). Все компоненты тщательно перемешиваются до получения однородной массы.
Способ №3
Состав замешивается на основе суглинков.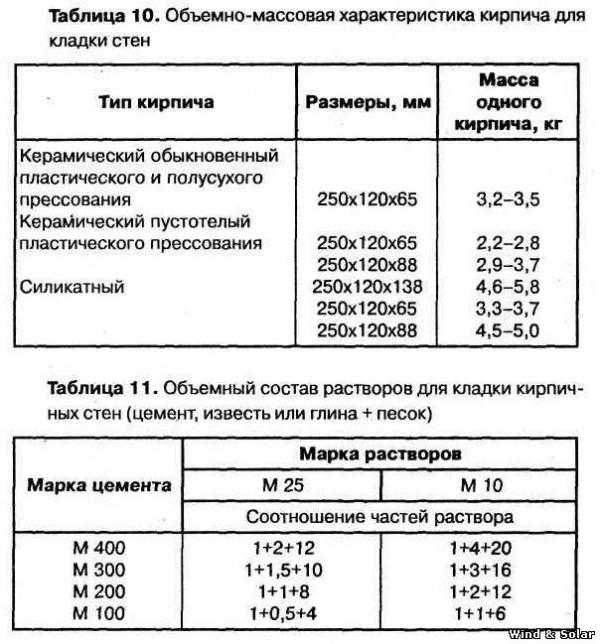 Этот рецепт предусматривает приготовление 10 различных вариантов раствора, из которого выбирается лучший.
Этот рецепт предусматривает приготовление 10 различных вариантов раствора, из которого выбирается лучший.
Для первого: 10 объемов суглинки, 1 объем песка и 1 объем цемента и т.д. по убыванию объема суглинки. Десять полученных основ помещаются в разные емкости и оставляются на просушку в течение 5-6 дней. По завершению отведенного времени определяется наиболее качественный состав раствора с минимальной степенью усадки и устойчивостью к растрескиванию.
Способ №4
К глине добавляется песок и ¼ воды. Все компоненты перемешиваются для получения густой тягучей массы. Для повышения прочности в подобную смесь рекомендуется добавить каменной соли или цемента. На ведро смеси – до 250 г соли и ¾ литра цемента. Соль предварительно растворяют в воде, а цемент разводят водой до густой консистенции, после чего добавляют в готовую основу.
На основе извести
Для строительства фундамента и печного дымохода рекомендуется использовать состав на основе извести и цемента.
Особое тесто, получаемое путем смешивания негашеной извести и воды в соотношении 3:1. В готовое тесто добавляется просеянный песок через мелкоячеистое сито в соотношении 3:1 – на 3 объема песка 1 объем теста. Готовая масса разбавляется водой до получения густой массы.
В готовое тесто добавляется просеянный песок через мелкоячеистое сито в соотношении 3:1 – на 3 объема песка 1 объем теста. Готовая масса разбавляется водой до получения густой массы.
Смесь для кладки печи на основе извести получается достаточно пластичной и прочной.
Показатель жирности состава из извести определяется количеством песка. Для чрезмерно жирной смеси требуется 5 объемов песочной составляющей, для нормальной – не более 3 объемов.
Увеличить прочность и водостойкость можно путем добавления цемента. Для приготовления подобного состава необходимо использовать компоненты в таких пропорциях (части):
- Цемент – 1;
- Песок – 10;
- Известковое тесто – 2.
Приготовление раствора имеет такую последовательность действий: цементные и песочные компоненты соединяются в отдельной емкости. Готовое тесто на основе извести разбавляют очищенной водой до получения густой консистенции. В разведенное тесто вводят сыпучие компоненты и перемешивают. Для увеличения вязкости, состав разбавляют водой.
На основе цемента
Какой раствор нужен для обустройства печного фундамента и кладки наружной части дымоходной трубы? Ответ прост – состав на основе цемента, песка и воды. По своей прочности он равен известковому аналогу, но для затвердения требует гораздо больше времени.
Оптимальный состав готовой массы получается в следующих пропорциях – 3:1 (на 3 объема песка 1 объем цемента марки М 300 или 400). Перед смешиванием все компоненты просеиваются через мелкоячеистое сито. В глубокую емкость засыпается просеянный песок, добавляется цемент и перемешиваются до однородной массы. В конце добавляется вода.
Готовую смесь нужно довести до густой и тягучей консистенции. Определить подходящую густоту достаточно просто – состав должен оставаться подвижным, но при этом не стекать с лопаты при ее повороте до 45 градусов.
Чтобы возвести монолитный печник, рекомендуется использовать огнеупорную бетонную смесь в следующих пропорциях (части):
- Цемент (М 400) – 1;
- Щебень или гравий – 2;
- Мелкозернистый песок – 2;
- Песок из шамота – 0,4.

Чтобы печник имел прочный фундамент, рекомендуется подготовить раствор для кладки, состоящий из крупно фракционного гравия, песка, цемента (пропорции 3:3:1).
Для увеличения прочности можно использовать кварцевую крошку. Огнеупорная бетонная смесь получается крупно фракционной, повышенной плотности и водонепроницаемости.
Для правильного замеса на 25 кг готовой смеси требуется 10 литров воды. Оптимальный способ смешивания – механический при помощи бетономешалки. Готовый состав застывает быстро, поэтому рекомендуется использовать его сразу после приготовления.
Строительство печи имеет свои отличительные особенности в отношении правильного выбора состава и приготовления кладочного раствора. Для разных элементов конструкции используются различные составы.
Какой раствор лучше применять для кладки дровяных печей из кирпича: виды смесей, правила выбора
В каждом частном доме используются различные системы обогрева. В последнее время у многих владельцев возникает желание устроить в своем жилище печь. И это вполне понятно, ведь она хорошо прогревает дом и сохраняет тепло в течение длительного времени. Ее можно топить обычными дровами, которые можно заготовить самостоятельно, тем самым снизив затраты на обогрев дома, или использовать уголь.
И это вполне понятно, ведь она хорошо прогревает дом и сохраняет тепло в течение длительного времени. Ее можно топить обычными дровами, которые можно заготовить самостоятельно, тем самым снизив затраты на обогрев дома, или использовать уголь.Если вы осознали необходимость устройства в своем доме печи, то выполнить работу своими руками можно довольно просто. Главное — заранее ознакомиться с инструкцией по кладке печи, подготовить необходимые инструменты и использовать качественные материалы.
Обратитесь к любому квалифицированному специалисту, и он вам скажет, что половина успеха при строительстве печи зависит от используемой кладочной смеси. К этим составам предъявляются определенные требования, о которых необходимо знать.
Какой применять раствор для кладки печи?
Когда владелец частного дома решил устроить в жилище печь, то главная сложность, с которой он сталкивается, заключается в том, что высоким термическим нагрузкам будут подвергаться стенки печи в процессе эксплуатации сооружения. Традиционно печники при кладке этого сооружения используют раствор из глины, предназначенный именно для кладки печей.
Традиционно печники при кладке этого сооружения используют раствор из глины, предназначенный именно для кладки печей.Главный связующий компонент – глина. Когда происходит её нагрев, то этот материал набирает прочность, при этом свою эластичность под воздействием температуры он не теряет. Поэтому неудивительно то, что готовые смеси и самодельные растворы в качестве основной составляющей содержат в себе глину. Она выступает не только в роли связующего компонента, но и в качестве пластификатора.
Виды смесей
В настоящее время для кладки печей можно использовать различные составы. С основными видами этих составов мы познакомим вас ниже.
Готовые составы
В эту группу смесей входят огнеупорные материалы, которые могут использоваться для кладки печи. Кроме них сюда же можно отнести и составы, которые дают возможность проводить работы с такими материалами, как керамогранит и природный камень.
Строительные смеси универсального применения
Их назначением является кладка печей.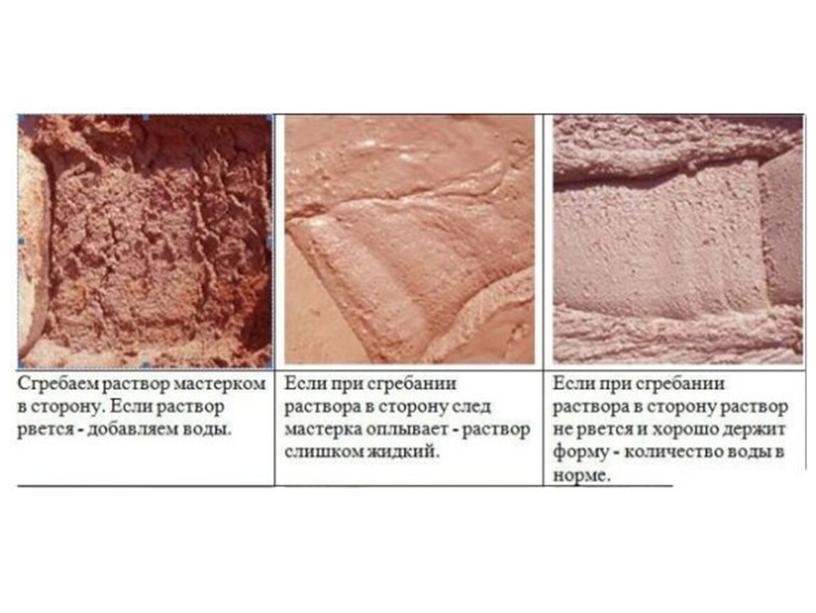 Они дают возможность проводить работы с кирпичом. Помимо этого их можно использовать для отделки и штукатурки поверхности сооружения.
Они дают возможность проводить работы с кирпичом. Помимо этого их можно использовать для отделки и штукатурки поверхности сооружения.
Смеси для кладки печей самостоятельного изготовления
Нередко владельцы частных домов, решившие построить печь, раствор для кладки готовят своими руками. Для создания раствора потребуется приобрести основные компоненты будущего состава:
- песок;
- глина;
- пластификаторы.
Их можно без проблем можно купить в любом строительном магазине. После этого они смешиваются между собой в определенной пропорции. Также все компоненты для приготовления состава можно заготовить в карьере.
Если для ведения работ по кладке печей используется смесь из цемента и песка, то её нанесение должно производиться тонким слоем. Следует знать, что чем меньше его толщина, тем выше прочность. Выбирая готовую смесь, необходимо обращать внимание на характеристики состава. Ознакомиться с ними можно, если взглянуть на мешок со смесью.
Готовые составы
Готовым составам для кладки печей присуще одно преимущество. Процесс приготовления смеси не занимает много времени и не доставляет больших проблем. Мастеру требуется только добавить в сухую смесь необходимое количество воды, а потом провести тщательное перемешивание. Пластификаторы составы заводского изготовления уже содержат. Поэтому после приготовления она может сразу применяться. Чтобы при использовании шов имел высокие свойства в плане прочности и при этом был бы достаточно эластичным, рекомендуется следующее:- выполнять замешивание состава необходимо с использованием миксера. Когда перемешивание производится вручную, то в смесь добавляется слишком большое количество воды, что крайне негативно влияет на свойства раствора. Недопустимым является выполнение повторного замешивания после того, как смесь застыла;
- для приготовления раствора для кладки печной трубы из кирпича необходимо приобретать специальный раствор.
 На мешке можно обнаружить соответствующие обозначения;
На мешке можно обнаружить соответствующие обозначения; - при приготовлении раствора необходимо замешивать такое количество глины, какое можно потратить за один час работы;
- проводить работы по кладке печей необходимо в помещении при температуре не ниже 10 градусов;
- растворы, предназначенные для кладки печей, имеют в своем составе пластификатор, который исключает их быстрое высыхание. Высыхание происходит равномерно, поэтому нарушение целостности шва не происходит. На его поверхности не появляются трещины. После завершения работ по кладке печи топка печи должна производиться только по прошествии трое суток после окончания процесса. При этом прогрев необходимо выполнять при температуре 300 градусов не более часа;
- не ранее, чем через 4 недели необходимо проводить облицовку с момента начала интенсивной эксплуатации печи. Для этого можно применять шамотный раствор;
- после того как будет проведён первый прогрев сооружения, возможно появление на поверхности швов высолов.
 Для того чтобы убрать эти полосы, необходимо использовать влажную тряпку. Применять ее следует после остывания печи.
Для того чтобы убрать эти полосы, необходимо использовать влажную тряпку. Применять ее следует после остывания печи.
Глиняный раствор
Чтобы изготовить глиняный раствор самостоятельно, необходимо иметь определенный опыт в этом деле. При этом нужно соблюдать пропорции раствора для печного кирпича.К глине для кладки печей , используемой в растворах, предъявляются определенные требования:
Для кладочных работ можно использовать три сорта глины: жирную, тощую, среднюю.
Соотношение глины с песком определяют на основании вида, к которому она принадлежит. Для устройства печей чаще всего используют средний сорт глины.
Для кладки дымохода используют шамотную глину. Также она применяется и для создания топки.
При кладке печей о замесе глины необходимо побеспокоиться заранее. Такие качества, как эластичность и прочность определяются грамотностью вымешивания и подготовкой материала.
Конечные свойства готового глиняного раствора во многом зависят от способа его приготовления.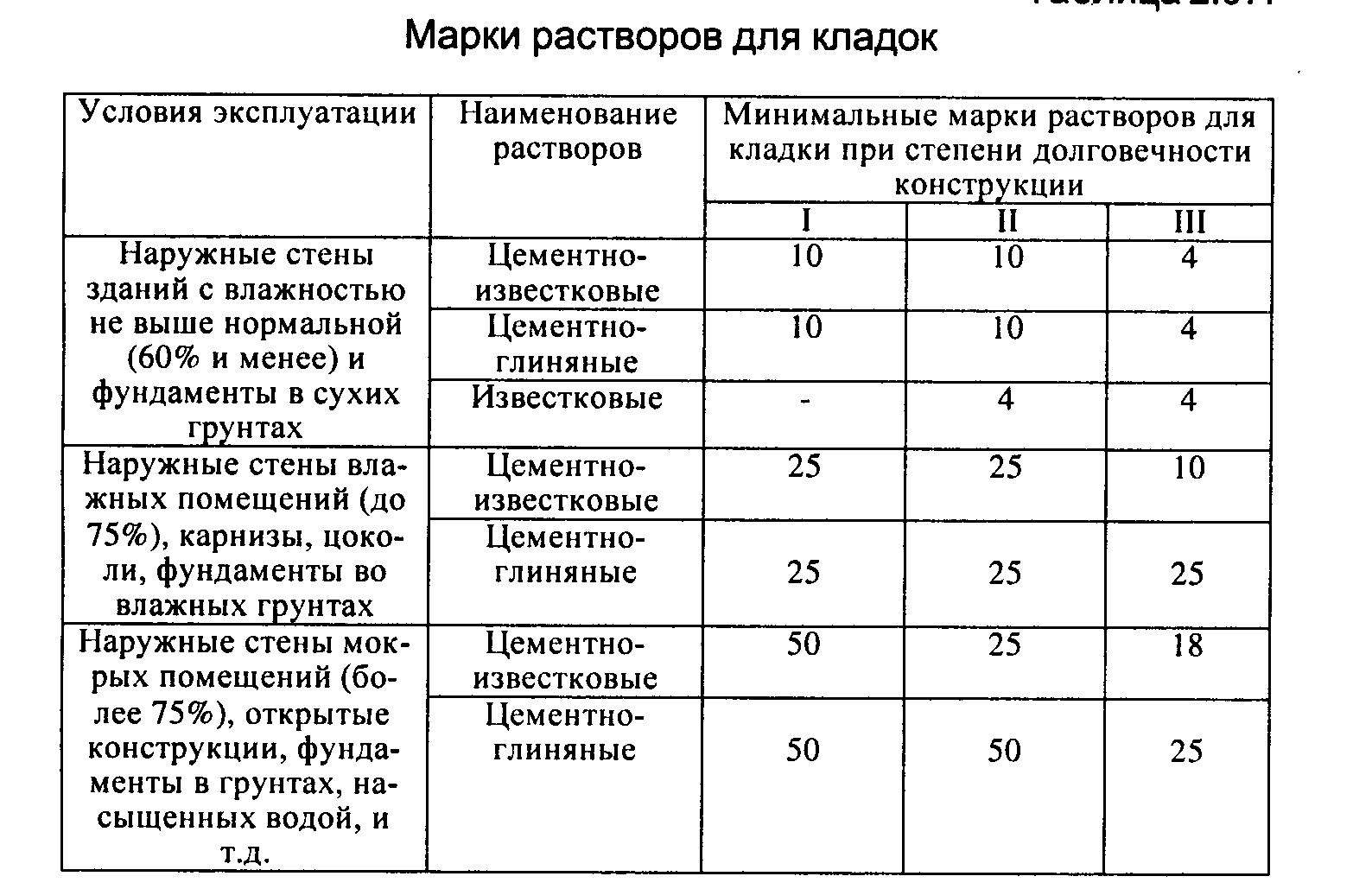 Следует не забывать, что приходится выдерживать температурные нагрузки до 1000 градусов Цельсия. При этом недопустимым является снижение прочностных качеств и возникновения его деформации.
Следует не забывать, что приходится выдерживать температурные нагрузки до 1000 градусов Цельсия. При этом недопустимым является снижение прочностных качеств и возникновения его деформации.
Как выбрать глину
Заменить каким-либо другим компонентом глину в растворе для кладки печи практически невозможно. Поэтому к качеству этой составляющей предъявляются высокие требования. Изготовление раствора для печных работ преследует еще одну цель — создать состав, который при эксплуатации не будет расширяться и сужаться, как огнеупорный кирпич.
Глина, которая соответствует этим требованиям, должна подбираться для каждой части печи. При этом необходимо учитывать следующее:
- соотношение песка и глины в приготавливаемых составах должно быть оптимальным. Поэтому для кладки печи лучшее решение — использование смесей, обладающих высокими свойствами в плане жаростойкости;
- при выполнении кладки готовыми растворами расход находится на уровне 25 кг на каждые 90 кирпичей при условии, что толщина шва составляет 3 мм;
- для печных работ не следует использовать жирную глину.
 Хотя с её укладкой на поверхность кирпича не возникает проблем, но после высыхания происходит ее растрескивание, и она не в состоянии держать кладку;
Хотя с её укладкой на поверхность кирпича не возникает проблем, но после высыхания происходит ее растрескивание, и она не в состоянии держать кладку; - для приготовления раствора для кладки используют глину средней жирности. При этом для того, чтобы повысить прочностные характеристики, в состав добавляется цемент. Для обеспечения быстрого высыхания дополнительно вносится известь;
- качество материала проверяет тогда, когда завершён замес глины. Обычно при приготовлении состава в него вносится различное количество песка, а потом делают заготовки из каждого полученного состава. Когда они высохли, то необходимо выбирать тот состав, который не имеет трещин и обладает высокой прочностью;
- чтобы не возникало перерыва при проведении работ, необходимо заранее готовить состав для каждого дня.
Если зайти в любой строительный магазин, то там можно обнаружить различные компоненты, которые можно использовать при приготовлении раствора. Что следует принимать во внимание при выборе глины?
- Белая глина – этот материал присутствует во многих огнеупорных составах в качестве главной составляющей.
 Однако использовать ее для кладки печи можно лишь тогда, если сооружение будет топиться дровами, а температура в ней в процессе эксплуатации будет превышать 1000 градусов.
Однако использовать ее для кладки печи можно лишь тогда, если сооружение будет топиться дровами, а температура в ней в процессе эксплуатации будет превышать 1000 градусов. - Шамот — для кладки печей использование шамотной глины — самое лучшее решение. На этапе создания наружной части дымохода можно также использовать раствор на основе цемента.
- По той причине, что процесс изготовления глины требует больших затрат времени, чаще всего владельцы частных домов при кладке печей используют уже готовые печные смеси заводского производства.
- Для того чтобы придать определенные свойства смеси, используют специальные добавки, вносимые в раствор. Для кладки печей с огнеупорным кирпичом может использоваться нормальная глина без необходимости внесения в её состав добавок и примесей. Однако чистую глину найти довольно проблематично.
- Песок — является одним из важных компонентов, добавляемым в составы для печных работ. Его вносят в пропорции 1:1. Однако это соотношение может изменяться.
 Все зависит от качества глины.
Все зависит от качества глины. - Когда необходимо, чтобы кладка быстро схватилась, используется известь.
- Цемент – в смесь этот компонент добавляют вместе с глиной и песком. Внесение его в готовый материал позволяет повысить прочностные характеристики состава. Если поверхности сильно греются, то добавлять цемент не следует. Иначе это может привести к тому, что с поверхности шва будет сыпаться цемент. В результате трещина возникнет на поверхности шва.
Есть также целый ряд требований к растворам, которые также должны учитываться на этапе работ по сооружению печной трубы.
Составы для печной трубы
Специалисты дают разные рекомендации насчет того, какие смеси лучше всего применять при кладке печной трубы.Для возвышающейся над крышей верхней части дымохода обычно используется смесь из глины, в которую добавлено некоторое количество цемента. Это нужно для обеспечения высоких прочностных характеристик кладки, а также для повышения устойчивости к ветровым нагрузкам и атмосферным осадкам.
Задача изготовления печной смеси своими руками достаточно сложная, поэтому лучше потратить деньги на приобретение готовых составов, чем заниматься самостоятельным приготовлением материала и смеси для кладки печи. На рынке предлагаются не только смеси отечественных производителей, но и продукты зарубежных компаний. Они обладают различными свойствами и имеют разное предназначение. Можно использовать для кладки печи как универсальные составы, так и цветные растворы. Последние применяются для чистовой кладки кирпича. Готовые смеси обладают более высокими качествами в сравнении с самодельными. Главным их недостатком является высокая стоимость.
Заключение
Многие владельцы частных домов все чаще задумываются о строительстве печи в своем жилище. Она создает особую атмосферу, а кроме этого позволяет экономить на отоплении в зимний период. Построить печку своими руками — сложная задача. Главное — подобрать качественный материал и использовать кладочную смесь из подходящих материалов хорошего качества.
К этим материалам предъявляются особые требования, о которых необходимо знать при выборе смеси заводского изготовления. Правильно подобрав материал для кладки и следуя технологии работ, можно получить сооружение, которое прослужит долгие годы и обеспечит тепло в помещениях вашего дома.
Оцените статью: Поделитесь с друзьями!Какой раствор нужен для кладки печи
Раствор для кладки печей, топок, печной. Состав, приготовление, пропорции. Приготовить, смешать, класть.
Как приготовить раствор для кладки печей и топок (10+)
Приготовление раствора для кладки печей
Дешевый и надежный раствор для кладки печей можно легко приготовить из подручных материалов.
Такой раствор подходит для печей и топок на дровах. Для топок под каменный уголь нужен другой раствор. Его лучше купить уже готовым.
Иногда приходится класть кирпичные конструкции, которые будут подвергаться нагреву. Прежде всего это – печи и стены, контактирующие с печами. Обычный цементный раствор при нагреве разлагается. Кроме того бетон имеет коэффициент теплового расширения отличный от керамики (кирпич). В результате конструкция не становится единим целым и растрескивается при нагреве.
Прежде всего это – печи и стены, контактирующие с печами. Обычный цементный раствор при нагреве разлагается. Кроме того бетон имеет коэффициент теплового расширения отличный от керамики (кирпич). В результате конструкция не становится единим целым и растрескивается при нагреве.
Преимущества моего раствора для печной кладки
Вашему вниманию подборка материалов:
Все, что нужно знать об отоплении и климат-контроле Особенности выбора и обслуживания котлов и горелок. Сравнение топлива (газ, дизель, масло, уголь, дрова, электричество). Печи своими руками. Теплоноситель, радиаторы, трубы, теплый пол, циркуляцинные насосы. Чистка дымоходов. Кондиционирование
Традиционный песчано-глиняный раствор, на котором обычно кладут печки, не обладает достаточной прочностью до обжига, что затрудняет кладку, очень долго сохнет и нередко при обжиге трескается, так как до конца не высох. Я пользуюсь немного другим раствором. Его преимущества:
Дешев, приготавливается из подручных материалов.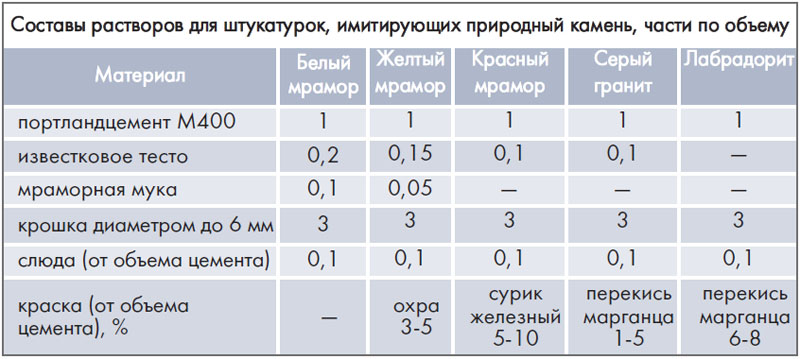
Достаточно прочен сразу после высыхания, до обжига.
Довольно быстро сохнет. За две недели высыхает до состояния, когда можно обжигать.
Довольно устойчив к влаге. При использовании традиционного раствора, некоторые части печки, которые не подвергаются достаточному нагреву, не обжигаются. В результате в этих местах раствор продолжает впитывать влагу и постепенно крошится и высыпается. Предлагаемый раствор этим недостатком не страдает, хотя конечно лить воду на него не следует.
Приготовление, состав раствора для кладки печей
Я готовлю раствор для печной кладки из суглинка прямо с участка, где стоит дом, если грунт суглинистый, или привожу с другого участка. Кучи такого суглинка образуются при строительстве колодцев, заливке фундаментов и прочих земляных работах. Даже если на Вашем участке почвы песчаные, Вам с радостью отдадут некоторое количество суглинка друзья. Еще потребуется песок и немного цемента.
Суглинки природного происхождения нужно очистить от примесей (камушков). Проще всего это сделать, намочив суглинок до сметанообразного состояния и протерев его через мелкую сетку.
Проще всего это сделать, намочив суглинок до сметанообразного состояния и протерев его через мелкую сетку.
Проблема суглинков в том, что они в разных местах разной жирности, то есть в них разное соотношение глины и песка, а нам нужно получить точно определенное соотношение. Для этого поступаем так. Замешиваем 10 вариантов раствора. Каждого варианта нам надо совсем немного, около спичечного коробка.
Описанный раствор быстро сохнет за счет того, что цемент поглощает воду. После вставания он довольно прочен и без обжига.
Применение самодельного раствора в печах и топках
Описанный раствор прекрасно работает при температуре до 600 градусов. При более высоких температурах он оплавляется и разрушается, впрочем, также, как и обычный кирпич. Так что на описанном растворе для кладки печей можно класть и топки, рассчитанные на дрова, торф, бурый уголь. Для топок на каменном угле он не подходит. Топки под каменный уголь нужно класть из специального шамотного кирпича на шамотном растворе. Но саму печь можно делать на этом растворе, так как все, кроме топки в печи не нагревается до экстремальных температур.
Раствор для кладки печи
Кирпичную печь нельзя построить без использования раствора. Опытные печники рассчитывают количество раствора для кладки печи исходя из соотношения: сто кирпичей – три ведра раствора. В сущности, по составу кирпичи и глиняный раствор, применяемый для кладки, практически одинаковы. Поэтому швы из глинянного раствора могут выдерживать нагрев до 1000 градусов цельсия.
В сущности, по составу кирпичи и глиняный раствор, применяемый для кладки, практически одинаковы. Поэтому швы из глинянного раствора могут выдерживать нагрев до 1000 градусов цельсия.
Требования к кладке раствора для печи
Глиняный раствор, при кладке печи, кладется швом толщиной не более 3-5 миллиметров.
Если шов будет больше, то на нагревании печи шов может потрескаться и раскрошиться, образуя трещины. Через эти трещины в печь будет попадать воздух, что вызовет падение тяги и увеличение количества используемого топлива, а после сгорания топлива, через трещины в помещение будет попадать угарный газ. Поэтому печники говорят, что чем ближе шов к оптимальной высоте 3 – 4 мм, тем лучше. При меньшей толщине шва между кирпичами не будет обеспечена должная связка.
Глиняный раствор для кладки печи позволяет печнику исправить ошибки, если они были допущены. При ремонтных работах у печи, сделанной на глиняном растворе, кирпич, раствор и облицовку можно сохранить, и переделать печь использую те же материалы.
Современные печники, часто используют в глиняном растворе для кладки различные добавки, которые, по их мнению, должны сделать раствор более стойким и клейким. Но если вспомнить наших предков, то они никаких добавок не применяли, а печи стояли сотни лет.
Типы глины для раствора
Прежде всего хотелось отметить, что глина может быть жирной, при этом глина блестит, легко сочится сквозь пальцы при сжатии кулака словно жир и тощая, когда глины на ощупь с явным содержанием песка, отламывается кусками – малопластична.
Раствор для кладки печи не должен быть жирным, и должен быть в меру пластичным. Жирный раствор после высыхания быстро растрескивается, создавая те проблемы, о которых было сказано выше.
Раствор для кладки печи должен быть, так сказать, нормальной жирности. Чтобы добиться ее , иногда приходиться смешивать глины из разных месторождений.
Проверка жирности печного раствора
Для проверки жирности глины для печи использует несколько способов. Наиболее достоверный состоит в том, что в полкилограмма глины добавляют немного воды и тщательно разминают, пока вся вода не раствориться в глине и глина не будет прилипать к рукам. Затем, из полученного раствора делается лепешка диаметром 10 сантиметров и дают ей высохнуть несколько дней.
Песок или глину добавляют незначительными порциями, каждый раз проверяя качество получаемого раствора для кладки.
Приготовление растворов для печи и каминов
Приготовление раствора также имеет несколько способов.
1
2 – Когда глина нормальной жирности и в нее не надо добавлять песок, ее насыпают на боек, это специальная площадка полтора на полтора метра для смешивания раствора. Затем глину смачивают водой и перелопачивают, смачивая водой делают грядку высотой 30-35 сантиметров и затем разбивают ударами лопаты, грядку по всей её длине.
Для жирной глины
– При добавлении песка, делается «бутерброд» из песка, смоченной водой глины, и еще одного слоя песка. Все это тщательно перемешивается. Вообще, залог приготовления качественного глиняного раствора состоит в тщательности смешивания ингредиентов. Бывает трудно добиться избавления от кусков песка в сухом виде. Поэтому перед смешиванием его несколько раз просеивают через сито, более мелкие частицы лучше смешиваются в растворе.
Выбираем смесь для монтажа печей и каминов
Монтаж печей и дымоходов процесс непростой. Строительство такого рода сложной и пажароопасной конструкции требует участия профессиональных квалифицированных печников-монтажников. Однако всегда найдутся смелые и настойчивые любители печного дела, народные умельцы, полагающиеся только на собственные силы и навыки. Мы расскажем вам как выбрать печную смесь или приготовить её самостоятельно.
В любом случае следует знать, что огромное значение имеет использование качественной смеси для кладки и облицовки печей. Применяемые кладочные растворы напрямую влияют на надежность и продолжительность службы печи или камина. Поэтому использовать печную смесь нужно обязательно качественную и подходящую именно нужному типу отопительного сооружения.
Разновидности кладочных печных смесей
Смеси для кладки печей подразделяются на следующие виды:
Жаростойкий раствор. Такая печная кладочная смесь отличается хорошей стойкостью к высоким температурам. Остыв, она сохраняет свои химические свойства и структуру. При этом не возникает необратимого деформирования. Описываемая смесь не теряет несущей способности даже при нагревании.
Жаропрочный раствор. Под воздействием высоких температур данная смесь не расширяется и не меняет своих свойств. В нагретом состоянии смесь сохраняет все характерные ей механические свойства. Раствор более устойчив к тепловым деформациям, по сравнению с жаростойкой смесью. Отлично держит как статические, так и динамические нагрузки.
Отлично держит как статические, так и динамические нагрузки.
Огнеупорный раствор. Бывает жаростойким или жаропрочным. Смесь огнеупорная печная может выдержать не только высокую температуру, но и влияние химически агрессивных веществ, находящихся в отработанных газах.
При возведении любых печей, даже тех, которые нагреваются не более, чем на 400°С, следует использовать только огнестойкие и жаростойкие кладочные растворы. Обойтись обычными строительными смесями в данном случае невозможно и крайне опасно, так как разрушение под воздействием высоких температур печи или дымохода, часто приводит к пожарам.
Смеси для устройства отдельных конструкций печи
Ко всем растворам, использующимся в кладке печей, предъявляются следующие требования:
- термоустойчивость, обеспечивающая безопасность печи и возможность ее полноценной эксплуатации;
- эластичность, необходимая для предотвращения возникновения трещин на стенках печи.
Кладочные растворы для печей подразделяются также по типу компонентов. Среди них можно отметить смеси на основе:
Среди них можно отметить смеси на основе:
- цемента;
- гипса;
- извести;
- смешанные (в случае наличия в составе нескольких связующих).
Фундамент конструкции. Основание печи сооружается с применением известковой или цементно-известковой смеси. Если ниже фундамента наблюдается переизбыток влаги, то следует воспользоваться цементной смесью. Она достаточно влагоустойчивая.
Дымоход. Часть конструкции, находящаяся над кровлей, нуждается в использовании известкового или известково-гипсового раствора. Для ускорения процесса застывания смеси, рекомендуется добавить в неё гипс. Тем, кто во главе угла ставит прочность сооружения, стоит включить в состав цемент.
Тело сооружения. Для устройства этой части печи необходимо использовать раствор, в состав которого входит песок, вода и глина. Причем глина должна быть достаточно жирная.
Известковая смесь
Основными компонентами данного раствора являются песок и известковое тесто, представляющее собой смесь негашеной извести и воды в пропорции 1:3.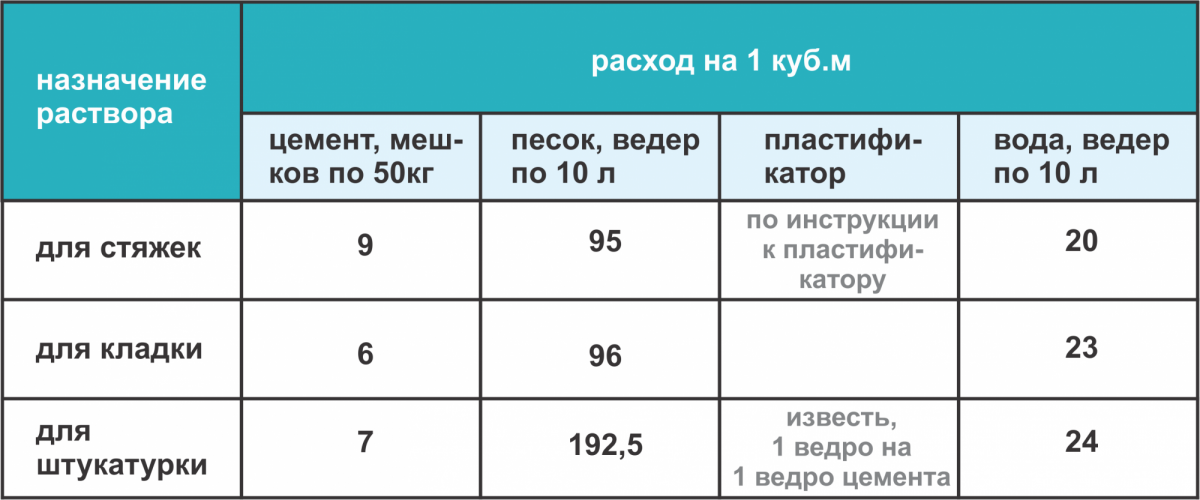 Известковое тесто можно купить или приготовить своими руками. В первом случае вам будет гарантировано высокое качество материала, преимуществом второго является оптимальная стоимость.
Известковое тесто можно купить или приготовить своими руками. В первом случае вам будет гарантировано высокое качество материала, преимуществом второго является оптимальная стоимость.
Чтобы приготовить раствор, требуется просеять через сито песок, смешать его с известковым тестом в соотношении 1:3 и добавить такое количество воды, чтобы смесь по густоте напоминала сметану.
Далее раствор проверяют на эластичность. Для этого нужно воспользоваться планкой из дерева. Помешивая ею смесь можно определить следующее состояние раствора:
- тощий раствор, если на древесине вообще не остается смеси. Это значит, что нужно прибавить немного извести;
- нормальная смесь, если извлеченная из нее деревянная планка покрыта пленкой из смеси или комочками из нее же;
- жирный раствор, если на планке налип толстый слой смеси. В этом случае, следует прибавить в смесь больше песка.
Смесь на основе извести имеет свои недостатки. Это продолжительное высыхание кладки и неблагоприятное воздействие испарений материала на человеческий организм.
Цементная смесь
Обычная цементная смесь включает в себя песок, цемент и воду. Марка цемента определяет выбор пропорции компонентов. Сначала нужно смешать цемент с песком. Только после этого добавляют воду.
Сложные смеси получают путем включения в состав дополнительных компонентов. Если в качестве такового выступает известковое тесто, то с использованием полученной смеси задерживаться не стоит. Смешанный раствор следует готовить в следующих пропорциях: одна часть цемента, 1-3 части прочих ингредиентов и 6-15 частей песка.
Если добавить в обычный цементный раствор портландцемент и битый кирпич, то получится смесь жаростойкого типа.
Глиняная смесь
Чтобы соорудить тело печи, нужно приготовить глиняную смесь Она должна быть однородной, без комков, сметанообразной консистенции. Если раствор приготовлен некачественно, то в процессе использования печи он будет крошиться. Также не удастся добиться красивых швов кладки.
Прежде чем приступить к приготовлению раствора, нужно проверить жирность глины. Для этого берут около 2 кг материала и вливают в него воду. Перемешав полученную смесь деревянной планкой, проводят визуальный осмотр последней:
Для этого берут около 2 кг материала и вливают в него воду. Перемешав полученную смесь деревянной планкой, проводят визуальный осмотр последней:
- сильно налипшая на лопатку глина свидетельствует о ее высокой жирности. Ее нужно затощать песком;
- остающиеся на планке небольшие куски глины говорят о том, что раствор нормальный и добавлять в него песок не нужно;
- покрывающая древесину глиняная пленка указывает на тощесть материала и предполагает включение в смесь более жирной глины.
Смесь из глины расходуется следующим образом: на 100 кирпичей требуется около 25 л смеси. Наилучшая смесь для печного кирпича та, состав которой имеет наибольшее сходство с составом применяемого кирпича. Качественный глиняный раствор способен выдержать 800-1000°С без образования трещин и не теряя прочностных свойств.
Чтобы добиться более прочного раствора, можно добавить в него такие ингредиенты, как хлористый натрий и портландцемент:
- хлористый натрий ( поваренная соль) добавляется в количестве 100-150 г на ведро смеси.
 Полученный раствор следует хорошо перемешать;
Полученный раствор следует хорошо перемешать; - в состав включают 0,5-1 кг портландцемента на такое же количество глиняной смеси.
Количество глины и песка в растворе может изменяться в пределах соотношений: 1:1 – 1:2. При этом вода занимает четвертую часть добавленной глины.
Ингредиенты, включаемые в смесь, можно подготовить самостоятельно или купить готовые материалы. Сейчас продают следующие виды глины:
- белая глина, подходящая для огнестойких растворов и используемая для печей на дровах с режимом топки не превышающим 1000°С;
- шамотная глина, применяемая для кладки печей с любым температурным режимом.
Готовые смеси для монтажа печей
Дешевле всего заготовить ингредиенты для кладочной смеси самостоятельно. Однако такой вариант является самым трудоемким. Чтобы этот процесс прошел быстрее, легче и надежней, целесообразней всего воспользоваться готовыми смесями.
В настоящее время на рынке России присутствует много как зарубежных так и отечественных производителей готовых печных смесей. Вы без труда сможете выбрать и купить печную смесь. Производители, как правило производят различные по составу и назначению смеси :
- Термостойкие, огнеупорные, кладочные смеси;
- Печные шпаклевки, клеи, мастики
Среди многочисленного списка таких материалов стоит отметить следующие:
Plitonit – ассортимент строительных смесей для возведения печей и каминов. Плитонит – совместное предприятие, производит смеси по немецкой технологии на территории России. В ассортименте представлены смеси с армирующими термостойкими волокнами для кладки топок, термостойкие растворы для кладки и ремонта печей, каминов, дымоходов, а так же растворы и клеи для оштукатуривания и облицовки.
БОССНАБ – бренд Санкт-Петербургской компании выпускающей печные смеси на основе красной глины. В ассортименте представлены огнеупорные и термостойкие растворы для кладки печей, а так же печные штукатурные смеси и клеи для облицовочных работ.
Терракот. Российский производитель строительных смесей в том числе для строительства и ремонта и облицовки печей, каминов и дымоходов. Смеси Терракот безопасный для окружающей среды и человека, жаростойкий, пластичный материал, основными вяжущими компонентами которого являются каолиновая глина, песок, а также шамот. Терракот стойко выносит нагревание, вплоть до 1300°С.
RATH – Австрийское предприятие, производит огнеупорные смеси на территории стран Европы: Германии, Австрии и Венгрии и Польши. Производит большое количество строительных огнеупорных и термостойких материалов, в том числе и печных смесей различного назначения: огнеупорные бетоны, пластические массы, клеи и растворы.
Vetonit – копания является частью международной организация Weber имеющей производство в 64 странах мира. Штаб квартира компании находится во Франции. Среди разнообразия продукции компании представлен кладочный раствор Ветонит, состоящий из глины, цемента, песка и дополнительных компонентов, нашедший применение в устройстве внутреннего пространства печей и печных труб из красного кирпича.
Печной дом «Макаровых» — одна из лучших кладочных смесей производящихся на территории России. Предприятие выросло из малого предприятия в г. Кастороме, основатель которого наладил производство печных кладочных смесей для собственных нужд и коллег печников. Учитывая качество смеси продукция стала пользоваться высоким спросом у профессиональных строителей печей и каминов, и в результате предприятие стало выпускать продукцию в промышленных масштабах. В настоящее время Печной дом «Макаровых» выпускает кладочные смеси из экологически чистых материалов, на основе красной и голубой кембрийской глины.
СЭВ – Российская компания выпускающая сухие смеси для кладки печей и каминов. Производство компании расположено в г. Боровичи Новгородской области.
В процессе применения готовых смесей следует соблюдать определенные правила:
- Замешивание осуществляется только при помощи миксера.
- Нельзя замешивать смесь снова после того как она застыла.

- Замешанный объем смеси необходимо расходовать в течение 60 минут.
- Температура окружающей среды при устройстве печи должна быть не меньше 10°С.
- Нельзя прогревать готовую печь раньше, чем через 3 дня после завершения ее укладки. Это связано с тем, что в состав смесей входят вещества, которые задерживают высыхание раствора и, соответственно, исключают возможность растрескивания швов.
- Укладка печной трубы осуществляется при помощи специальной смеси, о принадлежности к которой можно узнать по отметке на упаковке.
- Облицовку печи надлежит проводить не раньше, чем через месяц после того как ею начнут усиленно пользоваться.
Чтобы устранить высолы на швах кладки, которые могут образоваться после первого пользования печью по назначению, нужно воспользоваться влажной ветошью. Но только после того как печь полностью остынет.
Смеси, приготовленные самостоятельно, стоят дешевле готовых материалов. Однако последние имеют целый ряд преимуществ. Поэтому каждый из вас должен сделать выбор самостоятельно в пользу того или иного варианта, исходя из своих предпочтений и возможностей.
Однако последние имеют целый ряд преимуществ. Поэтому каждый из вас должен сделать выбор самостоятельно в пользу того или иного варианта, исходя из своих предпочтений и возможностей.
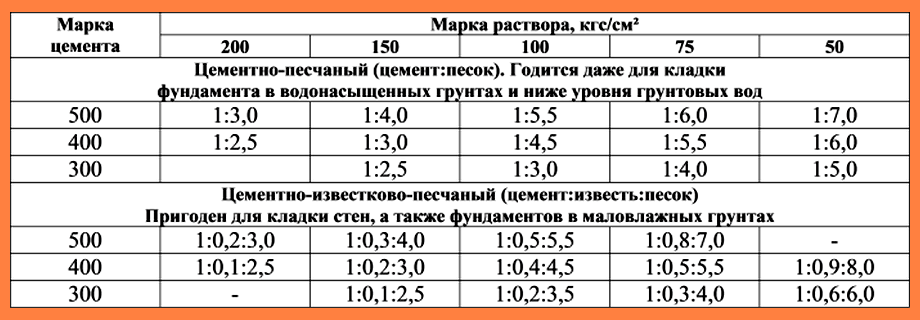
какой выбрать цемент для кладки, пропорции цементного раствора
Кладочный раствор – вид строительных растворов, состав и технологию приготовления которых регламентирует ГОСТ 28013-98, а также СП и СНиПы. Кладочные растворы могут изготавливаться на базе различных вяжущих. Для кладки кирпича в частном жилом строительстве чаще всего используются материалы на основе портландцемента марок М400 и М500.
Основные требования к кладочным растворам
Чтобы кладка была надежной и долговечной, кладочная смесь должна соответствовать нормативным требованиям по составу и характеристикам, среди которых:
- Пластичность. Только пластичный материал может заполнить все пустоты между кирпичами в горизонтальных и вертикальных швах.
 При ведении кладки в условиях высоких температур лучше использовать смесь с повышенной подвижностью.
При ведении кладки в условиях высоких температур лучше использовать смесь с повышенной подвижностью. - Высокий уровень адгезии с кирпичом. Хорошее сцепление раствора с элементами кладки обеспечивает прочность и длительный рабочий период всей строительной конструкции.
- Оптимальное время схватывания. И слишком быстрое, и слишком длительное схватывание осложняют строительные работы. Оптимальный период сохранения раствором пластичности – 1,5-2 часа.
- Высокая прочность после застывания, отсутствие трещин, способных вызвать деформацию кладки, вплоть до ее полного разрушения.
- Водонепроницаемость. Швы должны быть устойчивы к проникновению атмосферной влаги.
- Для цветных смесей – стабильность и долговечность цвета.
Какой цемент нужен для изготовления раствора для кладки кирпича?
Для приготовления кладочных смесей функции вяжущего чаще всего выполняют:
- Портландцемент марки М400 Д0 и М400 Д5.
 Это вяжущее содержит минеральные добавки в количестве до 5 %. По новому стандарту этот материал обозначается как ЦЕМ I 32,5. Прочность на сжатие – до 40 МПа. При решении вопроса о том, какая марка цемента нужна для кладки кирпича, для строительства небольших домов чаще всего приобретают портландцемент М400.
Это вяжущее содержит минеральные добавки в количестве до 5 %. По новому стандарту этот материал обозначается как ЦЕМ I 32,5. Прочность на сжатие – до 40 МПа. При решении вопроса о том, какая марка цемента нужна для кладки кирпича, для строительства небольших домов чаще всего приобретают портландцемент М400. - Портландцемент марки М500 Д0. По новому стандарту – ЦЕМ I 42,5. Прочность на сжатие – до 50 МПа. Смеси, изготовленные на основе этого цемента, имеют незначительную усадку при затвердевании, что снижает риск появления трещин. Портландцемент М500 используется в основном при строительстве зданий, испытывающих повышенные нагрузки.
Компоненты и пропорции кладочных растворов
Помимо вяжущего, в кладочных растворах присутствуют:
- Песок. Для этой цели может применяться только песок, соответствующий требованиям ГОСТа 8736-2014. Это может быть карьерный песок – мытый или сеяный, речной, очищенный от илистых включений.
 Применение песка, загрязненного глинистыми, илистыми включениями, имеющего в составе пыль, приводит к значительному снижению качества кладочного раствора. В соответствии с нормативом максимальная крупность зерен составляет 2,5 мм.
Применение песка, загрязненного глинистыми, илистыми включениями, имеющего в составе пыль, приводит к значительному снижению качества кладочного раствора. В соответствии с нормативом максимальная крупность зерен составляет 2,5 мм. - Вода. Для изготовления кладочных смесей можно применять воду из питьевого водопровода. Если такой возможности нет, то при использовании воды технической или из природных водоемов ее необходимо проверить в лаборатории на наличие примесей, которые смогут негативно повлиять на качество готового продукта. Вода должна иметь комнатную температуру.
- Красящие пигменты. Для получения определенного цвета смеси используют красящие компоненты. Составы темного оттенка изготавливают с помощью добавления графита, сажи.
- Пластификаторы. Улучшают удобоукладываемость, облегчают ведение строительных работ, повышают характеристики готового продукта. Для повышения пластичности смеси можно использовать покупные вещества или моющие средства – шампунь, стиральный порошок, жидкость для мытья посуды.

- Противоморозные компоненты. Используются в условиях пониженных температур для обеспечения нормальной гидратации цемента.
Таблица пропорций цемента и песка для приготовления раствора для кладки кирпича
| Марка раствора | Марка цемента | Соотношение компонентов, Ц:П |
| М50 | М400 | 1:7,4 |
| М75 | М400 | 1:5,4 |
| М500 | 1:6,7 | |
| М100 | М400 | 1:4,3 |
| М500 | 1:5,3 | |
| М150 | М400 | 1:3,25 |
| М500 | 1:3,9 |
Как определить, какая марка кладочного раствора необходима?
Области применения кладочных растворов разных марок прочности:
- М50.
 Востребован для ведения кирпичной кладки в малоэтажном строительстве, заделки трещин. Рекомендуется применение пластификаторов.
Востребован для ведения кирпичной кладки в малоэтажном строительстве, заделки трещин. Рекомендуется применение пластификаторов. - М75. Универсальный материал, используемый для кирпичной и блочной кладки внутренних перегородок и наружных стен.
- М100. Пригоден для строительства многоэтажных жилых зданий и объектов производственного назначения. Используется для возведения колонн, арок.
- М150. Материал отличается высокой прочностью, востребован для ведения каменной кладки.
Технология изготовления кладочного раствора на основе цемента
Этапы изготовления смеси вручную:
- Готовят инструменты и оборудование – крупногабаритную емкость для замешивания, лопату, мастерок, а также все компоненты смеси.
- В емкости смешивают сухие компоненты – цемент, песок, пигменты, если они находятся в сухом виде, и только потом добавляют постепенно воду. В среднем принимают, что количество воды на 1 кг цементного вяжущего должно составлять 0,8 л.

Для приготовления больших объемов раствора используют бетономешалку.
Порядок работ в этом случае несколько иной:
- В барабан заливают примерно 2/3 от требуемого количества воды, вводят добавки.
- Всыпают примерно половину песка, цемент, перемешивают.
- Засыпают оставшийся песок, перемешивают.
- Добавляют необходимое количество воды.
Как примерно рассчитать требуемое количество компонентов кладочной смеси?
Для планирования закупок строительных материалов необходимо хотя бы приблизительно рассчитать требуемое количество кладочного раствора. Для этого можно воспользоваться таблицей, в которой указывается количество кладочного раствора (м3), расходуемое на 1 м3 кладки.
| Вид кирпича | Толщина стены, в кирпичах (мм) | |||
| 0,5 (120) | 1 (250) | 1,5 (380) | 2 (510) | |
| Обычный | 0,189 | 0,221 | 0,234 | 0,24 |
| Полуторный | 0,16 | 0,2 | 0,216 | 0,222 |
Как рассчитать требуемое количество цемента и песка:
- Определите объем кладки.
 Для этого периметр строения умножают на толщину и высоту стен. Далее вычисляют суммарную площадь оконных и дверных проемов, умножают ее на толщину стен. Из общего объема кладки вычитают суммарный объем оконных и дверных проемов.
Для этого периметр строения умножают на толщину и высоту стен. Далее вычисляют суммарную площадь оконных и дверных проемов, умножают ее на толщину стен. Из общего объема кладки вычитают суммарный объем оконных и дверных проемов. - Полученный объем кладки умножают на количество смеси, необходимое для устройства 1 м3 кладки (данные берут из представленной выше таблицы). Например, нам необходимо рассчитать количество раствора, необходимое для кладки 12 м3 одинарного кирпича, толщина – в 1,5 кирпича. Расчет: 12*0,234 = 2,8 м3. Переводим объем смеси (2,8 м3) в кг. Для этого объем умножаем на среднюю плотность, которая примерно равна 1700 кг/м3: 2,8*1700 = 4760 кг.
- Далее необходимо рассчитать количество цемента и песка. Например, мы планируем изготовить цементно-песчаный раствор марки М75 с использованием цемента марки М400. Ц:П составляет в этом случае 1:5,4. Это означает, что в растворе всего содержится 6,4 части сухих компонентов.
 То есть, если мы разделим 4760 кг на 6,4, получим количество цемента – 743 кг. Простые расчеты показывают, что нам понадобится 15 мешков цемента по 50 кг каждый. Но, поскольку расчеты примерные, лучше приобрести материал с небольшим запасом. Далее вычисляем необходимое количество песка, которого в нашем случае содержится 5,4 части. Если одна часть составляет 743 кг, то всего нам понадобится 743*5,4 = 4012 кг песка.
То есть, если мы разделим 4760 кг на 6,4, получим количество цемента – 743 кг. Простые расчеты показывают, что нам понадобится 15 мешков цемента по 50 кг каждый. Но, поскольку расчеты примерные, лучше приобрести материал с небольшим запасом. Далее вычисляем необходимое количество песка, которого в нашем случае содержится 5,4 части. Если одна часть составляет 743 кг, то всего нам понадобится 743*5,4 = 4012 кг песка.
Ускорить ведение строительных работ и повысить качество результата помогает использование сухих смесей, составленных в заводских условиях, что обеспечивает точность пропорций компонентов.
В строймагазинах можно приобрести такие смеси для кладки всех видов кирпича – керамического, силикатного, рядового и облицовочного. В продаже также есть материалы белого и других цветов.
Какой песок нужен для кладки кирпича: пропорции, особенности
При возведении кирпичных стен необходим кладочный раствор, обязательным компонентом которого является песок. Непосвященным кажется, что песок играет последнюю роль в вопросе прочности и качества постройки. Пропорции песка и цемента в растворе для кладки облицовочного кирпича влияют на пластичность раствора и степень последующей усадки. В кладочном растворе должны присутствовать все необходимые компоненты: песок, цемент и вода.
Непосвященным кажется, что песок играет последнюю роль в вопросе прочности и качества постройки. Пропорции песка и цемента в растворе для кладки облицовочного кирпича влияют на пластичность раствора и степень последующей усадки. В кладочном растворе должны присутствовать все необходимые компоненты: песок, цемент и вода.
Какую роль играет песок?
В растворе для кладки песок занимает немалую часть – больше половины общего объема. Функции материала заключаются в регулировании объема смеси, снижении степени усадки, заполнении пустотных образований. Альтернативы песку пока не найдено – это лучший компонент, который отлично справляется с поставленными задачами. Песок обладает рядом уникальных свойств:
- химическая инертность вещества,
- достаточная однородность состава,
- прочность и устойчивость к нагрузкам,
- низкая себестоимость.
Соперничать с песком для кладки кирпича могла бы глина, однако ее добывают более затратным карьерным способом.
Виды строительного материала
Существует несколько видов песка:
- Песок, добываемый в оврагах и содержащий примеси, который применяется для сооружения фундамента;
- Речной песок, который считается самым лучшим материалом для цементного раствора;
- Песок, добываемый в карьерах открытым способом, который также может содержать посторонние включения.
Важным критерием считается размер песчинок, строительный песок разделяется на мелкий, средний и крупный.
Какой песок для строительства лучше?
Песок для кладки должен быть чистым и однородным, негативно сказывается содержание примесей в нем. Инородная примесь плохо отражается на качестве кладочного раствора, снижая однородность и пластичность состава. Идеальным для кладки кирпичей считается песок средней фракции, а для декоративной отделки используют мелкий песок.
Какой песок лучше, однозначно сказать сложно. Предпочтительнее используют речной вид с частицами средней фракции. Однако песчинки могут быть сильно отшлифованы, что повлечет автоматическое снижение сцепных характеристик материала. В этом случае рекомендуют карьерный вид, отличающийся высокой степенью сцепления частиц. Такой песок требует дополнительного промывания и очистки для исключения посторонних примесей.
Однако песчинки могут быть сильно отшлифованы, что повлечет автоматическое снижение сцепных характеристик материала. В этом случае рекомендуют карьерный вид, отличающийся высокой степенью сцепления частиц. Такой песок требует дополнительного промывания и очистки для исключения посторонних примесей.
Как получить очищенный песок?
Для того чтобы сделать карьерный песок очищенным, его подвергают дополнительной очистке от примесей. Такой песок называется намывным, он не требует дополнительного просеивания. Преимуществом этого материала считается универсальность использования: его допускается применять при любых видах строительных работ. Высокое качество намывного песка компенсирует более дорогую стоимость материала, такой песок вполне может заменить речной и иногда превосходит его по функциональным параметрам.
Использование раствора для кирпичной кладки
Песок считается важным компонентом цементного раствора, он придает смеси пластичность, а кладке из кирпичей прочность и максимальную степень надежности. Главное – правильно подобрать и смешать материалы. Песок в составе раствора должен быть однородным по структуре, обладать оптимальным размером частиц их гладкостью и чистотой.
Главное – правильно подобрать и смешать материалы. Песок в составе раствора должен быть однородным по структуре, обладать оптимальным размером частиц их гладкостью и чистотой.
Другие компоненты
В составе раствора присутствуют и другие компоненты – это цемент и вода. Цемент обеспечивает кладке прочность и предотвращает риск разрушений. Важно правильно подобрать марку цемента, который хорошо затвердевает в сыром состоянии. Рекомендуют также добавить в раствор гашеную известь. Она помогает составу смеси приобрести дополнительную текучесть для того, чтобы заполнить все промежутки и пространства между кирпичами, исключая образование пустот. Другие дополнительные компоненты в раствор вводят для увеличения влагостойкости и исключения образования высолов, белых полос на поверхности кирпичной стены.
Свойства кладочного раствора
Если раствор замешан правильно, он сохраняет свои свойства на протяжении двух часов. Компоненты добавляют порциями и постепенно перемешивают.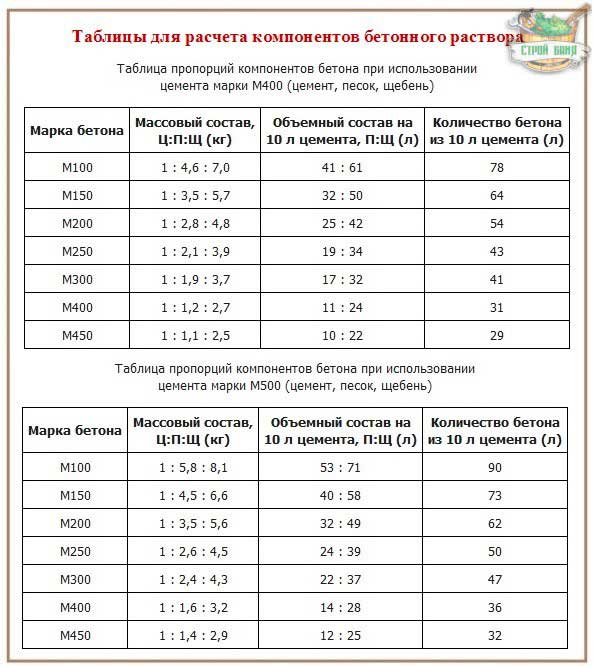 Важно учитывать скорость работы мастеров по укладке, чтобы правильно рассчитать объемы замешиваемого раствора. Слишком большой объем может испортиться и свойства смеси будут утрачены. О готовности смеси говорит ее однородность и сохранение углубления после внешнего воздействия. В процессе работы рекомендуется подливать в раствор небольшое количество воды.
Важно учитывать скорость работы мастеров по укладке, чтобы правильно рассчитать объемы замешиваемого раствора. Слишком большой объем может испортиться и свойства смеси будут утрачены. О готовности смеси говорит ее однородность и сохранение углубления после внешнего воздействия. В процессе работы рекомендуется подливать в раствор небольшое количество воды.
Только правильное соблюдение пропорций всех компонентов раствора гарантирует прочность и ровность кирпичной кладки, надежность строительной конструкции, устойчивость к нагрузкам, исключение риска разрушения и воздействия на кирпич. Ориентируйтесь на советы специалистов и не экономьте на стоимости песка для кладки кирпича.
Какой раствор нужен для отмостки дома
Цементный раствор — основной связующий материал в строительстве. Его используют для создания отмостки, которая защищает фундамент от разрушения, а также для бетонных работ, возведения стен.
Благодаря прочности и надежности раствора удается добиться качественных результатов. В зависимости от своего вида цемент может иметь различные характеристики, например, водонепроницаемость или пластичность.
Правильно приготовленная смесь гарантирует долговечность эксплуатации сооружения, монолитность постройки и оптимальное сцепление поверхностей.
От их качества зависит, как себя будет вести бетон в условиях различных температур, какова будет его плотность. Для придания бетону дополнительных свойств в цементную смесь для добавляют опилки, осколки камней, шлаковые отходы и др.
Приготовленную смесь можно использовать для отмостки вокруг дома, для возведения ленточного и монолитно ленточного фундаментов.
Цемент – основа раствора для отмостки. Он должен обладать высокими вяжущими свойствами, быть устойчивым к химическим и механическим воздействиям, обеспечивать бетону прочность.
В зависимости от маркировки цемент отличается различной скоростью застывания, схватывания и областью применения.
Цемент может быть чистым или с добавками. На мешках об этом свидетельствуют индексы:
О дополнительных характеристиках можно судить по наличию следующих аббревиатур:
Маркировка – М – позволяет определить степень нагрузки на квадратный сантиметр, который может выдержать цемент. Так, М500 значит, что данный материал выдерживает нагрузку в 500 кг на 1 см2.
Качественная отмостка и её долговечность определяется прочностью цемента. Чем прочнее цемент, тем выше эксплуатационные сроки отмостки и ниже вероятность её ремонта (как отремонтировать отмостку читайте здесь).
Для создания цементного раствора лучше отдать предпочтение портландцементу.
Чтобы добиться оптимальной плотности бетона рекомендуется использовать цемент марки не ниже М200. Для улучшения характеристик раствора можно добавить в него армированный или неармированный гравий от 0,5 до 2 см в диаметре.
На неустойчивых участках вокруг дома или здания применяют цемент М400. Они достаточно морозо- и водостойкие. При создании отмостки для промышленных объектов в раствор подмешивают цемент прочностью М500 или ПЦ500. Материал отлично подходит для участков с высокой влажностью и резкими температурными перепадами.
При создании отмостки для промышленных объектов в раствор подмешивают цемент прочностью М500 или ПЦ500. Материал отлично подходит для участков с высокой влажностью и резкими температурными перепадами.
Требования к выбору песка предъявляются самые высокие. В составе материала обязательно должны отсутствовать примеси глины. Оптимальный вариант песка:
Продажей песка занимается ряд компаний. Его добывают в карьерах, путем просеивания крупных частиц и очищения песчаного грунта. Перед сделкой покупателю обязательно должны предоставить сертификат качества, который является подтверждением соблюдения всех норм обработки.
Каждая марка цемента предполагает соблюдение индивидуальных пропорций при добавлении песка. Если соотношение будет нарушено, то это обязательно скажется на качестве цементной смеси.
Для монтажа отмостки лучше всего выбирать цемент от М300 до М500. Эти марки являются универсальными и идеально сочетают в себе все необходимые функции.
Получить бетон М100 можно несколькими способами:
Для бетона М200 понадобится уменьшить количество песка:
Низкие марки бетона пригодны для создания стяжек полов или проведения штукатурных работ. Для отмостки, так же как для заливки ленточного фундамента дома, понадобится бетон прочностью не менее М200.
Для отмостки, так же как для заливки ленточного фундамента дома, понадобится бетон прочностью не менее М200.
Вода в соотношении играет немаловажную роль. Её количество, как правило, составляет половину от веса цемента. Например, на 500 кг цемента понадобится 1500 кг песка и 250 л воды. Если смещать количество воды в меньшую сторону, раствор будет становиться гуще, а его прочность – выше.
А в этой статье читайте как правильно залить ленточный фундамент.
Расход цемента на создание отмостки зависит от марки самого материала и марки бетона, который вы хотите получить в результате. Также на подготовку влияют такие факторы как чистота компонентов, их крупность, качество воды и прочие нюансы.
В среднем на кубометр раствора для бетона М200, необходимо 490 кг цемента М400 или 410 кг цемента М500. Такие пропорции подходят для работ по созданию отмостки, заливки фундамента, формирования садовых дорожек.
Наибольшей популярностью пользуется цемент М500. Он подходит практически для любых видов деятельности и позволяет создать бетон любой прочности.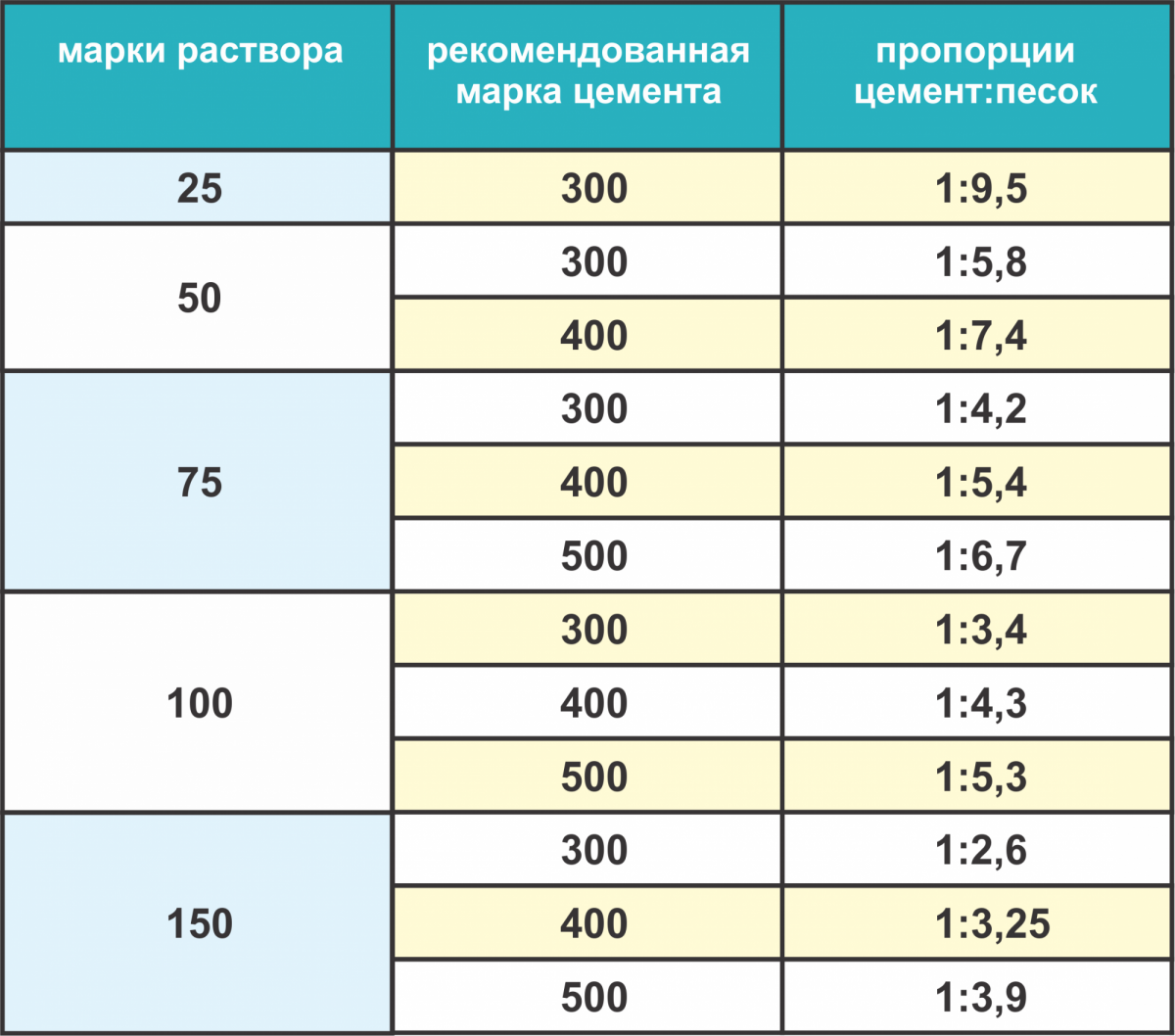 Его соотношение на 1 м3 при стандартных условиях составляет:
Его соотношение на 1 м3 при стандартных условиях составляет:
Во время приготовления цементного раствора не забывайте о температуре воздуха, которая должна быть не ниже -5 градусов, и качестве компонентов. Скорости вымешивания в 10-12 оборотов в минуту достаточно, чтобы приготовить раствор за 5-10 минут.
Использовать состав необходимо в течение часа после приготовления. Только при соблюдении всех рекомендаций, можно получить высококачественный и прочный материал.
Как правильно замешивать цементный раствор и какие пропорции при этом соблюдать рассказывает следующее видео:
Отмостка является обязательным элементом при возведении жилого дома. Она защищает фундамент от воздействия атмосферных осадков, предотвращает расползание почвы под основанием дома и завершает архитектуру постройки. Правильно подобранные пропорции бетона для отмостки позволят увеличить эксплуатационный срок здания.
При соблюдении технологий подбор состава бетонной смеси для сооружения отмостки не будет являться сложным процессом. Одной из главных задач при замешивании раствора является определение количества и дозировки компонентов для строительства.
Одной из главных задач при замешивании раствора является определение количества и дозировки компонентов для строительства.
Отмостка выполняет две функции: защитную и декоративную. Она отвечает за сохранность цоколя фундамента дома и его подземной части от разрушительного воздействия талой и дождевой воды. Устройство отмостки из бетона позволяет продлить эксплуатационный период основания: если почва вокруг фундамента будет оставаться в сухости, то ему не грозит разрушение от влаги.
Сухое основание предотвратит образование плесени и мха на поверхности стен. Кроме того, на цоколь при сооруженной отмостке снижается нагрузка в весенний период, когда происходит пучение грунтов.
Декоративная функция заключается в завершенности архитектуры дома. Кроме того, этот элемент может быть использован в качестве пешеходной дорожки.
Согласно СНиП требования по сооружению отмостки стандартны:
Следует помнить, что отмостку сооружают с уклоном от стен фундамента. Грунт под бетонной лентой следует уплотнять. Кроме того, необходимо устроить дренажный слой в виде щебневой подсыпки.
Кроме того, необходимо устроить дренажный слой в виде щебневой подсыпки.
Кроме стандартов, регламентированных СНиП, необходимо также помнить, что ширину отмостки следует принимать на 200 мм от вылета козырька. Если крыша дома плоская, то это значение должно составлять минимум 0,5 м от стены.
Сооружать отмостку рекомендуется по всему периметру вокруг дома без каких-либо прерываний. Однако не стоит забывать и про температурные швы — их рекомендуется нарезать через каждые 2-2,5 м. Обязательными являются швы на отмостке в точках углов здания.
В первую очередь качество бетонной конструкции будет зависеть от используемых компонентов, во вторую — от технологии заливки раствора. При этом рекомендуется тщательно соблюдать приготовление смеси с учетом всех требований, поскольку производство некачественной бетонной массы приведет к быстрому появлению трещин, сколов и, как следствие, скорому разрушению конструкции.
Если рассматривать бетонную смесь с точки зрения качественных характеристик компонентов, то тут следует придерживаться таких рекомендаций по их выбору:
Для сооружения отмостки рекомендуется готовить раствор не ниже марки М200, что соответствует маркам цемента М300, М400.
Поскольку цемент является связующим компонентом в составе бетонной массы, то от его качества будет зависеть прочность будущего сооружения.
Самым востребованным является цемент марки М400 — он подходит для изготовления бетонного раствора класса В-15. Материал отвечает следующим техническим требованиям:
Бетонная конструкция, изготовленная с применением этого цемента, набирает марочную прочность за месяц, отличается повышенной водонепроницаемостью, не вступает в реакцию с химическими реагентами и устойчива к сильным температурным перепадам.
Кроме этого, следует обращать внимание на дату производства цемента. Качественный материал сохраняет свои свойства в течение 3 месяцев со дня изготовления, после чего теряется около 30% прочностных характеристик. Маркировка должна включать указание точного времени (посекундно), в противном случае можно приобрести подделку.
Из цемента марки М400 можно получить на выходе бетон разной марочной прочности, если корректировать пропорции добавляемых компонентов. Какая марка бетона получится в зависимости от составляющих, можно увидеть ниже.
Какая марка бетона получится в зависимости от составляющих, можно увидеть ниже.
Некоторые участки могут оказаться неустойчивыми вследствие пучинистых грунтов или высокого пролегания грунтовых вод. В этом случае цемент рекомендуется использовать марки не ниже М400, реже — портландцемент марки ПЦ500. Материал хорошо подходит для местности с резкими перепадами температур и повышенной влажностью.
Каким должен быть наполнитель
В качестве наполнителей выступают речной песок и щебень средней фракции. В некоторых случаях вместо щебня используется мелкий гравий. Для снижения веса и увеличения объема раствора часто добавляется керамзит: он отличается малым весом и является хорошим заполнителем массы.
Необходимо помнить, что щебень средней фракции потребует большего количества воды, чем крупнофракционный.
Известняк для приготовления бетона брать не рекомендуется, поскольку он снижает марочную прочность конструкции.
Как подготовить песок
Прочность бетонной конструкции будет зависеть не только от вяжущего материала, но и наполнителей, одним из которых является речной песок. Для приготовления смеси рекомендуется использовать песок крупной фракции. Допускается применение карьерного песка, предварительно просеянного через мелкоячеистую решетку.
Для приготовления смеси рекомендуется использовать песок крупной фракции. Допускается применение карьерного песка, предварительно просеянного через мелкоячеистую решетку.
Если самостоятельно добытый песок имеет глинистые частицы, то удалить их можно с помощью простой промывки. Для этого в емкость с песком заливается большое количество воды, песок отстаивается, затем промывается. Большая часть глинистых примесей осядет на дно, а после промывки песок станет чистым настолько, что его можно будет использовать для приготовления смеси.
Чем выше требуется марочная прочность бетона, тем меньшее количество песка понадобится для создания раствора.
Как добавлять воду
Воду в бетонную смесь следует добавлять после того, как тщательно перемешаны все составляющие сухой массы. Количество жидкости для затворения раствора в большинстве случаев определяется как 1/2 часть от объема цемента, однако это не всегда так. Затворитель должен образовывать смесь такой консистенции, чтобы она была достаточно пластичной и удобной для заливки отмостки.
Жидкость для разведения раствора должна быть чистой. Можно использовать холодную колодезную воду или из скважины, главное условие — чтобы она не содержала мусора и грязных примесей, например, глинистых частиц. Наличие примесей может снизить вяжущие свойства смеси.
Затворитель добавляется в таком объеме, чтобы полученная масса не стекала с лопаты и не слишком налипала на нее. Консистенция бетонной массы должна быть схожа по вязкости с густой сметаной.
Пропорции бетона для отмостки: расчет
Стандартный рецепт приготовления бетонного раствора содержит следующие компоненты и пропорции:
- песок речной — 3 части;
- цемент марки М400 — 1 часть;
- щебень или гравий — 4 части;
- вода — 1/2 части цемента.
Под частью подразумевается мера материалов в 1 ведро. Если планируется устройство широкой бетонной ленты (шире, чем 1 м), то в этом случае раствор рекомендуется замешивать в пропорциях 1:3:3 (цемент-песок-щебень или гравий).
Если рассматривать весовые значения компонентов смеси, то для приготовления 1 м³ бетонной массы марки М200 понадобится:
- песок — 750-840 кг;
- цемент — 280-300 кг;
- щебень средней фракции — 1100-1400 кг;
- вода — 140-150 л.

Числовые значения указаны для табличных удельных плотностей материалов. Фракция щебня может иметь размер от 5 до 20 мм.
На основе эмпирических данных выведено примерное соотношение водоцементного состава, которое составляет 0,65:1 (вода-цемент). Но и в этом случае объем затворителя (воды) может варьироваться в зависимости от степени увлажненности песка.
Существуют пропорции и для сухой смеси. Чтобы узнать, сколько сухой массы понадобится для сооружения отмостки, необходимо произвести следующие расчеты:
- Определиться с размерами отмостки.
- Вычислить площадь постройки.
- Определить объем сооружения.
Полученное значение следует увеличить на 10-15%, чтобы брать смесь с запасом. Получившаяся цифра и станет указателем, сколько сухой смеси может потребоваться для сооружения отмостки вокруг дома.
Например, ширина отмостки равна 1,2 м, длина (в данном случае лента будет охватывать весь дом) составляет 30 м, высоту конструкции принимают равной 20 см. Воспользовавшись методикой расчета, получают следующее:
Воспользовавшись методикой расчета, получают следующее:
- Sотм = A*B = 1,2*30 = 36 м2.
- Vотм = Sотм*Hотм = 36*0.2 = 7,2 м3.
- Vсм = Vотм+15% = 7,2 +15% = 8,28м3.
Из расчетов выходит, что для отмостки длиной в 30 м и шириной в 1,2 м на высоту слоя в 20 см понадобится 8,28 м³ сухой смеси (с запасом).
Рекомендации по замешиванию
Самостоятельно замесить раствор для заливки отмостки несложно. Нужно помнить, что исходный объем сухих компонентов не будет равен итоговому объему, т. е. на 1 м3 общей смеси ингредиентов придется около 0,7 м³ бетонной массы.
Для удобства расчетов за эталон весовой мерки принимается цемент, и все замеры нужно производить ведрами.
Для того чтобы отмостка получилась качественной, бетонную массу необходимо не только готовить с соблюдением правильных пропорций, но и правильно замешивать, соблюдая очередность подачи компонентов:
- В емкость насыпается песок.
- Сверху засыпается цемент.
- После перемешивания сухих компонентов (в течение 2-3 минут) к ним добавляется немного воды, и смесь снова тщательно перемешивается 3-6 минут до получения однородной густой сметанообразной консистенции.

- Затем в емкость засыпается щебень, и масса снова тщательно перемешивается.
При необходимости в смесь можно добавить присадку-пластификатор для увеличения противоморозных свойств будущей бетонной конструкции. По возможности рекомендуется использовать бетономешалку. При этом следует помнить, что каждый последующий компонент в массу добавляется только после того, как будут тщательно перемешаны все предыдущие составляющие смеси.
Если бетономешалки нет и приходится замешивать раствор вручную, то рекомендуется замес производить в большом корыте, мешая массу штыковой лопатой. Лопата пригодится в случае, когда потребуется отмерять части компонентов для приготовления смеси, а так же для заливки готового раствора в опалубочную конструкцию.
При ручном замешивании бетонной массы следует тщательно смешивать цемент с водой. При этом нужно помнить, что избыток жидкости-затворителя недопустим, иначе готовая конструкция будет иметь низкий уровень прочности. Необходимо, чтобы влага полностью впиталась в цементный порошок; недостаточное время для замешивания приведет к тому, что влага останется в чистом виде и во время сильных морозов разрушит всю постройку.
Необходимо, чтобы влага полностью впиталась в цементный порошок; недостаточное время для замешивания приведет к тому, что влага останется в чистом виде и во время сильных морозов разрушит всю постройку.
Для регионов с холодным климатом рекомендуется при возведении отмостки в бетонную смесь добавлять присадки, повышающие водонепроницаемость конструкции. Также рекомендуется применять морозостойкие компоненты. А еще желательно добавить уплотнитель — чем плотнее и пластичнее окажется раствор, тем большей прочностью будет обладать будущая постройка, а это значит, что отмостка прослужит долгое время.
При приготовлении раствора следует помнить, что температура воздуха не должна быть ниже +5 0С, в противном случае замешивание будет затруднено. Весь состав желательно израсходовать в течение 1 часа, чтобы он не успел схватиться и застыть.
Старым, но испытанным методом упрочения конструкции является железнение покрытия. Просушку следует проводить, настилая на отмостку периодически увлажняемую ткань.
После возведения отмостки ее рекомендуется дополнительно покрыть пропиткой с проникающим гидроизоляционным действием. При желании можно воспользоваться облицовочным материалом: брусчаткой, плиткой, камнем. Декоративная отделка придаст эстетичный вид всей архитектуре и увеличит срок службы бетонной конструкции.
Заключение
От прочности фундамента дома будет зависеть прочность всей постройки. Поэтому основание следует хорошо защитить от разрушительного воздействия атмосферных осадков и подтопления грунтовых вод. Устройство отмостки вокруг дома способствует предотвращению образования плесени и гнили на стенах фундамента, а также снизит вероятность появления сырости в доме. Чтобы отмостка прослужила долго, ее следует возводить, используя только качественные материалы, соблюдая технологию приготовления бетонной смеси.
Правильный состав бетона для отмостки: пропорции в ведрах, приготовление своими руками
От качества фундамента зависит степень прочности и время службы всего сооружения; это самое уязвимое место, которое может пострадать от осадков и грунтовых вод. Если не будет качественной отмостки, в жилом помещении образуется плесень и сырость. Многие люди задаются вопросом, как приготовить цементный раствор для отмостки дома.
Если не будет качественной отмостки, в жилом помещении образуется плесень и сырость. Многие люди задаются вопросом, как приготовить цементный раствор для отмостки дома.
Особенности конструкции
Отмостка — это покрытие, плотно опоясывающее постройку по всему ее периметру. Имеет заданную непрерывную ширину. Сооружается данная конструкция на последнем строительном этапе, когда уже полностью закончены облицовочные работы на фундаменте.
Функции отмостки:
- Защитная функция — при выпадении большого количества осадков они попадают в специальную канализацию для слива, предотвращая контакт фундамента с водой. Если отмостки не будет, вода способна со временем разрушить основание всего дома.
- Препятствие вспучиванию грунтового слоя — фундаментное сооружение не нарушится, если промерзание грунта будет минимальным.
- Теплоизоляционная способность помогает удерживать тепло дома, не давая промерзнуть грунту в холодное время года.
- Декоративная роль улучшает внешний вид дома, делая его законченным и завершенным.

Требования к отмостке
Она должна выступать на 200 мм от дома, оптимальная ширина — 1 м, это позволяет ходить по отмостке вокруг дома, используя ее в качестве пешеходной дорожки.
Покрывать весь периметр сооружения необходимо беспрерывно, благодаря этому весь фундамент будет защищен. Толщина выбирается в зависимости от эксплуатационной нагрузки, в среднем это 7 см. При повышенной нагрузке слой бетона может достигать 16 см.
Сооружать отмостку рекомендуется под небольшим наклоном, угол которого составляет не меньше 1-2º, это обеспечит отток воды от дома во время выпадения большого количества осадков.
Компенсационные швы — это важная составляющая отмостки. Изготавливаются из виниловой ленты или отрезков ЭППС, толщина которых — 5-12 мм. Располагаются на стыке конструкции отмостки и фундамента.
Компоненты и пропорции
Хороший бетонный раствор для отмостки получится только в случае строгого соблюдения всех пропорций.
Классический способ, помогающий правильно определить пропорции бетона на отмостку:
- В смеситель помещается песок и цемент в пропорции 1:3.

- Добавляется вода, при размешивании должна получиться масса однородной консистенции, имеющая вид густой сметаны.
- Перемешивая, добавляют не менее 3 частей мелкого щебня или гравия.
Например, чтобы получить раствор из бетона, имеющий объем 1 м³, потребуется:
- 300 кг цемента;
- 1120 кг щебня, имеющего фракцию 5-10 мм;
- просеянный и промытый от лишних примесей и земли песок в количестве 800 кг;
- вода в количестве 180 л.
Замешивая бетонный раствор, все следующие компоненты нужно вносить только после равномерного растворения предыдущих.
В случае приготовления бетона ручным способом все компоненты смешиваются в большой емкости типа ванны или корыта. Сначала раствор мешается при помощи тяпки, а после добавления щебенки или гравия лучше мешать штыковой лопатой.
Бетон для отмостки частного дома своими руками
Некачественная отмостка проявляет себя после зимы: она просто распадается и раскалывается на небольшие части, а в некоторых случаях и полностью. Причина чаще всего в некачественном цементе, который применялся для изготовления бетона, и неправильная технология приготовления смеси из бетона.
Причина чаще всего в некачественном цементе, который применялся для изготовления бетона, и неправильная технология приготовления смеси из бетона.
Следует рассмотреть, как сделать бетон самостоятельно:
- Для этого берется материал марки М200, можно и выше, т.к. чем выше марка, тем более качественной получится вся конструкция.
- Песок берется очищенный, без примеси глины, известняка, ила. Лучше для этого подойдет песок в ведрах, принесенных из карьера или реки.
- Щебень или гравий должен быть мелкой фракции (от 5 до 20 мм).
- Чем больше воды, тем ниже прочность бетонной конструкции.
- Подбирая состав бетона для отмостки, пропорции надо соблюдать следующие: 1 часть цемента, 4 части щебня, 2 части песка, вода 0.5 части.
Качество компонентов
От качественной характеристики цемента во многом будет зависеть срок эксплуатации. В цементе не должно быть лишней влаги и различных частиц, особенно твердых. Стройматериал нужно приобретать только у проверенных поставщиков. э
э
При покупке необходимо обязательно смотреть на срок годности цемента, т.к. наиболее качественный он в первые 3 месяца после выпуска. После этого срока показатели прочности начинают снижаться.
Маркировка бетона
Марка бетона — это показатель его прочности в результате сжатия. Регламент по технической характеристике — ГОСТ 912897, 747394.
Выбирая ту или иную марку, необходимо учитывать нагрузку, характеристику грунта, условия климата. Отмостка должна соответствовать следующим требованиям:
- марка М200;
- прочность В 15;
- морозостойкость F150.
При стройке в местности с частым выпадением большого количества осадков и резкими перепадами температур лучше применять М250. Такая марка наиболее устойчива к сильной жаре и холоду, подвержена меньшей вероятности растрескивания.
Чем больше строительный объект, тем больше должна быть марка, т.к. слишком низкие могут разрушаться в результате вибрации.
Пропорции для бетона м 200
М200 — самый популярный раствор, изготавливаемый из М400 цемента. Перед тем как делать бетон этой марки, необходимо определить максимально точное соотношение всех компонентов. Для 1 м³ продукции потребуются:
Перед тем как делать бетон этой марки, необходимо определить максимально точное соотношение всех компонентов. Для 1 м³ продукции потребуются:
- цемент — 330 кг;
- гравий — 1260 кг;
- песок — 650 кг;
- вода — 170-180 л.
Приготовление
Сначала заливается в бетономешалку или емкость, при ручном способе приготовления чистая водопроводная вода, затем в небольшом количестве добавляется цемент, все перемешивается. Следующий этап — внесение щебня и песка.
Укладка
Вначале формируется подстилочный слой из глины и песка. Затем из щебня делается дренирующий слой. Для гидроизоляции подойдет рубероид или полиэтиленовая пленка.
Для формирования самой отмостки нужен строительный уровень, при его помощи проводится контроль ровности, рейка, размером в 2 м, инструменты для штукатурки и копания.
Рассчитывается площадь для будущей конструкции, ориентировка при этом должна быть на параметры ширины ленты. Следующим этапом является снятие слоя земли на глубину 200-220 мм. Затем выставляется опалубка и уплотняется грунт, который лежит в траншее. На все дно укладывается глина, толщиной не менее 50 мм, которая хорошо трамбуется. На слой глины кладется слой песка в 100 мм, трамбуется, затем идет 50 мм прослойки из щебня.
Затем выставляется опалубка и уплотняется грунт, который лежит в траншее. На все дно укладывается глина, толщиной не менее 50 мм, которая хорошо трамбуется. На слой глины кладется слой песка в 100 мм, трамбуется, затем идет 50 мм прослойки из щебня.
Следующий этап — армирующая сетка с установкой специального деформационного шва в месте соединения цоколя и ленты из бетона, все это уплотняется и выравнивается. Расстояние между деформационными швами должно составлять 2-3 м, при этом на углах постройки делать их нужно обязательно. Для этого можно применить рейки, расположив их на уровне, идентичном поверхности, учитывая ее наклонную силу.
Отмостка из бетона, которая изготовлена из качественных материалов с соблюдением необходимых пропорций и технологии, будет служить не менее 20 лет. Для еще большего срока эксплуатации можно покрыть конструкцию тротуарной плиткой. Она высокого качества, отлично переносит перепады температур и холодное время года, выдерживает большую проходимость.
Марка бетона для отмостки: пропорции раствора
Бетонный раствор — смесь из цемента, песка, воды. Смесь активно применяется в строительстве, помогая создавать прочные конструкции. Закладывают прочный фундамент под дом, который необходимо дополнительно защитить от лишней влаги, чтобы увеличить период эксплуатации постройки.
Виды отмостки
Отмостка — защитная полоса по периметру дома, плотно прилегающая к фундаменту. Дополнительная прослойка между подземными водами и основанием здания, снижающая риск воздействия влаги.
Есть два варианта полосы – насыпь, бетонирование.
Выбор способа зависит от типа почвы на участке, особенностей климата, насыщенности, степени пучинитости почвы, величины предполагаемой нагрузки.
Прежде, чем сделать выбор, нужно исследовать землю, собрать прочие данные.
Насыпной вариант — чередование слоев глины, щебня, песка с обязательным трамбованием для создания плотной линии.
Бетонирование проводится с армированием сеткой, рекомендуется сразу под заливку положить теплоизоляцию – пенополистирол, либо пеноплекс. Между уложенными плитами заделывают швы герметиком.
Между уложенными плитами заделывают швы герметиком.
Если вблизи растут кустарники или деревья с мощными корнями, необходимо сразу выложить по краю бордюрный камень. Можно покрыть плиткой, камнем. Мягкую конструкцию можно закатать асфальтом, засыпать галькой.
Назначение
Отмостка предотвращает образование на стенах грибка, плесени, вымывание раствора, сооружается с небольшим уклоном от здания по направлению наружу.
Максимальную защиту основания и подвальных помещений обеспечивает сочетание с системой дренажа под землей.
В очень холодных регионах применяют утепленный тип конструкции, чтобы избежать промерзания основания дома, снизить тепловые потери.
Мягкое сооружение — доступный способ строительства защиты, который подходит для зданий с малой нагрузкой, но может частично пропускать влагу. Вариант не применяют при очень влажном грунте, типе климата.
Мягкая насыпь по периметру постройкиТвердый вариант — бетонная лента, которая не сможет распределить большое давление без повреждений, но предотвращает проникновение влаги.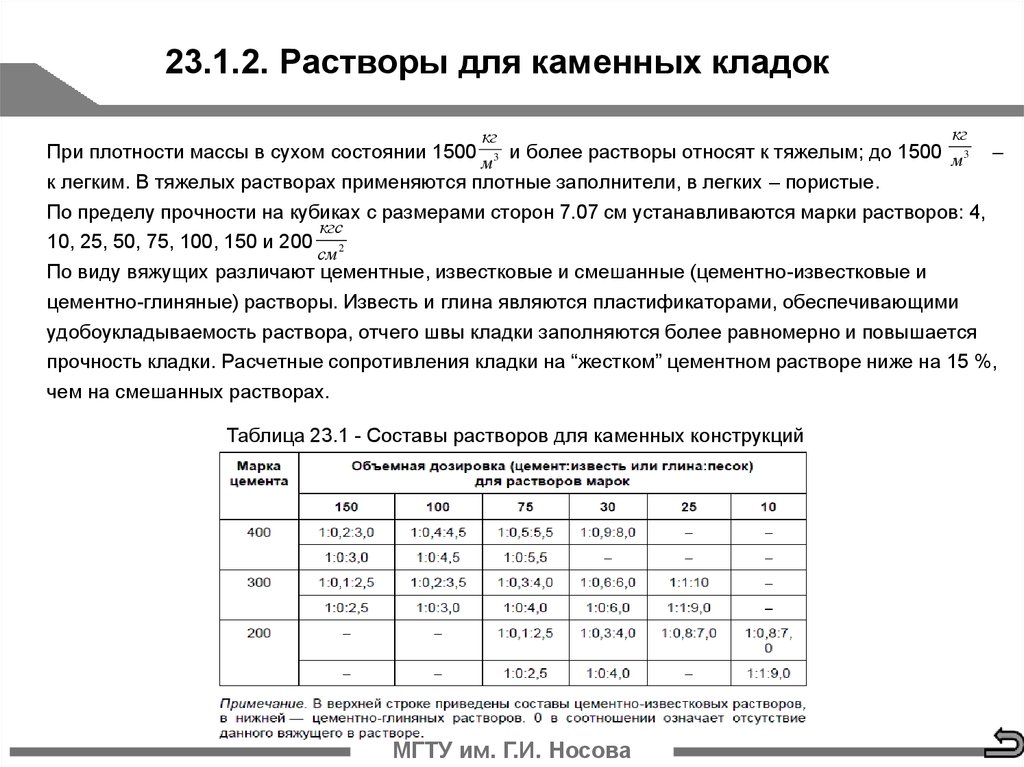
Требования к бетону
Если по насыпи движутся люди, автомобили, цемент должен быть прочным. Просто защита дома не предполагает больших нагрузок, можно использовать смесь низкой марки.
Главное, чтобы полученная заливка обладала достаточной степенью водонепроницаемости, стойкостью к промерзанию, высокой прочностью.
Какие основные принципы нужно усвоить, чтобы сделать качественную насыпь, можно узнать в следующем видео:
Какой марки должен получиться раствор
Конечная марка готового раствора зависит от маркировки цемента, пропорций составляющих веществ.
Под легкую полосу достаточно навести смесь, марки М100-М150, под уличную дорожку потребуется сделать марку чуть выше – М200.
В каких пропорциях замешивается раствор
Для качественного раствора нужно использовать чистые компоненты. Не просеянный песок, мутная вода, щебень вперемешку с мусором, не дадут нужный уровень адгезии. Заливка будет долго сохнуть, конструкция, скорее всего, разрушится после первой зимы.
Заливка будет долго сохнуть, конструкция, скорее всего, разрушится после первой зимы.
Оптимален цемент М400, конечный — М100.
Вымешивать компоненты нужно в правильной последовательности – сначала, до однородной массы вымешивают сухие вещества, только потом, постепенно добавляют, вмешивают воду.
Процесс замешивания под заливкуРазмешивать можно лопатой, но более качественный раствор получается после смешивания в бетономешалке.
Насколько важна водонепроницаемость
Чем меньше маркировка смеси, тем хуже параметры водонепроницаемости, грозит впитыванием грунтовой влаги, просачиванием к фундаменту. Толка от защиты будет мало.
Если вода будет напитывать заливку, поры начнут расширяться, затем, начинается деформация созданного сооружения. С наступлением заморозков мокрый бетон не выдерживает воздействия, покрывается трещинами.
Нужно делать смесь средней марки, чтобы отмостка была надежной, долговечной, эффективной. Придется покупать более дорогие материалы, но не нужно ничего переделывать, основание здания будет защищено.
Придется покупать более дорогие материалы, но не нужно ничего переделывать, основание здания будет защищено.
Как повысить водонепроницаемость у бетона низкой марки
Если невозможно сделать более высокомарочный бетон, можно постараться модифицировать доступный.
Есть два метода: внесение водостойких добавок, обработка застывшей поверхности.
Материалы для наружной обработки образуют связи с входящими в состав смеси минералами, перекрывая образующиеся поры. Количество образующихся влагостойких кристаллов прямо пропорционально количеству содержащейся влаги.
Дополнительные компоненты снижают общую сумму расходов, по сравнению с решением использования более высокой марки цемента. Придется выполнить ряд надбавочных действий.
Когда требуется локально повысить устойчивость к влаге, выполняют поверхностное железнение тремя методами.
Железнение цементомСухое железнение предполагает россыпь сухого цемента по поверхности заливки, разглаживание мастерком.
Мокрый вариант — нанесение жидких полимерных веществ, которые будут пропитывать стяжку, закупорят поры.
Третий вариант – компонентные внесения, например, жидкое стекло, процентное содержание которого в общем растворе не должно превышать 3%. Особенность методики — ускорение процесса, сжиженное стекло значительно ускоряет высыхание заливки.
Как сделать отмостку из бетона
Под защитную линию выкапывают траншею на небольшую глубину. Когда отмостка как придомовая дорожка не предполагается, не будет регулярной нагрузки, достаточно 15 см. Под большее давление выкапывают траншею на глубину 25 см. Ширина копки должна быть не менее 1 м, лучше больше.
Стенки выкопанного пространства выравнивают, дно трамбуют, насыпают слой щебенки, уплотняют, засыпают песчаную подушку, поливают водой, утрамбовывают.
Стелют геотекстиль, чтобы края отрезков заходили на стенки траншеи, посыпают гравием, щебнем, укладывают теплоизоляцию, выполняют герметизацию стыков между плитами.
Нужно уложить армирующую сетку, отрезав размер вставки, чтобы с каждой стороны от арматуры до края бетонного строения оставалось не менее сантиметра.
Затем, собирают опалубку из деревянных досок с обязательным скреплением шпильками, чтобы форму не разворотило от давления.
Через каждые 1,5-2 метра ставят поперечные распорки под компенсационный шов, призванный защитить бетон от разрушения в жару, когда размеры немного увеличиваются.
Если к дому нужно подвести коммуникации, сразу вставляют патрубки на нужных точках по принципу распорок.
Выполняют заливку, сразу протыкают раствор несколько раз арматурным прутом, дают искусственную усадку строительным вибратором. Будет удален лишний воздух, повысится прочность заливки, несущая способность.
При выполнении цементного железнения, от момента окончания бетонирования выжидают 1-2 часа, проводят процедуру по повышению влагостойкости.
Если нужно положить плитку, снова наводят раствор, каким заливали защитную полоску, кладут облицовочный материал на полностью просохший бетон.
Замешивают цементно-песчаный раствор.
Общие требования к отмостке вокруг здания несколько ниже, чем к фундаменту. Но лучше использовать качественные материалы в сочетании с дополнительными средствами сбережения целостности заливки. Тогда получится долговечное, прочное сооружение, сохраняющее целостность основной постройки.
Правила сооружения отмостки с утеплителем:
Приготовление раствора для отмостки своими руками
Первым этапом в изготовление сооружения станет обустройство котлована, который будет играть роль защитной системы. Он не должен выступать над поверхностью земли, но не должен быть сильно глубоко. Это делается для того, чтобы смесь для отмостки могла противостоять разрушению долго, а также это предотвращает намокание земли под сооружением.
Ширина котлована отмостки, как правило стандартных размеров не имеет, но чем шире она будет, тем меньше вероятность того, что вода повредит фундамент.
Иногда отмостка может использоваться в качестве подхода к дому и это стоит учитывать при определении ширины.
Таким образом, ширина отмостки должна составлять от 0,4 м до 1 м.
С тыльной стороны дома, ширину отмостки лучше сделать минимальной, в то время как с лицевой стороны ее можно сделать шире, все зависит от степени ее эксплуатации. В любом случае, отмостка сооружается с небольшим уклоном в направлении от дома, потому как вода должна стекать в почву.
Для этого нужно будет смастерить небольшую опалубку. Для изготовления прочной и надежной отмостки, вся конструкция должна быть целостной и единой. Идиальным условием будет получение монолита для этого отмостку нужно залить за один раз, следовательно, опалубку придется строить всю сразу, без промежуточных вставок и разделительных предметов.
Для того чтобы опалубка была ровной необходимо установить маяки. Располагать их лучше вдоль стен постройки.
Одним может быть край деревянной опалубки, для этого сориентируйте ее относительно уровня горизонта.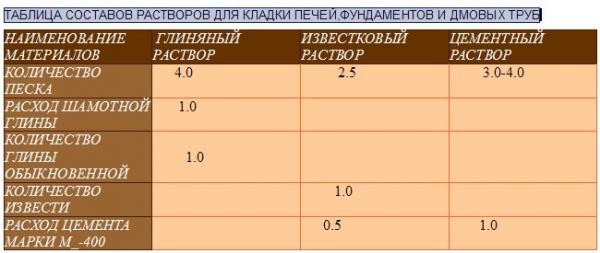 Вторым маяком могут послужить направляющие профили гипсокартона.
Вторым маяком могут послужить направляющие профили гипсокартона.
Проведение подготовительных мероприятий перед заливкой отмостки
Но перед тем как установить маяки нужно выполнить некоторые подготавительные мероприятия:
- Дно имеющегося котлована нужно посыпать щебенкой и хорошо утрамбовать. Это предотвратит оседание грунта и отмостка не потрескается. При выборе материалов разберитесь, какой щебень нужен для отмостки именно в вашем случае
- Следует сделать армирование. Железобетон имеет более длительный срок хранения, и растрескаться он практически не может, поэтому, даже если грунт и просядет в каким-либо месте, отмостка останется целой.
Для процедуры армирования необходимо взять металлическую сетку с ячейками 100х100 мм или арматуру. Учтите, сетка стоит намного дешевле, да и работать с ней намного проще. Сетку просто укладывают на основание, в то время как арматуру необходимо увязывать между собой.
Маяки устанавливаются только лишь после установки армирующего пояса.
Следующим этапом можно заливать отмостку.
У отмостки есть слабое место, без учета которого работа не пойдет. Сразу после залития бетона на стыке отмостки и стены образовывается трещина, через которую может заливаться вода. Чтобы этого не случилось перед залитием в стенах нужно сделать штробы с помощью перфоратора, для того чтобы бетон зашел в стену. Для более сильного эффекта, в штробе нужно просверлить отверстия и прикрепить туда арматуру. Таким образом, здание защищено и трещина не появится.
Правильное приготовление раствора
Главный успех бетонирования заключается в подготовлении бетона для отмостки. Основная загадка это подобрать правильный состав для отмостки дома. Многие считают, что ответ на вопрос как приготовить бетон для отмостки лежит в составе приготовления раствора для стяжек. Это неправильно, потому как состав раствора для отмостки дома отличается от других смесей типом цемента, песка. Также не маловажную роль играет фракция щебня для отмостки.
Раствор для отмостки дома должен иметь различные присадки, например морозостойкие.
Оптимальный состав бетона для отмостки это соотношение 1 части цемента к 3 частям щебня и песка. Вода в раствор для отмостки дома добавляется постепенно до достижения нужной густоты.
Заливаем и утрамбовываем раствор в опалубку. Далее остается оставить застывать раствор для отмостки дома, но этот процесс следует контролировать. Для этого спрячьте его от воздействия солнца и брызгайте на него водой в процессе высыхания. Качественный состав бетона для отмостки не потрескается, если соблюдать эти не хитрые правила. Потому как чем дольше высыхает бетон, тем крепче он становится и тем меньше повреждений будет у него в дальнейшем.
Еще по этой теме на нашем сайте:
- Сколько стоит залить отмостку вокруг дома
Для того чтобы отмостка служила долго, действительно защищала дом и обеспечивала водоотвод, ее изготовление лучше всего доверить профессионалам. Только они смогут выбрать качественный долговечный материал.
Только они смогут выбрать качественный долговечный материал.
Сколько стоит уложить отмостку вокруг дома из плитки
Отмостка – это конструкция, которая окружает дом беспрерывно по периметру и вплотную примыкает к цоколю. Основная функция отмостки – защита здания от попадания влаги в.
Уклон отмостки по СНиП – правильная конструкция отмостки дома
Основная функция отмостки предотвращать воздействие внешних факторов на фундамент дома. Эта защитная конструкция, которая должна предотвращать попадание любой влаги в здание, а для этого она.
Устройство отмостки вокруг дома из бетона − оптимальные параметры бетонной отмостки
Отмостка – это архитектурный элемент здания, который выполняет множество функций. Она предотвращает проникновение влаги в фундамент, подвал и технические помещения дома. Даже незначительное количество влаги.
Вы можете порекомендовать этот материал другим пользователям в социальных сетях
Важно не забывать, что устройство деформационных швов для отмостки из бетона нужно производить через каждые 2-2,5 метра , а на углах дома их присутствие просто обязательно. Для этого можно использовать рейки, которые размещаются на одном уровне с поверхностью, учитывая степень ее уклона.
Для этого можно использовать рейки, которые размещаются на одном уровне с поверхностью, учитывая степень ее уклона.
Добавить комментарий
Отменить ответВы можете подписаться на новые документы, публикуемые на сайте, и получать их на свою электронную почту:
Химический, молярный и массовый процент
Растворы представляют собой однородные (равномерно распределенные) смеси двух или более химических веществ. Растворы могут существовать в виде твердых тел, жидкостей или газов.
Все растворы содержат растворитель и одно или несколько растворенных веществ. Растворитель, часто вода, является наиболее распространенным химическим веществом. Растворенное вещество — это менее распространенные химические вещества.
Создание решений
Эксперименты по растворению твердых частиц и уменьшению масштаба
Для экспериментов вам часто потребуется растворять растворенные вещества в твердой форме, чтобы получить растворы определенной силы (сила измеряется диссоциацией ионов). Запланируйте один час на каждые 2-4 раствора, которые вам нужно приготовить. Вам потребуются весы для взвешивания растворенного вещества и градуированный цилиндр для измерения растворителя (если это вода).
Запланируйте один час на каждые 2-4 раствора, которые вам нужно приготовить. Вам потребуются весы для взвешивания растворенного вещества и градуированный цилиндр для измерения растворителя (если это вода).
Во-первых, определите концентрацию (массовый процент или молярность, см. Ниже) и количество (миллилитры) раствора, которое вам нужно, исходя из лабораторной процедуры. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из формул, приведенных ниже. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, с помощью градуированного цилиндра измерьте необходимый объем воды в миллилитрах и добавьте его в стакан.Размешивайте раствор, пока все химическое вещество не растворится.
Твердые куски химиката разбейте ступкой и пестиком или осторожно измельчите в полиэтиленовом пакете с помощью молотка. Химические вещества растворяются быстрее при осторожном нагревании раствора и перемешивании.
Вы можете рассмотреть возможность уменьшения масштаба, когда эксперименты требуют большого количества химикатов. Уменьшение масштаба снижает риски безопасности, химические затраты и удаление отходов.
Уменьшение масштаба снижает риски безопасности, химические затраты и удаление отходов.
Большинство экспериментов можно уменьшить, разделив растворенное вещество и растворитель на коэффициент по вашему выбору.Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы использовать только 5 г растворителя и 25 мл воды. Вы можете упростить масштабирование, используя мензурки, пробирки и другое измерительное оборудование меньшего размера.
При приготовлении химических растворов всегда используйте соответствующее защитное оборудование.
Как приготовить молярные растворы
Молярные (М) растворы основаны на количестве молей химического вещества в одном литре раствора.Моль состоит из 6,02 × 10 23 молекул или атомов. Молекулярный вес (MW) — это вес одного моля химического вещества. Определите молекулярную массу, используя периодическую таблицу, добавив атомную массу каждого атома в химическую формулу.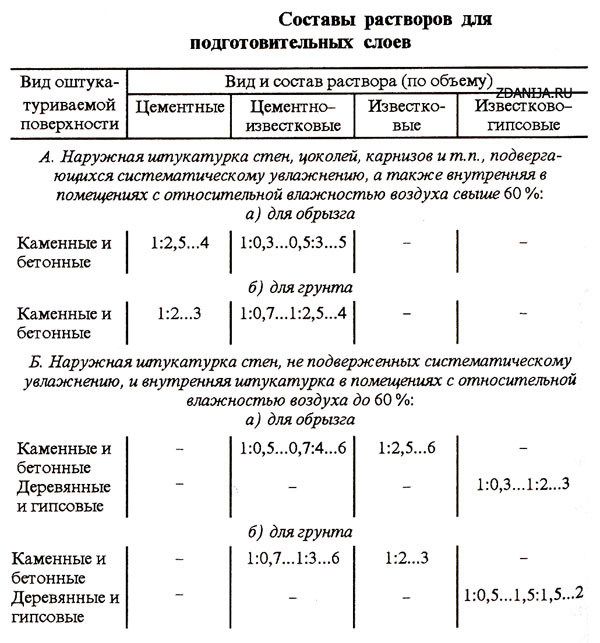
Пример. Для молекулярной массы CaCl 2 добавьте атомную массу Ca (40,01) к атомной массе двух Cl (2 x 35,45), чтобы получить 110,91 г / моль. Следовательно, 1М раствор CaCl 2 состоит из 110,91 г CaCl 2 , растворенных в воде, достаточной для приготовления одного литра раствора.
После того, как известна молекулярная масса растворенного вещества, масса химического вещества, которое должно раствориться в растворе для молярного раствора менее 1M, рассчитывается по формуле:
- граммов химического вещества = (молярность раствора в моль / литр) x (молекулярная масса химического вещества в г / моль) x (мл раствора) ÷ 1000 мл / литр
Например, чтобы приготовить 100 мл 0,1 М раствора CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам нужно:
- грамма CaCl 2 = (0.1) x (110,91) x (100) ÷ (1000) = 1,11 г
Теперь вы можете приготовить свой раствор: растворите 1,11 г CaCl 2 в воде, достаточной для получения 100 мл раствора. Необходимое количество воды будет чуть меньше 100 мл.
Необходимое количество воды будет чуть меньше 100 мл.
Для приготовления молярных растворов используются весы и мерная колба. Процедура приготовления молярного раствора с использованием мерной колбы на 100 мл следующая:
- Рассчитайте вес растворенного вещества, необходимый для приготовления 100 мл раствора, используя приведенную выше формулу.
- Взвесьте необходимое количество растворенного вещества на весах.
- Перенесите растворенное вещество в чистую сухую мерную колбу на 100 мл.
- Медленно добавьте дистиллированную воду в мерную колбу. При этом промойте все растворенное вещество на дне колбы. Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы.
- Поместите пробку в колбу и осторожно покачивайте колбу, пока все растворенное вещество не растворится.
Если у вас нет мерной колбы, вы можете использовать мерный цилиндр на 100 мл.Просто добавьте растворенное вещество в градуированный цилиндр, а затем добавьте дистиллированную воду до отметки 100 мл на боковой стороне цилиндра.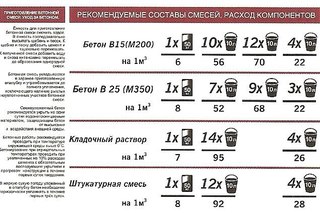
Как приготовить растворы в процентах по массе
В растворах массовых процентов вес растворенного вещества делится на вес раствора (растворенное вещество + вода) и умножается на 100. Поскольку плотность воды составляет 1 г / мл, формула для расчета количества растворенного вещества, которое должно смешать для получения массового процента раствора составляет:
- граммов растворенного вещества = (вес.% Раствора) x (мл воды) ÷ (100 — вес.% Раствора)
В качестве примера, чтобы приготовить 100 мл 10% раствора NaCl (поваренной соли), используйте предыдущую формулу, чтобы узнать, сколько NaCl вам нужно:
- грамма NaCl = (10) x (100) ÷ (100-10) = 11.1 г
Теперь вы можете приготовить свой раствор: растворите 11,1 г NaCl в 100 мл воды.
Создайте собственное решение для этих проектов:
Frozen Bubbles
Радужная реакция
Биологический тест на токсичность
Гальваника: ключ с медным покрытием
Реакции в растворе — Химия LibreTexts
Раствор состоит из двух или более веществ, растворенных в жидкой форме. Не путайте со смесью , которая является гетерогенной — существует множество веществ с разной структурой — растворы гомогенны, что означает, что атомы растворенного вещества равномерно распределены по растворителю (например,вода, этанол). Думайте об этом как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, которое растворяется.
Не путайте со смесью , которая является гетерогенной — существует множество веществ с разной структурой — растворы гомогенны, что означает, что атомы растворенного вещества равномерно распределены по растворителю (например,вода, этанол). Думайте об этом как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, которое растворяется.
отл.
Раствор NaCl в воде Смесь блоков лего и воды
Примечание. Все растворы являются смесями, но не все смеси.
Растворители
Вода (H 2 O) — наиболее распространенный растворитель, используемый для растворения многих соединений или приготовления кофе.Среди других распространенных растворителей — скипидар (разбавитель для краски), ацетон (жидкость для снятия лака) и этанол (используется в некоторых парфюмерии). Такие растворители обычно содержат углерод и называются органическими растворителями. Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, о которых здесь говорится.
Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, о которых здесь говорится.
Растворенные вещества
Различные химические соединения растворяются в растворенных веществах в разной степени. Некоторые соединения, такие как сильнокислая соляная кислота (HCl), полностью диссоциируют в растворе на ионы.Другие, такие как слабый щелочной аммиак (NH 3 ), диссоциируют лишь частично. Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями. В лабораторных реакциях часто участвуют кислоты и основания, о которых здесь подробнее рассказывается.
Концентрация
Концентрация — это мера количества растворенного вещества в определенном количестве растворителя. Знание концентрации раствора важно, помимо прочего, для определения силы кислоты или основания (pH).Когда в концентрации присутствует так много растворенного вещества, что оно больше не растворяется, раствор становится насыщенным.
Ученые часто используют молярность для измерения концентрации.
молярность = моль / литр
Поскольку стехиометрия реакции зависит от молярных соотношений, молярность является основным показателем концентрации.
Менее распространенная единица измерения концентрации называется моляльность .
Моляльность = моль / кг растворителя
Ученые иногда используют молярность для измерения концентрации, потому что объемы жидкости незначительно меняются в зависимости от температуры и давления.Однако масса остается прежней и ее можно точно измерить с помощью весов. Коммерческие концентрированные продукты обычно выражаются в массовых процентах; такие как промышленная концентрированная серная кислота, которая составляет 93-98% H 2 SO 4 по массе в воде (Hill, Petrucci 116).
Принятие решения
Растворы, используемые в лаборатории, обычно состоят из твердых растворенных веществ (часто солей) или исходных растворов.
Чтобы приготовить раствор из твердых растворенных веществ, сначала вычислите, сколько молей растворенного вещества содержится в желаемых растворах (используя молярность).Вычислите необходимое количество твердого вещества в граммах, используя необходимые моли и молярную массу растворенного вещества, и взвесьте необходимое количество. Перенесите растворенное вещество в контейнер (желательно мерную колбу, которая наиболее точно измеряет объем раствора, указанный на колбе) и добавьте небольшое количество растворителя. Тщательно перемешайте, чтобы растворенное вещество растворилось. После растворения растворенного вещества добавьте оставшийся растворитель, чтобы получить раствор желаемого объема, и тщательно перемешайте.
Например, чтобы сделать 0.5 литров 0,5 молярного NaCl:
1. Умножьте концентрацию (0,5 моль / литр) на объем раствора, который вам нужен (0,5 литра), чтобы найти нужное количество молей NaCl.
0,5 моль / литр * 0,5 литра = 0,25 моль NaCl
2. Умножьте моли NaCl на его молярную массу (58,44 г / моль), чтобы найти необходимые граммы растворенного вещества.
Умножьте моли NaCl на его молярную массу (58,44 г / моль), чтобы найти необходимые граммы растворенного вещества.
(0,25 моль NaCl) * (58,44 г / моль) = 14,61 г NaCl
Приготовление раствора определенной концентрации из основного раствора называется разбавлением.При разбавлении раствора имейте в виду, что добавление растворителя в раствор изменяет концентрацию раствора, но не количество уже присутствующего растворенного вещества.
Чтобы разбавить раствор с известной концентрацией, сначала определите количество молей растворенного вещества в растворе, умножив молярность на объем (в литрах). Затем разделите на желаемую молярность или объем, чтобы найти необходимый объем или концентрацию.Используемое уравнение — просто
M 1 V 1 = M 2 V 2
M 1 и V 1 — концентрация и объем исходного (исходного) раствора для разбавления; M 2 и V 2 — желаемая концентрация и объем конечного раствора.
Стехиометрия раствора
Для реакций, протекающих в растворах:
- Рассчитайте количество молей растворенного вещества в реакции, умножив концентрацию (молярность) на объем раствора (литры).
- Определить предельный реагент, если он есть
- Следуйте стехиометрическому процессу.
- Преобразуйте полученные моль растворенного вещества обратно в молярность, разделив на общий объем в литрах раствора, использованного в реакции.
- В случае реакций с участием ионов (например, в реакциях между сильными кислотами и основаниями), исключить ионы-наблюдатели из общего ионного уравнения. Ионы-наблюдатели в уравнениях не реагируют.
- Если концентрация не указана, но указаны молярная масса и объем, используйте плотность (граммы / литр), чтобы найти количество растворенного вещества в граммах, затем преобразуйте его в моль.
Список литературы
- Хилл, Петруччи. Общая химия: комплексный подход, второе издание.
 Нью-Джерси: Прентис-Холл, 1999.
Нью-Джерси: Прентис-Холл, 1999. - Петруччи, Харвуд, Селедка, Мадура. Общая химия: принципы и современные приложения, девятое издание. Нью-Джерси: Прентис-Холл, 2007.
Проблемы
- Раствор готовят растворением 44,6 г ацетона (OC (CH 3 ) 2 ) в воде с получением 1,50 литра раствора. Какая молярность полученного раствора?
- Для определенной лабораторной процедуры требуется 0,025 M H 2 SO 4 .Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
- Образец насыщенного NaNO 3 (водн.) — 10,9 M при 25 градусах Цельсия. Сколько граммов NaNO 3 содержится в 230 мл этого раствора при той же температуре?
- Стакан с 175 мл 0,950 М NaCl оставляют открытым на некоторое время. Если к концу периода времени объем раствора в химическом стакане уменьшился до 137 мл (потеря объема связана с испарением воды), какова результирующая концентрация раствора?
- Студент готовит раствор, растворяя 15.
 0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
Авторы и авторство
Приготовление растворов
Приготовление на водной основе Решения данной молярности
Молярность — полезный способ описания концентраций растворенных веществ в решение, а также источник полезных коэффициентов пересчета для конвертации между объемом (легко измеримое свойство растворов) и молями растворенного вещества.
Теперь посмотрим, как решения определенной молярности.
Представьте, что вы готовите
провести эксперимент, который требует двух растворов, 0,500 M Na 2 CO 3 и 1,50 М HCl. Типичный склад химии, вероятно, не будет хранить
решения этих типов, поэтому вам нужно будет составлять их из запасов
это доступно. На складе, вероятно, есть чистый карбонат натрия, поэтому
0. 500 M Na 2 CO 3 раствор может быть получен из чистого Na 2 CO 3 и вода. На складе почти наверняка не будет чистого хлористого водорода,
однако, потому что это газ, который трудно и опасно хранить. Вместо,
вы, вероятно, найдете концентрированный раствор соляной кислоты, который составляет 12
M HCl. Этот раствор можно разбавить до 1,50 М HCl.
500 M Na 2 CO 3 раствор может быть получен из чистого Na 2 CO 3 и вода. На складе почти наверняка не будет чистого хлористого водорода,
однако, потому что это газ, который трудно и опасно хранить. Вместо,
вы, вероятно, найдете концентрированный раствор соляной кислоты, который составляет 12
M HCl. Этот раствор можно разбавить до 1,50 М HCl.
Приведенное выше обсуждение предполагает что есть два общих способа приготовления растворов с заданной молярностью:
- Растворы можно приготовить, исходя из чистого растворенного вещества и воды.
- Растворы можно приготовить из более концентрированных растворов.
Создание решений из чистых твердых частиц
Следующие шаги описывают процедура приготовления раствора определенной молярности из чистого твердого субстанция.
- Во-первых, взвесьте правильную массу растворенного вещества.
- Растворите растворенное вещество в воде, сохраняя объем меньше, чем
желаемый общий объем раствора.

- Разбавьте раствор до желаемого общего объема раствора.
Нажмите здесь, чтобы увидеть Пример 1.
Нажмите здесь, чтобы увидеть образец листа исследования проблем которые просят вас описать, как приготовить водный раствор, начиная с чистого твердый.Нажмите здесь, чтобы увидеть Упражнение 1.
Изготовление Решения от More Concentrated Solutions Потому что это непрактично для
типичная лаборатория для приготовления растворов соляной кислоты из чистого HCl, химик
чаще заказывают раствор соляной кислоты, а не чистый водород
хлорид от химической компании-поставщика.Растворы соляной кислоты a
химик может использовать в реакциях концентрации 1 M HCl или 6 M HCl,
но растворы с такой концентрацией потребляли бы неудобное количество
место для хранения на складе химии. Следовательно, концентрированная соляная
раствор кислоты, обычно около 12 M HCl, покупается и хранится, и разбавляется
воды, когда требуется более разбавленный раствор. Концентрации типичных
концентрированные растворы кислоты и щелочной аммиак приведены в таблице.
ниже.
Концентрации типичных
концентрированные растворы кислоты и щелочной аммиак приведены в таблице.
ниже.
Типичные концентрации концентрированных кислот и аммиака
Вещество | Молярность | Массовый процент |
Соляная кислота, HCl (водн.) | 12,1 м | 38.7% |
Серная кислота, H 2 SO 4 | 17,8–18,4 млн | 95% -98% |
Азотная кислота, HNO 3 | 15,8 M | 69,71% |
Уксусная кислота, HC 2 H 3 O 2 | 17. | 99,7% |
Аммиак, NH 3 (водн.) | 14,8 млн | 28% |
Ниже приводится общая процедура разбавления относительно концентрированного раствора для образования тот, который более разбавлен. (Есть немного другая процедура для разбавление почти чистых кислот, таких как концентрированная серная кислота, что составляет 95-98% H 2 SO 4 .Мы ограничимся нашими примерами к разбавлению растворов, которые уже содержат значительное количество вода.)
- Добавьте правильный объем более концентрированного раствора в прибор для измерения объема, например мерная колба. (См. Пример 15.7 для примера того, как рассчитывается этот объем.)
- Добавьте воды, пока объем не достигнет желаемого значения.

Нажмите здесь, чтобы увидеть Пример 2.
Как упоминалось в Пример № 2, ярлык может использоваться для решения проблем, в которых относительно концентрированный раствор необходимо разбавить для получения раствора это менее концентрировано. Когда более концентрированный раствор разбавляется на при смешивании с водой количество растворенного вещества не меняется. Таким образом, число молей растворенного вещества в концентрированном растворе равно количеству молей растворенного вещества в разбавленном растворе.
# молей растворенного в концентрированный раствор = # моль растворенного вещества в разбавленном растворе
Моли растворенного вещества могут быть рассчитывается путем умножения объема раствора на молярность решение.
или
или В конц сол M конц soln = V dil soln M dil soln
Это знание приводит к
легко запоминающееся уравнение, которое мы можем использовать для решения задач этого
тип. Мы будем называть эти проблемы проблемами разбавления.
Мы будем называть эти проблемы проблемами разбавления.
M C В C = M D V D
М С = молярность более концентрированного раствора
V C = объем более концентрированного раствора
M D = молярность более разбавленного раствора
V D = объем более разбавленного раствора
Если вы знать это уравнение и распознавать ситуации, к которым оно применимо, это может сэкономить вам довольно много времени.Например, его можно использовать вместо размерного анализа в работу Пример №3.
Нажмите здесь, чтобы увидеть альтернативное решение для примера 2.
а образец учебный лист по проблемам разбавления.
Нажмите здесь, чтобы увидеть Пример 3.
Щелкните здесь, чтобы увидеть Упражнение 2.
Нажмите здесь, чтобы увидеть пример 4.
Щелкните здесь, чтобы просмотреть общий образец листа исследования для проблемы, которые просят вас описать, как решить конкретную молярность.
Нажмите здесь, чтобы увидеть Упражнение 3.
Примеры решений
Здесь представлены два простых примера. Треть пример представляет собой сложное решение, для которого в описании перечислены концентрации компонентов используя разные выражения.
Масса по объему: приготовить 2 литра 0,85% натрия хлорид
Если 1% определяется как 1 грамм на 100 мл, 0.85% это 0,85 грамма на 100 мл. Поскольку два литра — это 20х объем 100 мл, нам понадобится 20х0,85 граммов, что составляет 17 граммов NaCl. Для этого количества мы можем использовать балансир с верхней загрузкой или даже баланс поездки.
Обычные электронные весы с точностью до одного сотые доли грамма, что достаточно точно для развешивания 17 грамм. Сначала «тараем» прибор, поместив весовую лодку на чашу весов и установив его на «ноль.«Мы не хотим загрязнить наши химические запасы, поэтому мы перед окунанием очистите шпатель или ложку в контейнер или просто встряхиваем химикат на лодку.
Предположим, что мы извлекаем 16,97 грамма NaCl. Должен мы возьмем последние 0,03 грамма? Неа! Считайте, что если бы это было необходимо, чтобы быть более точным, мы бы описали формула как-то вроде 0.846% NaCl, а может 0,8495%. Если есть какое-то преимущество в точности тогда мы должны проявлять точность, иначе пытаемся чтобы быть слишком точным, просто напрасная трата времени.
Помните, как использовать значащие цифры? Семнадцать
граммы означает больше 16,5 граммов и меньше
17,5 грамм. Если бы мы хотели быть более точными, мы
напишет «17,0» грамма, что означает большее
больше или равно 16,95 грамма и меньше или равно
до 17.05 грамм.
Если бы мы хотели быть более точными, мы
напишет «17,0» грамма, что означает большее
больше или равно 16,95 грамма и меньше или равно
до 17.05 грамм.
Молярность: приготовьте 200 мл 70 мМ сахарозы
Предположим, вам нужно 200 миллилитров 70 мМ раствор сахарозы. Двести миллилитров составляет 0,2 л, а 70 мМ — 0,07 М. Молекулярная масса сахарозы можно определить по ее химическому формула, а именно C12h32O11 и атомные веса углерода, водорода и кислорода. Формула масса сахарозы идентична ее молекулярной вес, а именно 342.3 грамма на моль. Решение 1M будет состоять из 342,3 грамма сахарозы в одном литр конечный объем. Концентрация 70 мМ такая же, как 0,07 моль
за литр. Возьмите 0,07 моль / литр, умноженное на 342,3 грамма.
на моль, и вам потребуется 23,96 грамма на литр. Чтобы умножить 200 миллилитров вашего раствора
грамм / литр на литры. Начиная с 200 миллилитров
составляет 0,2 л, умножьте 23,96 грамма на 0.2 л, чтобы получить 4,792
граммы нужны. Поскольку типичная электроника с верхней загрузкой
весы отображают массу с точностью до 0,01 грамма,
взвешиваемая сумма должна быть округлена до 4,79
граммов, хотя это вполне приемлемо и
возможно, даже предпочтительнее округлить до 4,8 грамма.
Чтобы умножить 200 миллилитров вашего раствора
грамм / литр на литры. Начиная с 200 миллилитров
составляет 0,2 л, умножьте 23,96 грамма на 0.2 л, чтобы получить 4,792
граммы нужны. Поскольку типичная электроника с верхней загрузкой
весы отображают массу с точностью до 0,01 грамма,
взвешиваемая сумма должна быть округлена до 4,79
граммов, хотя это вполне приемлемо и
возможно, даже предпочтительнее округлить до 4,8 грамма.
Комплексный раствор: приготовьте буфер для образцов SDS-PAGE
Следующая формула описывает состав
2-кратного концентрированного буфера, который мы используем для денатурирования
белки для электрофореза.Описание формул
v / v или w / w не будут перечислены в разделе методов
так как очевидно, какие компоненты жидкие
или твердые вещества.
50% (об. / Об.) Концентрированный буфер геля для стекирования SDS-PAGE,
pH 6,8
4,6% (мас. / об.) додецилсульфат натрия
20% (об. / об.) глицерина
160 мМ дитиотреитол (реактив Клеланда)
0,01% краситель бромфенолового синего
Для 100 мл буфера для образцов 125 мл Эрленмейера
колба является подходящим сосудом для смешивания.Жидкость
компоненты займут 70% от общего объема
поэтому мы начинаем с размещения 50 мл гелевого буфера для укладки
и 20 мл глицерина в колбе. Глицерин очень
вязкая, поэтому для большей точности вы можете использовать шприц
доставить вещи. Нам нужно 4,6 грамма (4,6%)
додецилсульфата натрия (также называемого лаурилсульфатом).
Для равномерного перемешивания добавляйте при перемешивании.
решение. Концентрация красителя также
дано как объемная масса.Одна сотая 1%
составляет всего 0,1 мг / мл.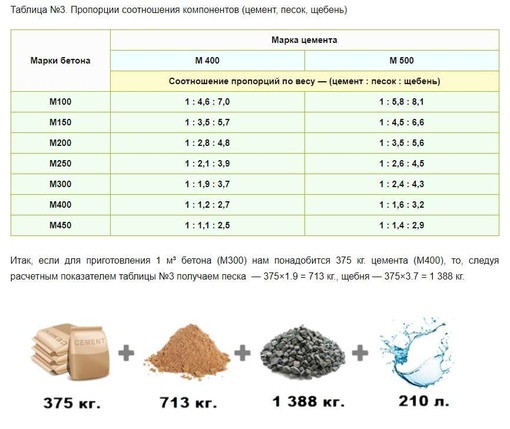 Вам понадобится всего 10 мг.
Поскольку бромфеноловый синий служит отслеживающим
краситель и его концентрация не критична, вы
может весить что-то около 10 мг или просто
используйте «щепотку», добавляя количество на узких
конец шпателя.
Вам понадобится всего 10 мг.
Поскольку бромфеноловый синий служит отслеживающим
краситель и его концентрация не критична, вы
может весить что-то около 10 мг или просто
используйте «щепотку», добавляя количество на узких
конец шпателя.
Формула веса реактива Клеланда 154 грамм / моль. Взвешиваемое количество равно (0,16 моль / л) (0.1 л) (154 г / моль) = 2,46 г (круглые от до 2,5 г).
В большинстве случаев нагревать
раствор для перемешивания, но в этом случае моющее средство
не растворяется полностью, пока
с подогревом. После того, как поставили колбу в микроволновую печь
духовку на минуту или около того на медленном огне и помешивая
немного раствор должен быть готов влить в
градуированный цилиндр на 100 мл для доливки
дистиллированная вода.
Концентрация раствора | Безграничная химия
Разведений растворов
Разбавление раствора включает добавление дополнительного растворителя для уменьшения концентрации раствора.
Цели обучения
Рассчитайте концентрацию разбавленного раствора.
Основные выводы
Ключевые моменты
- Чаще всего концентрация раствора выражается в процентах по массе, мольной доле, молярности, моляльности и нормальности.При расчете коэффициентов разбавления важно, чтобы единицы объема и концентрации оставались согласованными.
- Расчеты разбавления могут быть выполнены по формуле M 1 V 1 = M 2 V 2 .
- Серийное разведение — это серия пошаговых разведений, где коэффициент разведения поддерживается постоянным на каждом этапе.
Ключевые термины
- разбавление : раствор, в который был добавлен дополнительный растворитель, например вода, чтобы сделать его менее концентрированным
- серийное разведение : ступенчатое разведение вещества в растворе
Разбавление — это процесс добавления к раствору дополнительного растворителя для уменьшения его концентрации. Этот процесс поддерживает постоянное количество растворенного вещества, но увеличивает общее количество раствора, тем самым уменьшая его конечную концентрацию. Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов является необходимым процессом в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Этот процесс поддерживает постоянное количество растворенного вещества, но увеличивает общее количество раствора, тем самым уменьшая его конечную концентрацию. Разбавление также может быть достигнуто путем смешивания раствора более высокой концентрации с идентичным раствором меньшей концентрации. Разбавление растворов является необходимым процессом в лаборатории, так как исходные растворы часто покупаются и хранятся в очень концентрированных формах. Чтобы растворы можно было использовать в лаборатории (например, для титрования), они должны быть точно разбавлены до известной, меньшей концентрации.
Объем растворителя, необходимый для приготовления нового разбавленного раствора желаемой концентрации, можно рассчитать математически. Отношения следующие:
[латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ latex]
M 1 обозначает концентрацию исходного раствора, а V1 обозначает объем исходного раствора; M 2 представляет собой концентрацию разбавленного раствора, а V2 представляет собой конечный объем разбавленного раствора. При расчете коэффициентов разбавления важно, чтобы единицы измерения объема и концентрации были одинаковыми для обеих сторон уравнения.
При расчете коэффициентов разбавления важно, чтобы единицы измерения объема и концентрации были одинаковыми для обеих сторон уравнения.
Пример
- 175 мл 1,6 М водного раствора LiCl разбавляют водой до конечного объема 1,0 л. Какова конечная концентрация разбавленного раствора?
- [латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ latex]
- (1,6 M) (175 мл) = M 2 (1000 мл)
- M 2 = 0.28 млн
Разбавления : Разбавления иногда можно наблюдать визуально. На изображении выше интенсивный красный цвет медленно исчезает по мере того, как раствор становится более разбавленным.
Серийные разведения
Серийные разведения включают разведение исходного раствора или стандартного раствора несколько раз подряд. Обычно коэффициент разбавления остается постоянным для каждого разбавления, что приводит к экспоненциальному снижению концентрации. Например, десятикратное серийное разведение может привести к следующим концентрациям: 1 M, 0.1 M, 0,01 M, 0,001 M и т. Д. Как видно из этого примера, концентрация уменьшается в десять раз на каждом этапе. Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой. Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Например, десятикратное серийное разведение может привести к следующим концентрациям: 1 M, 0.1 M, 0,01 M, 0,001 M и т. Д. Как видно из этого примера, концентрация уменьшается в десять раз на каждом этапе. Последовательные разведения используются для точного создания чрезвычайно разбавленных растворов, а также растворов для экспериментов, требующих кривой концентрации с экспоненциальной или логарифмической шкалой. Серийные разведения широко используются в экспериментальных науках, включая биохимию, фармакологию, микробиологию и физику.
Решение проблем разбавления в химии раствора ЯСНО И ПРОСТО — YouTube : В этом видео показано, как решить две задачи разбавления, используя стандартную формулу разбавления, M 1 V 1 = M 2 V 2 .
Использование молярности в расчетах растворов
Молярность — это единица концентрации; он равен количеству молей растворенного вещества, деленному на общий объем раствора в литрах.
Цели обучения
Перевести между молярностью, граммами растворенного вещества в растворе и объемом раствора.
Основные выводы
Ключевые моменты
- Молярная концентрация, также называемая молярностью, — это количество молей растворенного вещества на литр раствора.Молярность — это наиболее распространенное измерение концентрации раствора.
- Поскольку молярность измеряется в моль / л, мы часто используем эту единицу для стехиометрических расчетов, чтобы определить количество химического вещества в данной смеси.
- Не путайте моль с молярностью: молярность — это мера концентрации, а моль — мера количества вещества.
Ключевые термины
- молярность : Концентрация вещества в растворе, выраженная в количестве молей растворенного вещества на литр раствора.
- раствор : однородная смесь жидкости, газа или твердого вещества, образованная растворением одного или нескольких веществ
- моль :
Молярность
В химии молярная концентрация или молярность определяется как количество молей растворенного вещества на общее количество литров раствора. Это важное различие; объем в определении молярности относится к объему раствора , а не к объему растворителя. Причина в том, что один литр раствора обычно содержит немного больше или чуть меньше 1 литра растворителя из-за присутствия растворенного вещества.Единица измерения молярности в системе СИ — моль / м 3 ; однако вы почти всегда будете встречать молярность в единицах моль / л. Раствор с концентрацией 1 моль / л также обозначается как «1 молярный» (1 М). Мол / л также можно записать следующими способами (однако чаще всего используется моль / л или просто М):
Это важное различие; объем в определении молярности относится к объему раствора , а не к объему растворителя. Причина в том, что один литр раствора обычно содержит немного больше или чуть меньше 1 литра растворителя из-за присутствия растворенного вещества.Единица измерения молярности в системе СИ — моль / м 3 ; однако вы почти всегда будете встречать молярность в единицах моль / л. Раствор с концентрацией 1 моль / л также обозначается как «1 молярный» (1 М). Мол / л также можно записать следующими способами (однако чаще всего используется моль / л или просто М):
1 моль / л = 1 M = 1 моль / дм 3 = 1 моль дм −3 = 1000 моль / м 3
Важно отличать родинки от молярности; молярность — это мера концентрации, в то время как моль — мера количества вещества, присутствующего в данный момент.
Молярность : Молярность — это мера концентрации в единицах моль растворенного вещества на литр раствора.
Использование молярности в расчетах с использованием решений
Молярность может использоваться в различных расчетах с использованием растворов. Следующая формула очень полезна, поскольку она связывает молярность раствора, общий объем раствора (в литрах) и количество молей растворенного вещества:
[латекс] \ text {MV} = \ text {mol} [/ latex]
Пример 1
Студент набирает пипеткой 100 мл пробы 1.5 М раствор бромида калия. Сколько молей бромида калия содержится в образце?
[латекс] \ text {MV} = \ text {mol} [/ latex]
(1,5 M) (0,100 л) =
мольмоль = 0,15 моль KBr
Обратите внимание, что в приведенном выше примере объем необходимо преобразовать в л из мл.
Вы могли заметить, что приведенная выше формула имеет некоторое сходство с нашей формулой разведения :
[латекс] \ text {M} _1 \ text {V} _1 = \ text {M} _2 \ text {V} _2 [/ latex]
Поскольку теперь мы знаем, что MV = моль, мы можем упростить нашу формулу разбавления до следующего:
[латекс] \ text {mol} _1 = \ text {mol} _2 [/ latex]
Это не должно нас удивлять.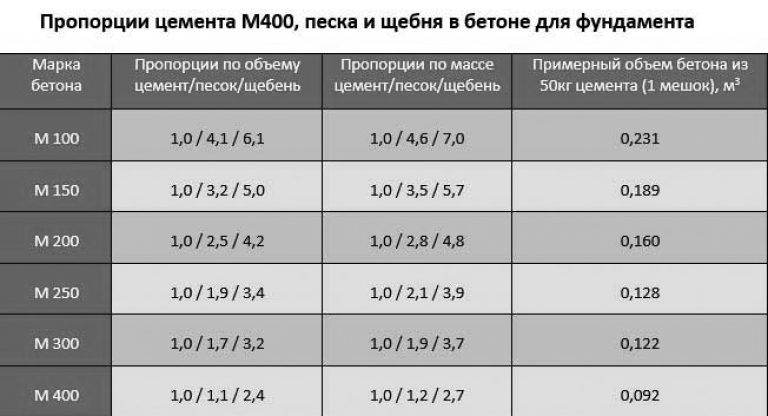 В конце концов, при любом разбавлении изменяется количество растворителя, в то время как количество молей растворенного вещества остается постоянным на всем протяжении.
В конце концов, при любом разбавлении изменяется количество растворителя, в то время как количество молей растворенного вещества остается постоянным на всем протяжении.
Пример 2
Какова молярность раствора, содержащего 0,32 моль NaCl в 3,4 литрах раствора?
[латекс] \ text {M} = \ frac {0,32 \ text {моль NaCl}} {3,4 \ text {L раствор}} = {0,094 \ text {M NaCl}} [/ латекс]
Практические задачи по молярности — YouTube : Это видео демонстрирует практические задачи с молярностью, вычислением молей и литров для определения молярной концентрации.Он также использует коэффициенты преобразования для преобразования граммов в моль и между миллилитрами и литрами.
Проблемы практики молярности (часть 2) — YouTube : Используйте молярность для преобразования массы и объема в растворе. В этом видео показано, как использовать молярность в качестве коэффициента преобразования. Если вам известна молярность, вы можете вычислить количество молей или объем раствора. Кроме того, молярность — это соотношение, которое описывает количество молей растворенного вещества на литр раствора.
В этом видео показано, как использовать молярность в качестве коэффициента преобразования. Если вам известна молярность, вы можете вычислить количество молей или объем раствора. Кроме того, молярность — это соотношение, которое описывает количество молей растворенного вещества на литр раствора.
Стехиометрия раствора
Стехиометрия может использоваться для расчета количественных соотношений между видами в водном растворе.
Цели обучения
Рассчитывайте концентрации растворов по молярности, моляльности, мольной доле и процентам по массе и объему.
Основные выводы
Ключевые моменты
- Стехиометрия определяет относительные количества реагентов и продуктов в химических реакциях. Его можно использовать для определения количества продуктов из данных реагентов в сбалансированной химической реакции, а также процентного выхода.
- Чтобы рассчитать количество продукта, рассчитайте количество молей для каждого реагента.
 Моли продукта равны молям ограничивающего реагента в однозначной стехиометрии реакции. Чтобы найти массу продукта, нужно умножить количество молей на молекулярную массу продукта.
Моли продукта равны молям ограничивающего реагента в однозначной стехиометрии реакции. Чтобы найти массу продукта, нужно умножить количество молей на молекулярную массу продукта. - В стехиометрических расчетах растворов в качестве коэффициента пересчета часто используется заданная концентрация раствора.
Ключевые термины
- стехиометрия : исследование и расчет количественных (измеримых) соотношений реагентов и продуктов в химических реакциях (химические уравнения)
- молярность : концентрация вещества в растворе, выраженная в количестве молей растворенного вещества на литр раствора
- моляльность : концентрация вещества в растворе, выраженная как количество молей растворенного вещества на килограмм растворителя
Концентрация растворов
Напомним, что раствор состоит из двух компонентов: растворенного вещества (растворенного вещества) и растворителя (жидкости, в которой растворенное вещество растворено). Количество растворенного вещества в данном количестве раствора или растворителя известно как концентрация. Двумя наиболее распространенными способами выражения концентрации являются молярность и молярность.
Количество растворенного вещества в данном количестве раствора или растворителя известно как концентрация. Двумя наиболее распространенными способами выражения концентрации являются молярность и молярность.
Молярность
Молярная концентрация (M) раствора определяется как количество молей растворенного вещества (n) на литр раствора (т. Е. Объем V раствора ):
[латекс] \ text {M} = \ frac {\ text {n}} {\ text {V} _ {\ text {solution}}} [/ latex]
Единицы измерения молярности — моль / л, часто сокращенно M .
Например, количество молей NaCl в 0,123 л 1,00 М раствора NaCl можно рассчитать следующим образом:
[латекс] 0,123 \ text {л раствора} \ times \ frac {1,00 \ text {моль}} {1,00 \ text {л раствора}} = 0,123 \ text {моль NaCl} [/ латекс]
Моляльность
Молярная концентрация (m) раствора определяется как число молей растворенного вещества (n) на килограмм растворителя (т. е. масса растворителя, m растворителя ):
е. масса растворителя, m растворителя ):
[латекс] \ text {m} = \ frac {\ text {n}} {\ text {m} _ {\ text {растворитель}}} [/ латекс]
Единицы моляльности — моль / кг, или м .
Например, количество молей NaCl, растворенных в 0,123 кг H 2 O (растворитель), чтобы приготовить 1,00 м раствор NaCl, можно рассчитать следующим образом:
[латекс] 0,123 \ text {кг растворителя} \ times \ frac {1,00 \ text {моль}} {1,00 \ text {кг растворителя}} = 0,123 \ text {моль NaCl} [/ латекс]
Стехиометрия реакций в растворах
Мы можем выполнять стехиометрические расчеты для реакций в водной фазе так же, как для реакций в твердой, жидкой или газовой фазах.Почти всегда в наших расчетах мы будем использовать концентрации растворов как коэффициенты преобразования .
Пример
- 123 мл 1,00 М раствора NaCl смешивают с 72,5 мл 2,71 М раствора AgNO 3 . Какова масса AgCl (ов), образовавшихся в результате реакции осаждения?
Кристаллы хлорида серебра (AgCl) : Стехиометрия определяет относительные количества реагентов и продуктов в химических реакциях.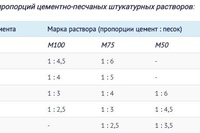 Его можно использовать для определения количества продуктов из данных реагентов в сбалансированной химической реакции, а также процентного выхода.
Его можно использовать для определения количества продуктов из данных реагентов в сбалансированной химической реакции, а также процентного выхода.
Во-первых, нам нужно написать наше сбалансированное уравнение реакции:
[латекс] \ text {AgNO} _3 (aq) + \ text {NaCl} (aq) \ rightarrow \ text {AgCl} (s) + \ text {NaNO} _3 (aq) [/ latex]
Следующим шагом, как и в любом вычислении, включающем стехиометрию, является определение нашего предельного реагента. Мы можем сделать это, преобразовав оба наших реагента в моль:
[латекс] \ text {123 мл NaCl} \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {1.00 моль NaCl}} {\ text {1 L}} = \ text {0,123 моль NaCl} [/ латекс]
[латекс] \ text {72,5 мл AgNO} _3 \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {2,71 моль AgNO} _3} {\ text { 1 л}} = \ text {0,196 моль AgNO} _3 [/ латекс]
Из нашего уравнения реакции видно, что AgNO3 и NaCl реагируют в соотношении 1: 1.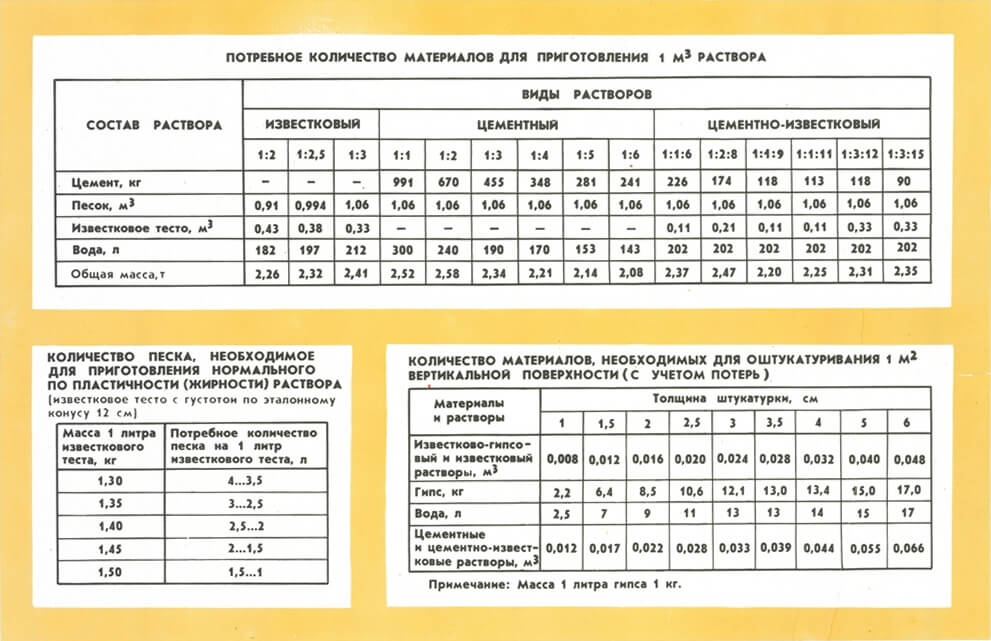 Поскольку в растворе присутствует меньше молей NaCl, NaCl является нашим ограничивающим реагентом. Теперь мы можем найти массу образовавшегося AgCl:
Поскольку в растворе присутствует меньше молей NaCl, NaCl является нашим ограничивающим реагентом. Теперь мы можем найти массу образовавшегося AgCl:
[латекс] \ text {123 мл NaCl} \ times \ frac {\ text {1 L}} {\ text {1000 мл}} \ times \ frac {\ text {1.00 моль NaCl}} {\ text {1 л}} \ times \ frac {\ text {1 моль AgCl}} {\ text {1 моль NaCl}} \ times \ frac {\ text {143 г}} {\ text {1 моль AgCl}} = \ text {17,6 г AgCl} [/ латекс]
Следовательно, в реакции образуется 17,6 г AgCl ( s ).
Подводя итог: мы пересчитали в моли каждого реагента, используя данные концентрации в качестве коэффициентов пересчета, выражая молярность как моль / л; как только мы нашли наш ограничивающий реагент, мы преобразовали его в граммы образовавшегося AgCl.
Глава 7 — Растворы — Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7. 3 Растворимость 7,4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7.9 Концентрации ионов в растворе 7.10 Внимание к окружающей среде: загрязнение свинцом 7.11 Резюме 7.12 Ссылки
3 Растворимость 7,4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7.9 Концентрации ионов в растворе 7.10 Внимание к окружающей среде: загрязнение свинцом 7.11 Резюме 7.12 Ссылки 7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого. Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах.В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах.В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.

Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом .Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью.Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие растворы, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси, с другой стороны, неоднородны и имеют участки смеси, которые выглядят иначе, чем другие участки смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси, с другой стороны, неоднородны и имеют участки смеси, которые выглядят иначе, чем другие участки смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы .
 Для количественной обработки такого типа растворов выделим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки такого типа растворов выделим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. - Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.
 Серебро, золото и медь образуют множество различных сплавов с уникальным цветом и внешним видом. Сплавы и другие твердые растворы важны в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальным цветом и внешним видом. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, растворимость которого не достигла максимальной, называется ненасыщенным раствором . Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Раствор, который достиг максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора.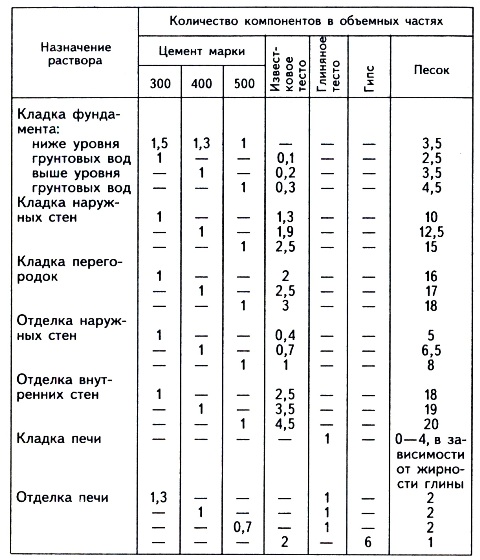 Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют наивысшую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 Более высокая разница электроотрицательности — это полярных соединений . Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.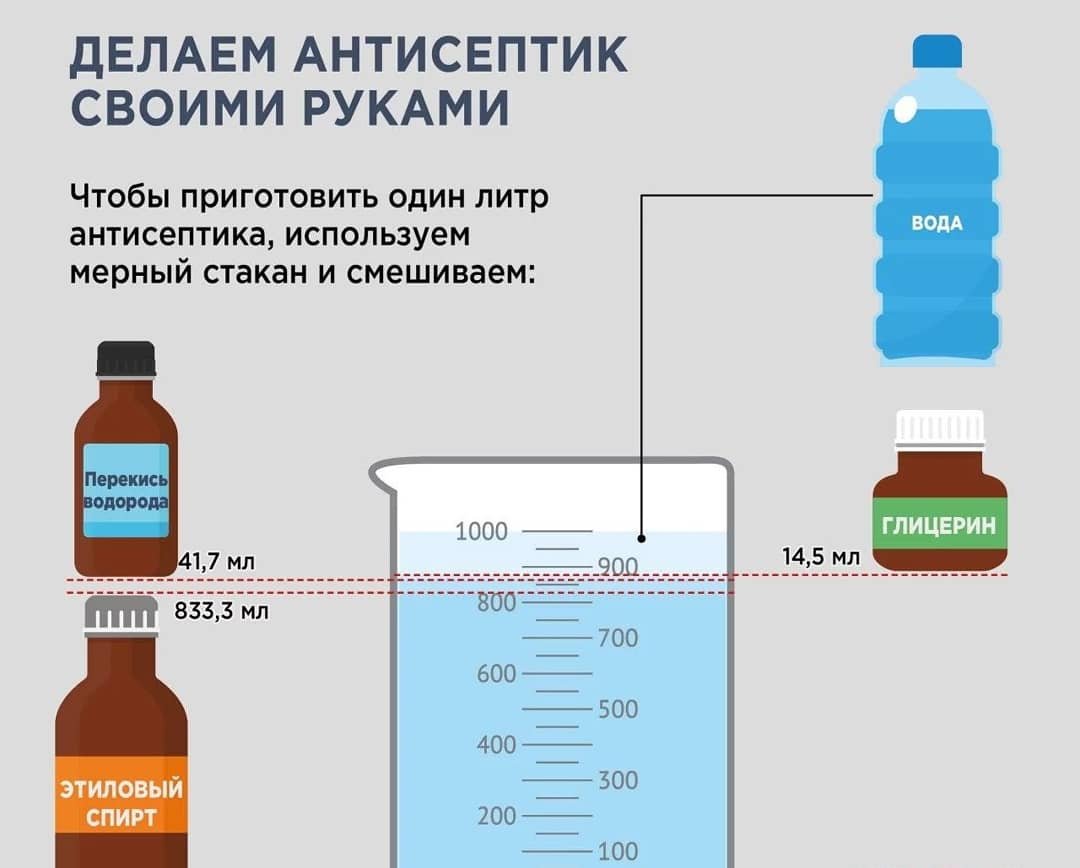
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида, когда он растворяется и взаимодействует с молекулами воды. Для ионных соединений, которые не растворимы в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разорваны частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
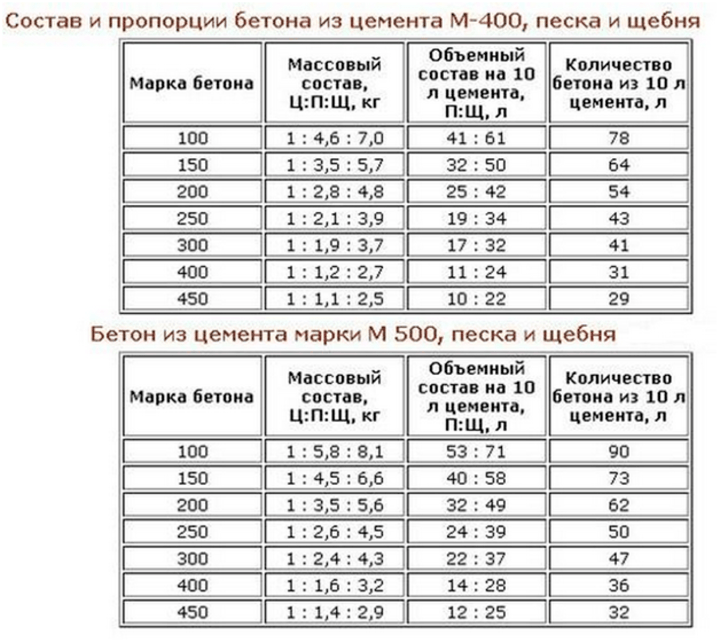 1 Правила растворимости
1 Правила растворимости Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют только частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Точно так же решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7,4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
На рис. 7.3 показаны графики зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; Величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси посредством фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на Рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Химики часто могут использовать эту информацию для разделения компонентов смеси посредством фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на Рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми на , чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4. Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», — нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.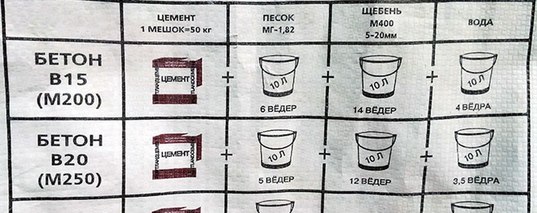 5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты подобными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты подобными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (водн.) → CO 2 2− (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.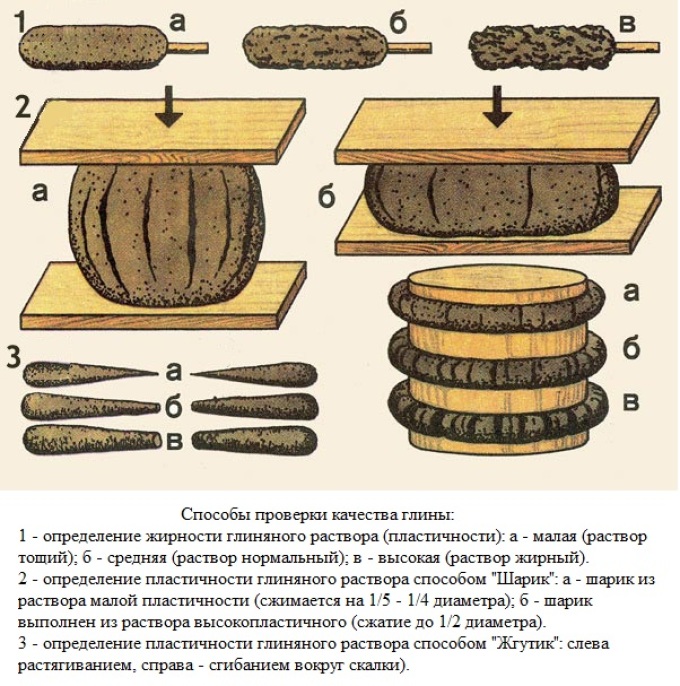 В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента котельной накипи.
В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента котельной накипи.
Рисунок 7.5 Вес котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах с горячей водой могут значительно снизить пропускную способность труб. Эти отложения, называемые котловыми отложениями, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В пункте тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотна, она имеет тенденцию плавать на поверхности более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы минимизировать любые неблагоприятные воздействия на температуру окружающих водоемов.На Тихоокеанском северо-западе популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды составляет от 12,8 до 17,8 o C (55-65 o F).
Поскольку теплая, обедненная кислородом вода менее плотна, она имеет тенденцию плавать на поверхности более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы минимизировать любые неблагоприятные воздействия на температуру окружающих водоемов.На Тихоокеанском северо-западе популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды составляет от 12,8 до 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Дополнительную информацию о влиянии повышения температуры на популяции лососевых можно найти в Focus Publication штата Вашингтон.
Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Дополнительную информацию о влиянии повышения температуры на популяции лососевых можно найти в Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого было глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего ареала, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтрующих организмов, что затем уменьшило пропускание света, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, который показывает влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как и скорость их растворения, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
(a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как и скорость их растворения, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — постоянная закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура. Хотя концентрация газа может быть выражена в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Хотя концентрация газа может быть выражена в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком малы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость. (Примечание: когда вещество парамагнитное , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
(Примечание: когда вещество парамагнитное , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Парциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих сферах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 — концентрация и соответственно парциальное давление газа в конечном состоянии. Например:
Например:
Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри. Например, HCl реагирует с водой с образованием H + (водн.) И Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Например, HCl реагирует с водой с образованием H + (водн.) И Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.Когда бутыль открыта, давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно подняться на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой больше N 2 из воздуха растворяется во внутренних жидкостях дайвера. Если дайвер всплывает слишком быстро, резкое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Если дайвер всплывает слишком быстро, резкое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Для увеличения концентрации O 2 во внутренних жидкостях организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и способствует его транспортировке из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Также сообщается, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Также сообщается, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который меняет цвет с синего на красный при гидратации и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности.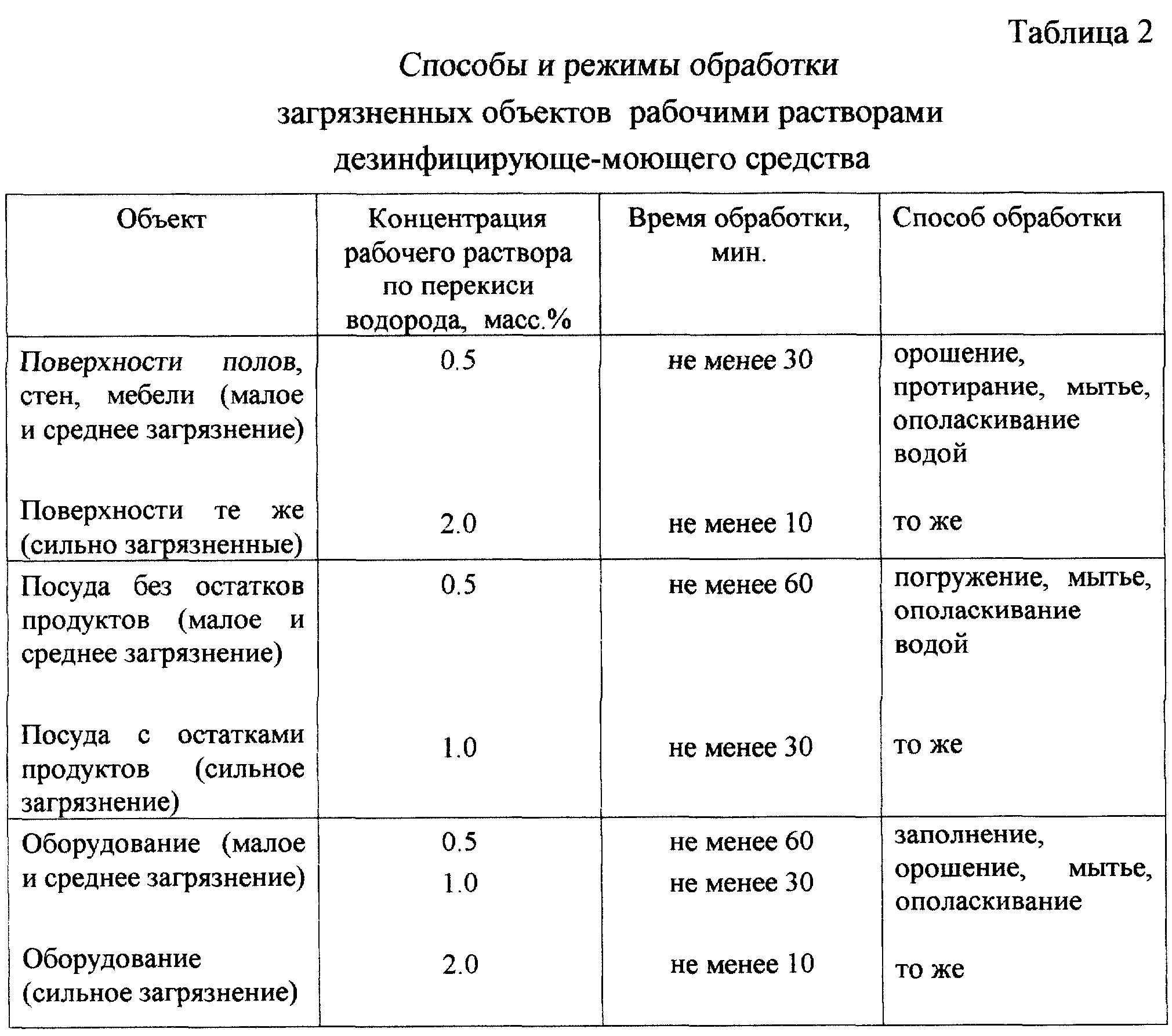 Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, тогда как частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, тогда как частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначения, используемые для обозначения твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Sesqui — 1½
- Di — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Hepta — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества считаются гигроскопичными и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое — разбавленный раствор, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность раствора (М) — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно M. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химической записи квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении расчета.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Дважды проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Поэтому никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.Для примера выше:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
Рисунок 7.8 иллюстрирует процедуру приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна 9000 моль / литр.
2. Чтобы рассчитать молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или и в том, и в другом (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор — это сумма как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:Например, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяется в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Аналогичные процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Здесь приведены массовые определения ppm и ppb:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей, как правило, очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторидов и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равен 1 экв. / Л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении, эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагировать или поставлять один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, поскольку альтернативный метод взвешивания небольших количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем.Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации. Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, поскольку альтернативный метод взвешивания небольших количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Требуется вычислить желаемое количество растворенного вещества в конечном объеме более разбавленного раствора, а затем вычислить объем основного раствора, который содержит это количество растворенного вещества. Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяется количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10. Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряется из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: Объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание: если требуется 333 мл основного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2−.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2− ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рисунок 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2− и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, такого как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 при растворении в воде образует три иона (2NH 4 + + 1Cr 2 O 7 2−), всего концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 может быть затем рассчитано путем деления 1,43 M на 4,29 M, что дает 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: Молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильнодействующий электролит или как неэлектролит.
B Если соединение является неэлектролитом, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Вспомните из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 — , поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 — , поэтому 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)7.10 Внимание к окружающей среде: загрязнение свинцом История использования свинца в США
В главе 5 вы познакомились с EPA и с тем, как параметры качества воздуха контролируются для определения уровней загрязнения.Один из шести основных параметров, за которым ведется мониторинг в соответствии с Законом о чистом воздухе, — это свинец. Свинец естественным образом встречается в земной коре в очень низких концентрациях, ~ 0,001%, и выглядит как сине-серый металл, мягкий и плотный. Он широко используется в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве материала для пайки труб и керамики, хрустального стекла и других известных коммерческих продуктов. Особенно часто свинец использовался в красках для наружных работ и в качестве добавки к бензину (рис.7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему является проблематичным и создает повышенный риск для здоровья населения.
Рис. 7.12 История использования свинца в красках и бензине на протяжении большей части 20 века. На графике показано раннее преобладание свинцовых красок, за которым последовал бум транспортировки, что привело к высокому использованию этилированного бензина.Спад после середины 1970-х годов был связан с контролем, введенным EPA для исключения этилированного бензина. Источник: Filippelli, et al (2005) используется с разрешения.
Национальные стандарты качества окружающего воздуха (NAAQS) для свинца устанавливаются на уровне 0,15 микрограмма на кубический метр Pb в общем количестве взвешенных частиц в среднем за 3 месяца. Как видно из рисунка 7.13, уровни свинца в атмосфере были очень высокими до середины 1990-х годов, после чего мы стали свидетелями резкого падения уровней свинца в атмосфере.Этот всплеск содержания свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано отрицательное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения выбросов, чтобы исключить использование свинца в бензине. Полный запрет на этилированный бензин вступил в силу в 1996 году.
Рис. 7.13 Уровни содержания свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха по участкам тренда, отображая средние 80%.Белая линия представляет собой среднее значение по всем сайтам трендов. Девяносто процентов участков имеют концентрации ниже верхней линии, в то время как десять процентов сайтов имеют концентрации ниже нижней линии. (B) Максимальный годовой максимум за 3 месяца содержания свинца в атмосфере, демонстрирующий снижение уровней загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA
Использование тетраэтилсвинца (TEL) было определено General Motors в качестве присадки к топливу, повышающей общее октановое число бензина.Это позволило значительно повысить компрессию двигателя, что привело к увеличению производительности автомобиля и большей экономии топлива.
TEL производится путем реакции хлорэтана с натрием — свинец сплав
4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb
Продукт регенерируется путем перегонки с водяным паром, в результате чего остается ил из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, который включает металлический натрий и превращает только 25% свинца в TEL. ТЕЛ — вязкая бесцветная жидкость. Поскольку TEL является нейтральным по заряду и содержит внешние углеродные группы, он является липофильным, (жиролюбивым) и растворимым в бензине.
При сжигании этилированного бензина выделяется не только диоксид углерода и вода, но и свинец
(CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb
Образующийся свинец также может окисляться во время горения с образованием оксида свинца (II)
2 Pb + O 2 → 2 PbO
Образование Pb и PbO внутри автомобильного двигателя быстро накапливается в избытке и вызывает серьезные повреждения двигателя.Таким образом, молекулы, улавливающие свинец, также должны были быть добавлены в бензин для реакции с продуктами свинца, образующимися при сгорании. Обычно для этого процесса использовались 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучий бромид свинца (II) и хлорид свинца (II), которые затем могут быть выброшены в атмосферу из двигателя.
Повышенные уровни свинца в атмосфере, вызванные использованием автомобилей, сильно коррелировали с повышенными уровнями свинца в крови среди населения.
7.14 Снижение среднего уровня свинца в крови у детей в США и общего количества свинца, использованного в год в бензине в 1974–1992 годах (адаптировано из U.S.EPA 1999).
Биологические эффекты свинца
Когда свинец попадает в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Проведенное в Цинциннати исследование показало, что воздействие свинца в детстве вызывает потерю серого вещества в мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (рис.15).
Рис. 7.15. Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, которые подвергались воздействию свинца в детстве, показывает уменьшенный объем, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Cecil, KM, et al.
Острое воздействие свинца может вызвать отравление свинцом и привести к боли в животе, запорам, головным болям, раздражительности, проблемам с памятью, неспособности иметь детей и покалыванию в руках и ногах.Это вызывает почти 10% умственной отсталости по неизвестной в противном случае причине и может привести к поведенческим проблемам. Некоторые эффекты постоянны. В тяжелых случаях могут наступить анемия, судороги, кома или смерть.
Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или потребительские товары. Дети подвергаются большему риску, поскольку они с большей вероятностью будут класть в рот предметы, например, содержащие свинцовую краску и поглощающие большую часть свинца. что они едят. Воздействие свинца на работе — частая причина отравления свинцом у взрослых людей определенных профессий, которым грозит особый риск.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг / дл (10 мкг / 100 г) и для детей на уровне 5 мкг / дл.
Интересная корреляция: преступность и уровни свинца в кровиРяд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем свинца в крови дошкольного возраста и последующим уровнем преступности, особенно насильственных преступлений, совершенных 20 лет спустя (Рисунок 7.16).
Рисунок 7.16. Соотношение уровней содержания свинца в крови дошкольников и тяжких преступлений, совершенных 23 года спустя.
В начале 1990-х годов убийства и насильственные преступления достигли рекордного уровня, которому не видно конца. Однако к концу 90-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого спада, включая увеличение количества заключенных и увеличение количества полицейских.Однако уровни свинца в крови демонстрируют очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, в том числе на хомяках и кошках, показали, что воздействие свинца увеличивает или усиливает агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные уровни тюремного заключения и контроля, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате употребления этилированного бензина объясняет, по крайней мере частично, рост уровня насильственных преступлений в 1980-х и начале 1990-х годов в Соединенных Штатах.
Текущие проблемы и опасенияНесмотря на то, что за последние 40-50 лет использование свинца резко сократилось, он все еще может быть обнаружен в повышенных количествах в почвах, особенно в городских и промышленных районах.Кроме того, свинец ранее использовался для строительства водопроводных труб, поскольку он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в стыках и соединениях которых использовалась свинцовая пайка. В апреле 2014 года это стало серьезной проблемой для жителей Флинта, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для обеспечения питьевой водой этого района.Экономия затрат оценивалась примерно в 10 миллионов долларов в год. Однако на строительство трубопровода уйдет несколько лет. Таким образом, чтобы сразу же сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт на время завершения строительства нового трубопровода. Однако с речной водой может быть труднее справиться из-за более сильных колебаний в количестве остатков стока, и почти сразу жители Флинта, штат Мичиган, начали жаловаться на неприятный запах, некрасивую воду, вытекающую из кранов (рис.7.17).
Рисунок 7.17. Ли-Энн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. al. (2017).
Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, из-за чего Флинт, штат Мичиган, выпустил рекомендации по кипячению и увеличил количество хлора, используемого для обработки воды. Это, в свою очередь, увеличивало производство тригалометанов. Тригалометаны образуются в результате реакции хлорсодержащих дезинфицирующих средств в воде с присутствующими органическими веществами, такими как те, которые образуются водорослями, присутствующими в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и привкус воды. Они также опасны при вдыхании, делая душ в горячей загрязненной воде серьезным риском для здоровья.
Таким образом, в попытке уменьшить образование побочных продуктов тригалогенметана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды.Однако они не смогли добавить никаких молекул, контролирующих коррозию, таких как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимого фосфата свинца, который не проникает в воду (рис. 7.18). Отсутствие контроля над коррозией со стороны города Флинт в сочетании с повышенным количеством FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl — . Результатом было общее увеличение потенциала коррозии, измеряемого по массовому соотношению хлорида и сульфата, от 0.45 для системы водоснабжения Детройта до 1,60 для нового водоснабжения реки Флинт. Имея такой потенциал коррозии, молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца выделялись также окисленные формы железа, вызывающие большее изменение цвета воды.
Рис. 7.18. Процесс коррозии во время водного кризиса во Флинте, штат Мичиган.
Чтобы увидеть интерактивную анимацию этого химического процесса, посмотрите этот
Видео журнала Scientific American — Коррозионная химия: как свинец попал в питьевую воду Флинта
Из-за протеста общественности и отказа города Флинта принимать меры в связи с плохим качеством воды компания Virgina Tech начала программу тестирования воды и обнаружила чрезвычайно высокие уровни свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно употреблять в пищу, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самый высокий образец, зарегистрированный Технологическим институтом штата Вирджиния, составил 13 000 частей на миллиард из образца в доме Ли-Энн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей, находящихся в этом районе, превышающий установленные CDC предельные уровни в крови, за это время увеличился вдвое (рис. 7.19). Несколько ожидающих рассмотрения судебных исков в настоящее время находятся в стадии рассмотрения из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе.
Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после переключения на источник воды реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, проверено выше пределов безопасности EPA для свинца после перехода на источник воды в реке Флинт. Нижняя панель показывает уровни свинца в крови у детей, которые регулярно проверяются на уровни свинца в крови в районе до и после перехода на новый источник воды. Источник: исследование Flint Water Study
.Предлагаемое задание: Учителя могут загрузить основанное на обсуждении задание на тему «Экологическая несправедливость и влияние токсичного загрязнения воды во Флинте, штат Мичиган,
».Flint Water Crisis Environmental Justice Assignment
7.11 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворимые вещества — это растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся, и несмешивающийся, вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей. Утверждение « как растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора.Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами , . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества. Такими решениями являются насыщенных . Растворы с количеством меньше максимального — ненасыщенные . Большинство растворов являются ненасыщенными, и существуют различные способы определения их концентрации. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда ионов. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются как молярность и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF является слабой кислотой, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, химический стакан №2 также является хорошим выбором для этой молекулы, поскольку только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что при диссоциации CaCl 2 он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —). для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) родинок Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием исходного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, гр. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1,08 М, h4PO4 = 0,816 М, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
7.12 Ссылки
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Мичиганская сеть по охране окружающей среды детей (2013 г.) Здоровье окружающей среды детей в Мичигане.Вики по гигиене окружающей среды. Проверено 9-6-2018 по адресу: http://wiki.mnceh.org/index.php/Neurotoxicity:_Lead .
- авторов Википедии. (2018, 5 сентября). Отравление свинцом. В Википедия, Бесплатная энциклопедия . Получено 2:05, 7 сентября 2018 г., с https://en.wikipedia.org/w/index.php?title=Lead_poisoning&oldid=858177302 .
- Ладапо, Дж. А., Мохаммед, А. К., и Нвосу, В. (2017) Загрязнение свинцом во Флинте, Мичиган, США, и других городах. Международный журнал экологического и научного образования, 11 (5): 1341-1351.Открытый доступ. Доступно по адресу: www.ijese.net/makale_indir/1899
Глава 7 — Растворы — Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7,4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7.6 твердых гидратов 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Резюме 7.11 Ссылки7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого.Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения.В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие растворы, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 Типы решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси, с другой стороны, неоднородны и имеют участки смеси, которые выглядят иначе, чем другие участки смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов выделим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов с уникальным цветом и внешним видом. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, растворимость которого не достигла максимальной, называется ненасыщенным раствором . Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Раствор, который достиг максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют наивысшую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 Более высокая разница электроотрицательности — это полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Like Dissolves Like.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида, когда он растворяется и взаимодействует с молекулами воды. Для ионных соединений, которые не растворимы в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разорваны частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют только частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Точно так же решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7,4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; Величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси посредством фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на Рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми на , чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4. Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», — нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты подобными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (водн.) → CO 2 2− (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента котельной накипи.
Рисунок 7.5 Вес котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах с горячей водой могут значительно снизить пропускную способность труб. Эти отложения, называемые котловыми отложениями, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В пункте тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотна, она имеет тенденцию плавать на поверхности более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы минимизировать любые неблагоприятные воздействия на температуру окружающих водоемов.На Тихоокеанском северо-западе популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды составляет от 12,8 до 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Дополнительную информацию о влиянии повышения температуры на популяции лососевых можно найти в Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого было глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего ареала, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтрующих организмов, что затем уменьшило пропускание света, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, который показывает влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как и скорость их растворения, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — постоянная закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрация газа может быть выражена в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком малы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитное , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих сферах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 — концентрация и соответственно парциальное давление газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют собой C 2 = ?? и P 2 = 5.0 атм. На этом этапе будет проще всего изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн.) И Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.Когда бутыль открыта, давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно подняться на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой больше N 2 из воздуха растворяется во внутренних жидкостях дайвера. Если дайвер всплывает слишком быстро, резкое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Для увеличения концентрации O 2 во внутренних жидкостях организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Также сообщается, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который меняет цвет с синего на красный при гидратации и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, тогда как частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначения, используемые для обозначения твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Sesqui — 1½
- Di — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Hepta — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества считаются гигроскопичными и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое — разбавленный раствор, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность раствора (М) — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно M. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химической записи квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении расчета.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Дважды проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Поэтому никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.Для примера выше:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
Рисунок 7.8 иллюстрирует процедуру приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна 9000 моль / литр.
2. Чтобы рассчитать молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или и в том, и в другом (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор — это сумма как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:Например, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяется в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Аналогичные процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Здесь приведены массовые определения ppm и ppb:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей, как правило, очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторидов и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равен 1 экв. / Л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении, эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагировать или поставлять один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, поскольку альтернативный метод взвешивания небольших количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяется количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10. Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряется из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: Объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание: если требуется 333 мл основного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2−.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2− ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рисунок 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2− и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, такого как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 при растворении в воде образует три иона (2NH 4 + + 1Cr 2 O 7 2−), всего концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 может быть затем рассчитано путем деления 1,43 M на 4,29 M, что дает 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: Молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильнодействующий электролит или как неэлектролит.
B Если соединение является неэлектролитом, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 — , поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 — , поэтому 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)7.10 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворимые вещества — это растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся, и несмешивающийся, вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей.Утверждение « как растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество.Такие растворы называются электролитами , . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества.Такими решениями являются насыщенных . Растворы с количеством меньше максимального — ненасыщенные . Большинство растворов являются ненасыщенными, и существуют различные способы определения их концентрации. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда ионов. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются как молярность и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF является слабой кислотой, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, химический стакан №2 также является хорошим выбором для этой молекулы, поскольку только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что при диссоциации CaCl 2 он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —). для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) родинок Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием исходного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, гр. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1,08 М, h4PO4 = 0,816 М, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
Список литературы
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д. У., Хилл, Дж. У., и Скотт Р.Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.



 На мешке можно обнаружить соответствующие обозначения;
На мешке можно обнаружить соответствующие обозначения;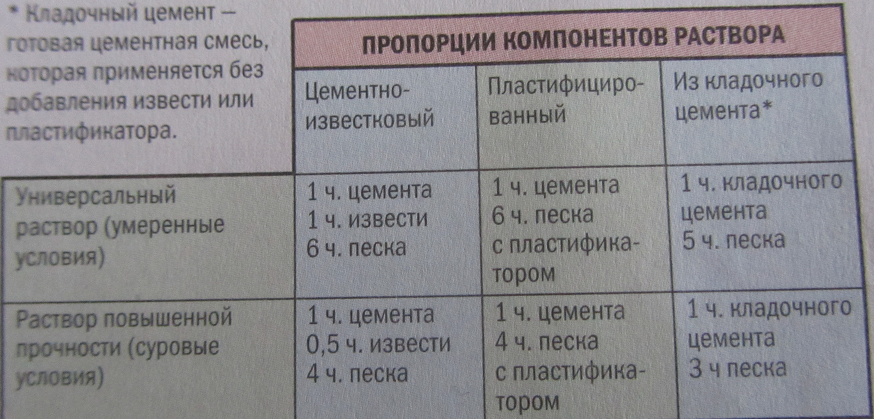 Для того чтобы убрать эти полосы, необходимо использовать влажную тряпку. Применять ее следует после остывания печи.
Для того чтобы убрать эти полосы, необходимо использовать влажную тряпку. Применять ее следует после остывания печи. Хотя с её укладкой на поверхность кирпича не возникает проблем, но после высыхания происходит ее растрескивание, и она не в состоянии держать кладку;
Хотя с её укладкой на поверхность кирпича не возникает проблем, но после высыхания происходит ее растрескивание, и она не в состоянии держать кладку; Однако использовать ее для кладки печи можно лишь тогда, если сооружение будет топиться дровами, а температура в ней в процессе эксплуатации будет превышать 1000 градусов.
Однако использовать ее для кладки печи можно лишь тогда, если сооружение будет топиться дровами, а температура в ней в процессе эксплуатации будет превышать 1000 градусов. Все зависит от качества глины.
Все зависит от качества глины. Полученный раствор следует хорошо перемешать;
Полученный раствор следует хорошо перемешать;
 При ведении кладки в условиях высоких температур лучше использовать смесь с повышенной подвижностью.
При ведении кладки в условиях высоких температур лучше использовать смесь с повышенной подвижностью. Это вяжущее содержит минеральные добавки в количестве до 5 %. По новому стандарту этот материал обозначается как ЦЕМ I 32,5. Прочность на сжатие – до 40 МПа. При решении вопроса о том, какая марка цемента нужна для кладки кирпича, для строительства небольших домов чаще всего приобретают портландцемент М400.
Это вяжущее содержит минеральные добавки в количестве до 5 %. По новому стандарту этот материал обозначается как ЦЕМ I 32,5. Прочность на сжатие – до 40 МПа. При решении вопроса о том, какая марка цемента нужна для кладки кирпича, для строительства небольших домов чаще всего приобретают портландцемент М400. Применение песка, загрязненного глинистыми, илистыми включениями, имеющего в составе пыль, приводит к значительному снижению качества кладочного раствора. В соответствии с нормативом максимальная крупность зерен составляет 2,5 мм.
Применение песка, загрязненного глинистыми, илистыми включениями, имеющего в составе пыль, приводит к значительному снижению качества кладочного раствора. В соответствии с нормативом максимальная крупность зерен составляет 2,5 мм.
 Востребован для ведения кирпичной кладки в малоэтажном строительстве, заделки трещин. Рекомендуется применение пластификаторов.
Востребован для ведения кирпичной кладки в малоэтажном строительстве, заделки трещин. Рекомендуется применение пластификаторов.
 Для этого периметр строения умножают на толщину и высоту стен. Далее вычисляют суммарную площадь оконных и дверных проемов, умножают ее на толщину стен. Из общего объема кладки вычитают суммарный объем оконных и дверных проемов.
Для этого периметр строения умножают на толщину и высоту стен. Далее вычисляют суммарную площадь оконных и дверных проемов, умножают ее на толщину стен. Из общего объема кладки вычитают суммарный объем оконных и дверных проемов. То есть, если мы разделим 4760 кг на 6,4, получим количество цемента – 743 кг. Простые расчеты показывают, что нам понадобится 15 мешков цемента по 50 кг каждый. Но, поскольку расчеты примерные, лучше приобрести материал с небольшим запасом. Далее вычисляем необходимое количество песка, которого в нашем случае содержится 5,4 части. Если одна часть составляет 743 кг, то всего нам понадобится 743*5,4 = 4012 кг песка.
То есть, если мы разделим 4760 кг на 6,4, получим количество цемента – 743 кг. Простые расчеты показывают, что нам понадобится 15 мешков цемента по 50 кг каждый. Но, поскольку расчеты примерные, лучше приобрести материал с небольшим запасом. Далее вычисляем необходимое количество песка, которого в нашем случае содержится 5,4 части. Если одна часть составляет 743 кг, то всего нам понадобится 743*5,4 = 4012 кг песка.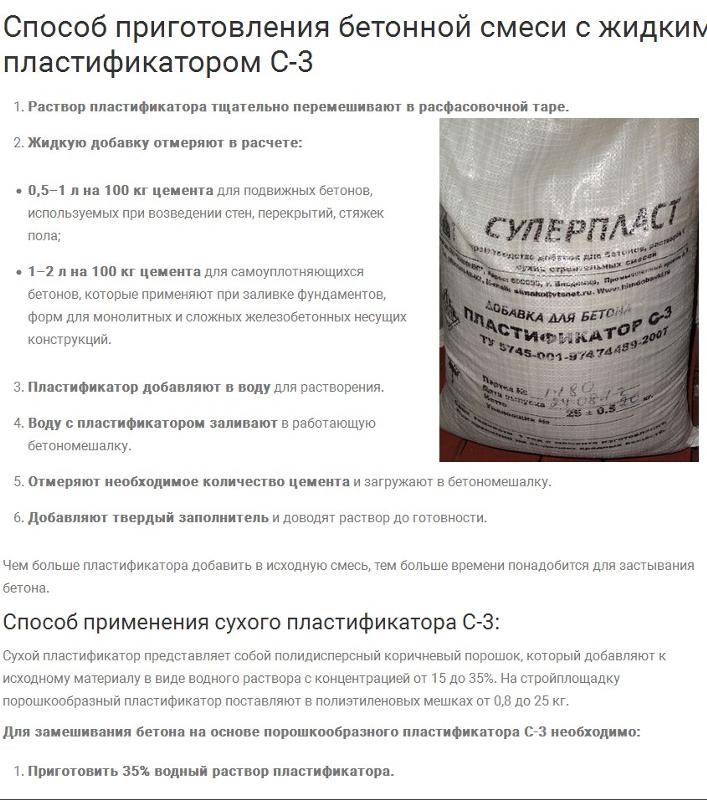

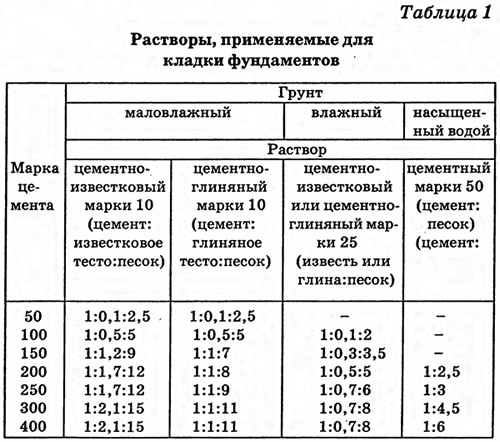
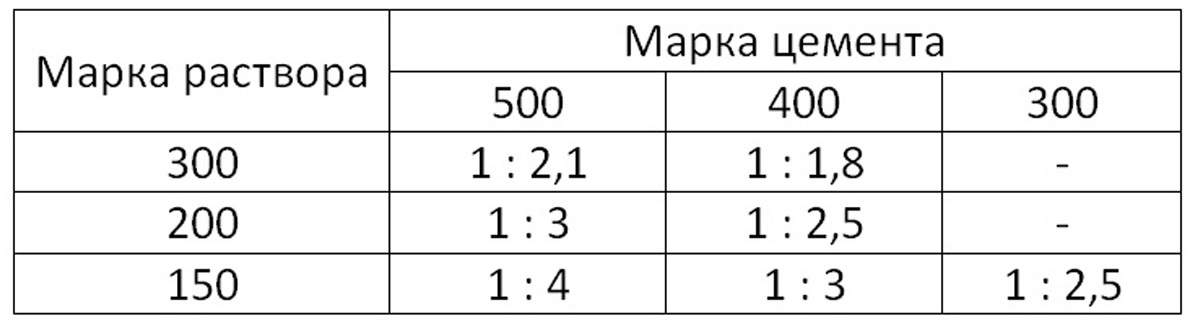 Следующим этапом можно заливать отмостку.
Следующим этапом можно заливать отмостку.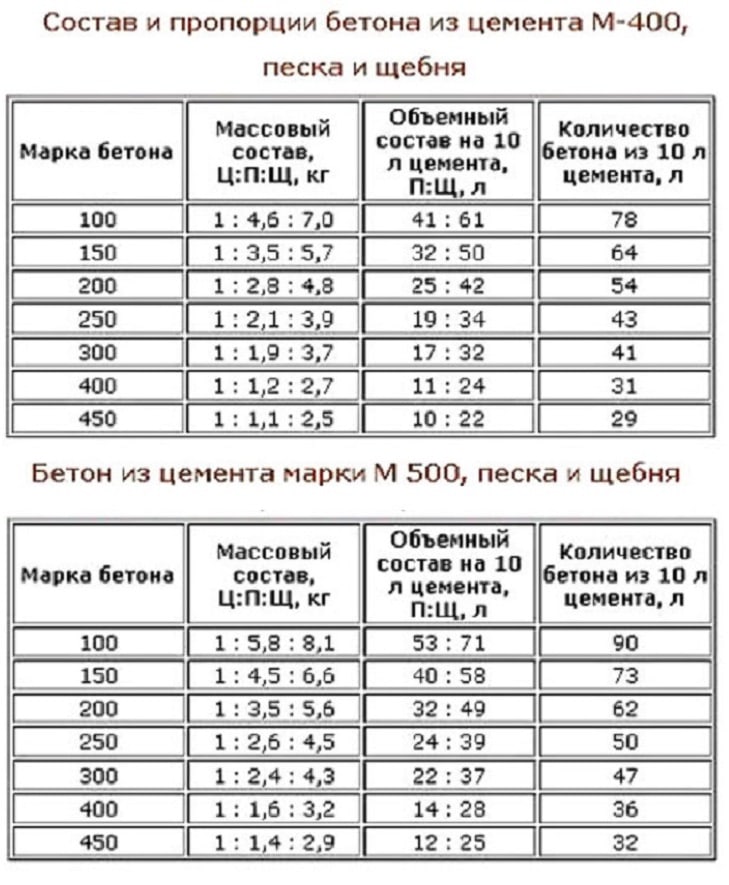 Только они смогут выбрать качественный долговечный материал.
Только они смогут выбрать качественный долговечный материал. Нью-Джерси: Прентис-Холл, 1999.
Нью-Джерси: Прентис-Холл, 1999. 0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
 4 м
4 м
 Моли продукта равны молям ограничивающего реагента в однозначной стехиометрии реакции. Чтобы найти массу продукта, нужно умножить количество молей на молекулярную массу продукта.
Моли продукта равны молям ограничивающего реагента в однозначной стехиометрии реакции. Чтобы найти массу продукта, нужно умножить количество молей на молекулярную массу продукта.
 Для количественной обработки такого типа растворов выделим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки такого типа растворов выделим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. Серебро, золото и медь образуют множество различных сплавов с уникальным цветом и внешним видом. Сплавы и другие твердые растворы важны в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальным цветом и внешним видом. Сплавы и другие твердые растворы важны в мире химии материалов.