Как сделать раствор для: как развести и сколько песка и цемента в 1 м3, соотношение частей и расход
Пропорции раствора для тротуарной плитки
Как сделать раствор для тротуарной плитки – этот вопрос может возникнуть в процессе ремонта частного дома, точнее ландшафтного оформления двора. В итоге смешивания определенных компонентов получается смесь бетона, которую можно легко приготовить самостоятельно. Однако при этом необходимо четко следовать всем указаниям и соблюдать правила. В процессе смешивания раствора необходимые условия – чистота, а также поддержание нужной влажности и температурного режима.
Если вы приготовите кашицу своими руками, это даст вам возможность провести некий эксперимент с цветами, а также с внешним видом плитки в плане формы. При этом форма для будущих элементов может быть также сделана своими руками. Используются самые разные геометрические фигуры.
Чаще всего:
- квадрат
- прямоугольник (в том числе с узорными краями)
- овал
- ромб
Чтобы реализовать замысел создания раствора, смеси под плитку, нужно взять смесь из полиуретана и форму, например, плитку или гипс.
И все же пока рано приступать к подготовке самого раствора. Перед этим подготавливается вибростол, у которого должна быть четко ровная поверхность.
Приспособление изготавливают из разных материалов – это может быть деревянная основа, силиконовая, пенопласт, полиуретан и другие материалы. Кроме того, понадобится масляное вещество, которым нужно будет смазать формы. В качестве смазки можно использовать подсолнечное или пальмовое масла, а также подойдут даже старые моторные масла, которые уже отработали и не пригодятся автовладельцу.
Как приготовить раствор для тротуарной плитки
Состав раствора включает в себя несколько компонентов – это и материалы для получения бетона, и жидкие вещества. Итак, приготовление раствора для плитки происходит за счет размешивания в одной таре:
- цемента (чаще всего специалисты советуют использовать материал белого цвета)
- дистиллированной воды
- мелкофракционного речного песка (он должен быть просеян)
- пластификатора, который придает пластичность материалу
- гранитного щебня (фракция должна быть три-пять миллиметров)
- жидкого пигмента
- диспергатора, который делает смесь морозоустойчивой
Последний компонент (это относится и к пигментам) можно добавлять при желании, это не является обязательным условием.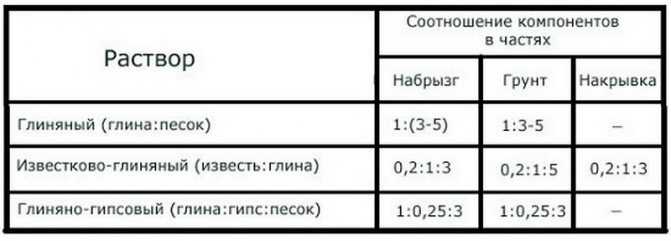
Приготовить плиточный раствор: пропорции
Очень важно соблюсти верные пропорции – только в этом случае получится качественный раствор для плитки. Итак, в состав бетона для тротуарной плитки должны войти материалы в следующем процентном соотношении:
- цемента – 23
- щебня – 57
- песка – 20
- воды – 40 (имеется в виду от количества сухих компонентов)
- пигмента (700 мл)
- пластификатора – 0,5 (имеется в виду от количества цемента)
- диспергатора (90 г)
Когда готовится раствор для тротуарной плитки, пропорции сухих компонентов нужно ввести особым способом. Воду мы считаем от количества этих компонентов, а пластификатор рассчитываем, соотнеся его с объемами цемента. Диспергаторы и пигменты добавляем, растворяя вещества водой. Чтобы сделать один квадратный метр готового изделия, необходимо затратить приблизительно порядка 20 кг цемента, примерно столько же песка, В результате получится изделие толщиной 4-5 см.
В результате получится изделие толщиной 4-5 см.
Изготовление растворов под плитку тротуарную: порядок действий
В самом начале необходимо очень хорошо перемешивать песок, цемент и пластификатор. Затем идет добавление щебня, а жидкость доливают уже в самом конце, причем мелкими дозами. Если пропорции были соблюдены верно, раствор получится довольно плотный и будет хорошо держаться на инструменте. Он не должен разливаться или крошиться. Если же состав раствора для тротуарной плитки был неверным, или мастер нарушил технологию его изготовления, масса может начать растекаться. Если мы получаем слишком твердый раствор для тротуарной плитки, пропорции также были не соблюдены.
Самый надежный способ – замешивать раствор с помощью бетономешалки. Еще одним методом может быть использование строительного миксера. Это профессиональные способы, но если таких возможностей нет, можно обойтись и подручными средствами, например, подойдет обычный мастерок. Просто такой способ изготовления растворов под уличную плитку потребует больше сил и времени.
Если же вы решили, что не хотите самостоятельно заниматься приготовлением состава для тротуарной плитки, можно обратиться к профессионалам.
Заливка бетона в специальные формы
Перед тем как придать подготовленному составу конечную форму, надо дать смеси настояться.
Далее необходимо следовать алгоритму:
- разложить формы на столе (вибростол)
- смазать изделия маслянистой жидкостью, используя кисточку или губку
- убрать лишнее масло салфеткой
- залить раствор для тротуарной плитки (пропорции в данном случае определяются формой, масса заливается ровными слоями)
Необходимо знать некоторые секреты заливки. Если нужно, чтобы получился насыщенный цвет, лучше заливать в несколько слоев. Если необходимо получить эффект мрамора, нужно заливать один за другим два цвета.
После заполнения форм нужно их простучать (провибрировать) в течение нескольких минут, затем осуществить выравнивание на поверхности, накрыть пленкой и дать бетону, раствору засохнуть.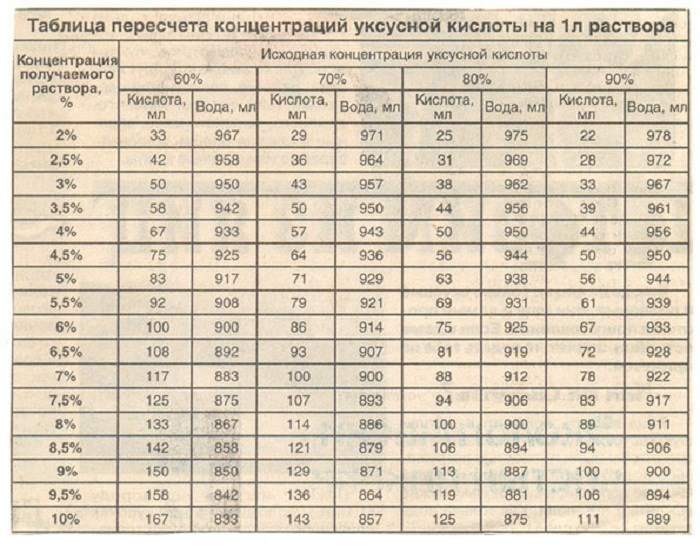 Чаще всего высыхание бетона занимает один-два дня. При этом очень важно соблюдать определенную температуру. Профессионалы говорят, что температурный режим должен составлять
Чаще всего высыхание бетона занимает один-два дня. При этом очень важно соблюдать определенную температуру. Профессионалы говорят, что температурный режим должен составлять
Проблемы при изготовлении тротуарной плитки
Если пропорции были соблюдены не до конца, могут возникнуть самые разные проблемы.
Среди них:
- краска может сбиться (в этом случае может исчезнуть эффект мрамора). Это происходит, когда постукивание проводили слишком долго
- тротуарную плитку трудно разъединить с формой. Такая проблема может возникнуть из-за того, что мастер использовал недостаточно смазочного материала
- образуются пузыри и пустоты. Значит, изделие плохо простучали и в бетоне задержались воздушные пузыри. Также проблема могла возникнуть из-за того, что мастер слишком много использовал смазки
- материал ломается. Чаще всего такая проблема возникает по причине того, что было использовано недостаточно много воды или сырье было не совсем качественным
Итак, как приготовить раствор для тротуарной плитки?
Должны применяться определенные способы работы с бетоном – тогда тротуарная плитка получится крепкой, качественной. Ее можно будет использовать в любых местах – выложить красивую дорожку, украсить детскую площадку или приусадебный участок. Возможно, для кого-то попытка создать домашнюю плитку станет способом начать собственный бизнес.
Ее можно будет использовать в любых местах – выложить красивую дорожку, украсить детскую площадку или приусадебный участок. Возможно, для кого-то попытка создать домашнюю плитку станет способом начать собственный бизнес.
Задание Анастасии «Мастер по ремонту квартир»
от 4 000 ₽
Спасибо Олегу за отлично выполненную работу, прошло около недели после завершения, все отлично держится, ни малейших нареканий. Олег самостоятельно закупил черновые материалы, что существенно ускорили работы, за это отдельный респект. Разумный срок, высокое качество, цена средняя или чуть выше среднего, но стоит того. Отличный мастер.
Исполнитель задания:
Олег
4,9 211 отзывов
Создать такое же задание
Как сделать раствор для штукатурки стен своими руками. Приготовление штукатурного раствора для стен
Октябрь 15 • Стройматериалы • Просмотров 895 • Комментариев к записи Как сделать раствор для штукатурки стен своими руками нет
При строительстве любого здания особое внимание следует уделить штукатурке.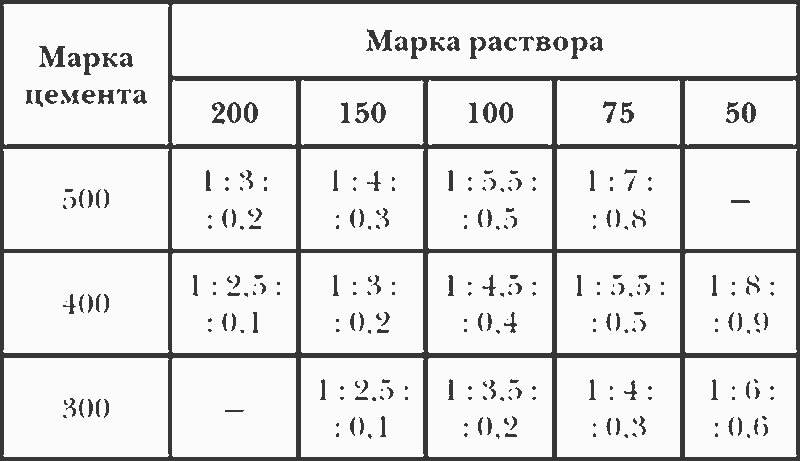 Благодаря нанесению этого слоя стены получают хорошую защиту от влаги. При этом поверхность штукатурки за счет своей пористости отлично пропускает воздух, благодаря чему стены «дышат». Это препятствует появлению грибка и плесени на их поверхности. К тому же слой штукатурки отлично влияет на теплоизолирующие качества стены, благодаря чему заметно снижаются потери тепла. Обработанную штукатуркой стену можно отделывать любыми материалами: обоями, финишной шпаклевкой «под покраску» и др.
Благодаря нанесению этого слоя стены получают хорошую защиту от влаги. При этом поверхность штукатурки за счет своей пористости отлично пропускает воздух, благодаря чему стены «дышат». Это препятствует появлению грибка и плесени на их поверхности. К тому же слой штукатурки отлично влияет на теплоизолирующие качества стены, благодаря чему заметно снижаются потери тепла. Обработанную штукатуркой стену можно отделывать любыми материалами: обоями, финишной шпаклевкой «под покраску» и др.
Содержание
- Из чего состоит штукатурка
- Свойства некоторых растворов для штукатурных работ
- Как сделать раствор для штукатурки стен. Правила приготовления штукатурного раствора
- Штукатурка наружных стен цементным раствором своими руками: фото
- Штукатурка стен цементно-песчаным раствором своими руками: видео
В настоящее время предложение готовых смесей для штукатурки поверхностей просто огромно. Стоимость одного мешка штукатурки сейчас уже не столь высока, как несколько лет назад. Однако, учитывая, сколько мешков не совсем дешевого материала может уйти на одну комнату, задача уже не кажется такой простой. Для удешевления ремонтных работ можно приготовить штукатурку самостоятельно. Процесс этот не слишком сложный, но может существенно сэкономить средства, за счет невысокой стоимости ингредиентов. О том, как приготовить раствор для штукатурки стен своими руками – далее в статье.
Однако, учитывая, сколько мешков не совсем дешевого материала может уйти на одну комнату, задача уже не кажется такой простой. Для удешевления ремонтных работ можно приготовить штукатурку самостоятельно. Процесс этот не слишком сложный, но может существенно сэкономить средства, за счет невысокой стоимости ингредиентов. О том, как приготовить раствор для штукатурки стен своими руками – далее в статье.
Из чего состоит штукатурка
Для того чтобы качественно приготовить штукатурку для отделки стен, необходимо знать из каких основных частей она состоит, и какие вещества для этого применяются.
В основе смеси каждой смеси для штукатурки стен лежат два компонента:
- Вяжущее вещество. Этот компонент отвечает за затвердевание раствора при его высыхании.
- Наполнитель. Он не только увеличивает объем смеси, но и препятствует ее чрезмерному пересыханию. Без него штукатурка будет непрочной, быстро растрескается и разрушится.
Правильно подобранные компоненты штукатурки и их пропорции в зависимости от условий ее использования станут залогом успеха всего предприятия.
В качестве наполнителя для приготовления штукатурки чаще всего используют песок. Наиболее качественным для строительных работ считается речной песок. Карьерный песок довольно часто имеет примеси глины, что негативно сказывается на его свойствах, а в морском — большое содержание солей. При добавлении песка в раствор, его необходимо просеять, чтобы штукатурка не содержала больших кусков. В противном случае они будут тянуться за шпателем, оставляя борозды. Размер ячейки сетки для просеивания песка должен быть 3-4 мм.
Если с наполнителем все более или менее понятно, то в качестве вяжущего вещества может применяться несколько различных компонентов. Их использование зависит от того, для каких целей будет применяться раствор. В качестве вяжущих веществ используют:
- Гипс. Этот материал обычно применяется как добавка в известковый раствор штукатурки, которая улучшает его свойства. Благодаря гипсу раствор начинает схватываться намного быстрее, а через 30-40 минут полностью затвердевает.
 При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде. - Цемент. Этот материал является самым крепким среди вяжущих веществ для штукатурки. Твердость цемента обозначается цифрами. Чем выше число на упаковке, тем выше твердость. Для приготовления штукатурки в основном применяется цемент марки 400, так как большой твердости для этой работы не требуется. Цемент, в отличие от гипса, застывает несколько дольше. Полностью раствор на основе этого материала набирает прочность через 28 дней.
- Глина. В основном штукатурка на основе глины применяется для внутренних работ. Благодаря особым качествам глины, растворы на ее основе обладают отличной термоизоляцией. Зимой в домах, стены которых оштукатурены глиной, всегда тепло, а летом прохладно.
- Известь. Это наиболее часто используемый материал для приготовления штукатурных растворов. От степени готовности известь делится на:
- гашеную;
- негашеную.

Вторая для приготовления штукатурки, ровно, как и для других строительных работ, не применяется. Перед использованием известь необходимо погасить. Негашеная известь при приготовлении раствора, в который обязательно входит вода, вступает с последней в бурную реакцию, что может стать причиной разрушения штукатурки.
Негашеная известь различается по своему химическому составу, и, соответственно, имеют свою скорость гашения:
- Быстрогасящаяся известь имеет скорость реакции около 10 минут. Ее засыпают в емкость с водой и тщательно перемешивают. После появления пара добавляют еще воду и опять перемешивают.
- Среднегасящаяся известь гасится примерно 25 минут. Засыпается известь в количестве примерно 25% объема емкости, затем до половины заливается вода. Как только появится пар, необходимо долить еще воды.
- Медленногасящаяся. Такая известь не заливается, а лишь слегка смачивается водой. Скорость гашения такого материала превышает 30 минут.
Готовить (гасить) известь для известкового раствора штукатурки своими руками не слишком сложно. Для приготовления самого раствора используется не известь, а известковое молочко. После того, как материал залит водой, его куски постепенно начинают разрушаться, а температура извести начинает расти. Затем на поверхности раствора появится корка. После этого в него добавляют воду и тщательно перемешивают. В результате таких действий твердые частицы осядут на дно, оставив на поверхности только известковое молочко. Последнее процеживается через специальное сито и сливается в специальную яму. Через 24 часа в яму добавляют просеянный песок и землю. Общая толщина слоя добавок должна составлять 50 см.
Для приготовления самого раствора используется не известь, а известковое молочко. После того, как материал залит водой, его куски постепенно начинают разрушаться, а температура извести начинает расти. Затем на поверхности раствора появится корка. После этого в него добавляют воду и тщательно перемешивают. В результате таких действий твердые частицы осядут на дно, оставив на поверхности только известковое молочко. Последнее процеживается через специальное сито и сливается в специальную яму. Через 24 часа в яму добавляют просеянный песок и землю. Общая толщина слоя добавок должна составлять 50 см.
Весь раствор выдерживается в яме около двадцати суток, после чего достается из ямы непосредственно перед приготовлением известкового раствора. За это время известковое молочко значительно загустевает и получает консистенцию густой сметаны. При этом известь гасится окончательно.
Свойства некоторых растворов для штукатурных работ
Чтобы приготовить годный для той или иной работы штукатурный раствор, необходимо знать свойства каждого из них.
Растворы на основе гашеной извести:
- Известковый раствор для штукатурки стен своими руками готовится на основе известкового теста и песка. Пропорции материалов в растворе: 1 часть теста на 3 части песка. Для лучшего перемешивания в емкость для приготовления раствора штукатурки добавляется вода. После окончания перемешивания готовая для применения штукатурка должна иметь консистенцию густого теста. Применяется, как правило, для внутренних работ. Не обладает особой прочностью.
- Чтобы известковый раствор стал прочнее, в него добавляют цемент в пропорции до 10% от общего объема. Такая смесь имеет название цементно-известковый раствор. Отличительной особенностью данных штукатурок является большое время застывания, что позволяет работать с ними довольно долго.
- Раствор с добавлением гипса. В первый вариант штукатурки добавляют гипс по пропорции: 1 часть гипса на 5 частей известкового раствора (песок + известковое тесто). В отличие от штукатурки с добавлением цемента, сохнет гипсовый раствор очень быстро, что доставляет определенные неудобства начинающим мастерам.
 Однако, этот факт определяет его пластичность и прочность.
Однако, этот факт определяет его пластичность и прочность. - Глиняная смесь. Такая штукатурка готовится на основе известкового и глиняного теста в пропорции 1:1. Отличается особой прочностью. За счет экологичности и отличных теплосберегающих свойств глины прекрасно подходит для внутренних работ.
Растворы строительные штукатурные на основе глины. Полностью глиняная штукатурка отличается особой технологией приготовления. Глину обильно смачивают водой и накрывают плотной тканью. После того, как она разбухнет, в нее добавляют три части наполнителя. Чаще всего в качестве последнего используют опилки или солому. К достоинствам такого раствора можно отнести экологичность, низкую себестоимость и отличные теплоизоляционные качества. Однако, прочность такого раствора оставляет желать лучшего.
Для увеличения прочности глины в штукатурку на ее основе добавляют цемент (примерно 10% от общего объема раствора).
Также часто при внутренней отделке помещений используют гипсово-глиняный раствор. Готовится он таким же образом, как и известковый раствор с добавлением гипса.
Готовится он таким же образом, как и известковый раствор с добавлением гипса.
Цементные растворы:
- Цементно-песчаный раствор для штукатурки стен своими руками готовится в пропорции 1:3 или 1:4. Выбирается она в зависимости от условий нанесения и эксплуатации штукатурки. Чем жестче условия – тем больше цемента.
- Цементно-известковый раствор готовится на основе 2 частей цементов марки М-400 или М-500 с добавлением 1 части известкового теста и 2 частей просеянного песка. Цемент придает любому раствору прочности и гидроизоляционные качества. Именно поэтому его часто применяют для наружных работ.
Существует два способа приготовления цементно-известкового раствора. При первом песок смешивается с известковым тестом, после чего в раствор добавляется цемент и вода до достижения нужной консистенции. При втором – цемент перемешивается с песком, далее в полученную однородную массу добавляется известковое молочко до приобретения раствором необходимой консистенции.
Штукатурка стен цементным раствором своими руками – наиболее часто встречающийся вид внешней отделки зданий.
Как сделать раствор для штукатурки стен. Правила приготовления штукатурного раствора
- При приготовлении любого раствора необходимо использовать материалы без примесей в четко указанных пропорциях. Сам раствор должен быть однородным, иметь среднюю жирность, нормально фиксироваться на поверхности, и не растрескиваться при высыхании. Слишком жирные растворы (те, у которых большое содержание вяжущего компонента) при высыхании могут растрескиваться. При замешивании такой жирный раствор слишком прилипает к лопатке смесителя. В таких случаях в него необходимо добавить заполнитель.
- Если готовый раствор совсем не прилипает к смесителю, он называется «тощий». В таком случае обязательной является добавка вяжущего вещества.
Штукатурка наружных стен цементным раствором своими руками: фото
Штукатурка стен цементно-песчаным раствором своими руками: видео
youtube.com/embed/zyPAxFxLL2A» frameborder=»0″ type=»text/html»/>« Пропитка для дерева: как покрыть морилкой деревянную поверхность своими руками Ремонт, циклевка и шлифовка паркета своими руками »
Химические вещества, молярные и массовые проценты
Растворы представляют собой гомогенные (равномерно распределенные) смеси двух или более химических веществ. Растворы могут существовать в виде твердых тел, жидкостей или газов.
Все растворы содержат растворитель и одно или несколько растворенных веществ. Растворитель, часто вода, является наиболее распространенным химическим веществом. Растворенное вещество — это химическое вещество (я), которое менее распространено.
Приготовление растворов
Как растворять твердые вещества и уменьшать масштабы экспериментов
Для проведения экспериментов вам часто потребуется растворять растворенные вещества в твердой форме, чтобы получить растворы определенной концентрации (сила измеряется диссоциацией ионов). Запланируйте один час на каждые 2-4 решения, которые вам нужно подготовить. Вам понадобятся весы для взвешивания растворенного вещества и мерный цилиндр для измерения растворителя (если это вода).
Запланируйте один час на каждые 2-4 решения, которые вам нужно подготовить. Вам понадобятся весы для взвешивания растворенного вещества и мерный цилиндр для измерения растворителя (если это вода).
Во-первых, определите концентрацию (весовой процент или молярность, см. ниже) и количество (миллилитров) раствора, который вам нужен, из вашей лабораторной процедуры. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из приведенных ниже формул. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, мерным цилиндром измерьте необходимый объем воды в миллилитрах и добавьте его в химический стакан. Перемешивайте раствор, пока все химикаты не растворятся.
Разбейте твердые комки химиката с помощью ступки и пестика или осторожно раздавите молотком в пластиковом пакете. Химические вещества растворяются быстрее при осторожном нагревании раствора и перемешивании.
Если для экспериментов требуется большое количество химикатов, можно уменьшить масштаб. Уменьшение масштаба снижает угрозы безопасности, затраты на химикаты и утилизацию отходов.
Уменьшение масштаба снижает угрозы безопасности, затраты на химикаты и утилизацию отходов.
Большинство экспериментов можно сократить, разделив растворенное вещество и растворитель на коэффициент по вашему выбору. Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы в нем использовалось только 5 г растворителя и 25 мл воды. Вы можете упростить масштабирование, используя стаканы меньшего размера, пробирки и другое измерительное оборудование.
При приготовлении химических растворов всегда используйте соответствующее защитное оборудование.
Как приготовить молярные растворы
Молярные (М) растворы основаны на количестве молей химического вещества в одном литре раствора. Моль состоит из 6,02×10 23 молекул или атомов. Молекулярная масса (MW) — это масса одного моля химического вещества. Определите молекулярную массу с помощью таблицы Менделеева, добавив атомную массу каждого атома в химическую формулу.
Пример: для молекулярной массы CaCl 2 , добавьте атомную массу Ca (40,01) к массе двух Cl (2 x 35,45), чтобы получить 110,91 г/моль. Следовательно, 1М раствор CaCl 2 состоит из 110,91 г CaCl 2 , растворенных в достаточном количестве воды, чтобы получился один литр раствора.
Когда молекулярная масса растворенного вещества известна, вес химического вещества, растворяемого в растворе, для молярного раствора менее 1 М рассчитывается по формуле:
- грамма химического вещества = (молярность раствора в молях/литр) x (молекулярная масса химиката в г/моль) x (мл раствора) ÷ 1000 мл/литр
Например, чтобы получить 100 мл 0,1 М раствора CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам потребуется:
- грамма CaCl 2 = (0,1) x (110,91) ) х (100) ÷ (1000) = 1,11 г
Теперь можно приготовить раствор: растворите 1,11 г CaCl 2 в воде, достаточном для приготовления 100 мл раствора. Необходимое количество воды будет чуть меньше 100 мл.
Необходимое количество воды будет чуть меньше 100 мл.
Весы и мерная колба используются для приготовления молярных растворов. Процедура приготовления молярного раствора в мерной колбе вместимостью 100 мл следующая:
- Рассчитайте массу растворенного вещества, необходимого для приготовления 100 мл раствора, используя приведенную выше формулу.
- Взвесьте необходимое количество растворенного вещества с помощью весов.
- Перенесите растворенное вещество в чистую сухую мерную колбу на 100 мл.
- Медленно добавьте дистиллированную воду в мерную колбу. При этом вымойте все растворенное вещество на дно колбы. Продолжайте добавлять воду, пока не достигнете отметки 100 мл на горлышке колбы.
- Поместите пробку в колбу и осторожно вращайте колбу, пока все растворенное вещество не растворится.
Если у вас нет мерной колбы, вместо нее можно использовать мерный цилиндр на 100 мл. Просто добавьте растворенное вещество в градуированный цилиндр, а затем добавьте дистиллированную воду, пока не достигнете отметки 100 мл на стенке цилиндра.
Как приготовить весовые проценты (вес.%) растворов
В весовых процентах растворов вес растворенного вещества делится на вес раствора (растворенное вещество + вода) и умножается на 100. Поскольку плотность воды равна 1 г/мл, формула для расчета количества растворенного вещества, которое необходимо смешать для получения раствора в процентах по массе:
- г растворенного вещества = (масс.% раствора) x (мл воды) ÷ (100 – масс.% раствора)
Например, чтобы приготовить 100 мл 10% раствора NaCl (поваренной соли), используйте предыдущую формулу, чтобы узнать, сколько NaCl вам нужно:
- грамма NaCl = (10) x (100) ÷ (100 – 10) = 11,1 г
Теперь можно приготовить раствор: растворите 11,1 г NaCl в 100 мл воды.
Создайте собственное решение для следующих проектов:
Frozen Bubbles
Rainbow Reaction
Биологический тест на токсичность
Гальваническое покрытие: ключ с медным покрытием
Глава 12.
 1: Подготовка растворов – Химия LibreTexts
1: Подготовка растворов – Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.
В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0003
В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0003
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на 90 146 меньше, чем желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (М)
Стратегия:
Чтобы найти количество молей CoCl 3 OCl 2 9 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12. 1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \право) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9. 0003
0003
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок 12.1.3 Приготовление раствора известной концентрации путем разбавления исходного раствора0033 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в указанном объеме умножение объема раствора на его молярность.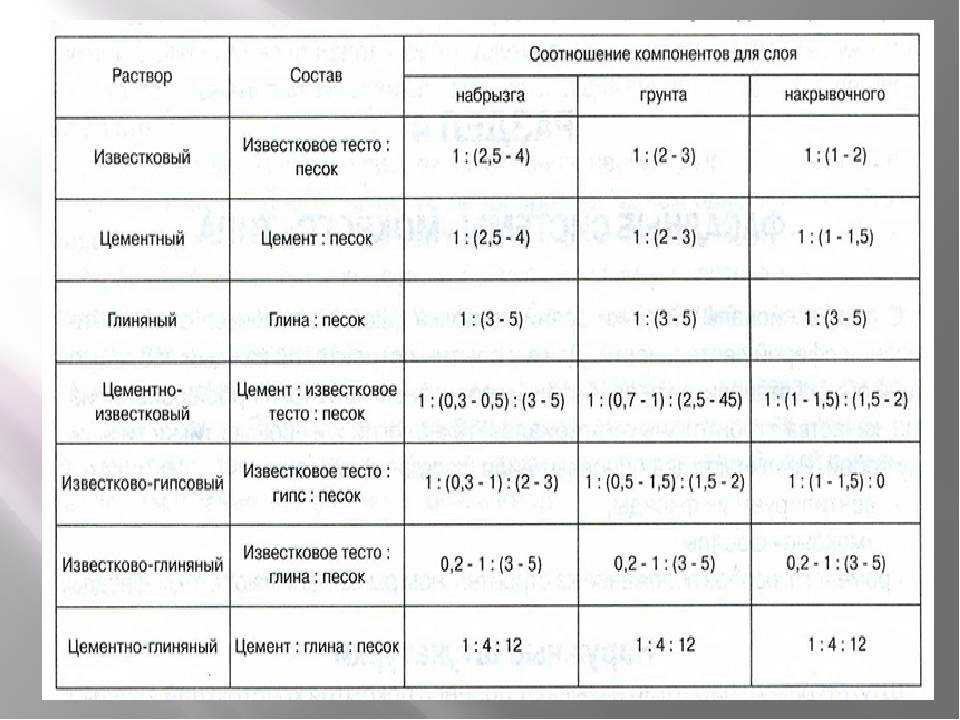
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема маточного раствора нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц.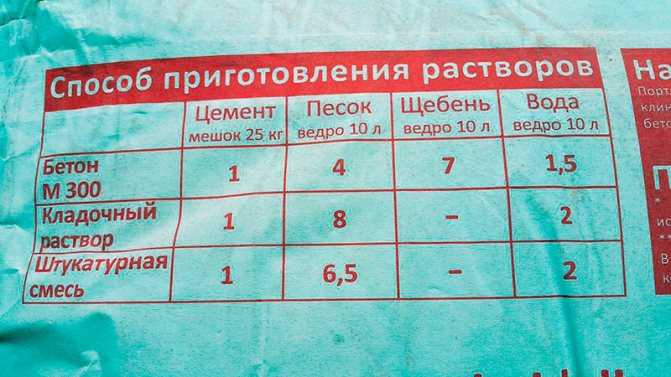 Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим подробнее, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим подробнее, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение: 9- (водн.) \) B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М. A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами. B Одна формула единицы в IN (№ 3 ) 3 производит один в 3 + ION и три № 3 — , так что 0,032 м в (№ 3 ))) 3 Решение содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это [№ 3 + ] = 0,032 м. − ] = 0,096 М. Упражнение Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах? Ответ:  — (водн.) \)
— (водн.) \) 1.2:
1.2:
Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Ответить
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Численные задачи
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке некоторых лекарств есть инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
Ответы
0,48 М ClO −
1,74 × 10 −3 М кофеин
Авторы
- Анонимно
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 12.

 При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
 Однако, этот факт определяет его пластичность и прочность.
Однако, этот факт определяет его пластичность и прочность.
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.

 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?