Как сделать раствор для: Как правильно разводить цемент — полезная информация о строительстве
Как сделать раствор цемента пропорции?
Строительные технологии в лице соответствующих ГОСТов, в зависимости от назначения, регламентируют несколько видов растворов на основе цемента. В то ж время, основные его составляющие постоянны, это:
- Цемент, различных марок, как связующий материал.
- Просеянный речной или намывной песок, как наполнитель.
- Щебень различных видов и фракций, повышающий прочность.
- Вода, как элемент смешивания, затворения и придания сухой смеси свойств раствора.
Кроме основных компонентов в раствор могут добавляться присадки (пластификаторы или отвердители), а щебень заменяться известью (цементно-известковые растворы).
Рецепт строительного раствора
Классический вариант раствора для общестроительных работ соответствует следующим пропорциям:
- Цемент – 1 часть.
- Песок – 1,1 части.
- Щебень – 2,5 части.
По такому соотношению готовится бетонный раствор марки М450, отличающийся высокой прочностью и предназначенный для строительства конструкций испытывающих нагрузку в 450 кг/см2 и более.
Учитывая указанные пропорции, для производства 1 м3 материала понадобится 470 кг цемента ходовой марки М400 (9 стандартных мешков массой 50 кг+20 кг), 517 кг речного просеянного песка и 1 176 кг щебенки.
Если фундамент или другая бетонная конструкция будет нагружаться величиной менее 450 кг/см2, то для приготовления раствора для ее возведения рекомендуется использовать бетоны низших марок, замешиваемые в следующих пропорциях:
- Бетон М100: 183 кг цемента марки М400 (3 мешка по 50 кг +30 кг), песок – 842 кг, щебень – 1282 кг.
- Бетон М200: 264 кг цемента марки М400 (5 мешков+14 кг), песок – 738 кг, щебень – 1265 кг.
- Бетон М300: 338 кг цемента марок М400 (6 мешков по 50 кг +38 кг), песок – 642 кг, щебень – 1250 кг.
Специальные виды цементных растворов
Пропорции цементно-известковых растворов предназначенных для возведения надземных объектов с возможной относительной влажностью воздуха внутри помещений до 60%, а также для строительства фундаментов в грунтах с небольшой влажностью.
- Раствор марки М10 на основе цемента М150 – 1 часть связующего, 1,2 части извести, 9,5 частей песка.
- Раствор марки М50 на основе цемента М200 – 1 часть связующего, 0,3 части извести, 4 части песка.
- Раствор марки М150 на основе цемента М400 – 1 часть связующего, 0,2 части извести, 3 части песка.
- Раствор марки М200 на основе цемента М400 – 1 часть связующего, 0,1 часть извести, 2,5 части песка.
Пропорции цементно-известковых растворов для строительства надземных зданий с возможной относительной влажностью более 60%, а также для конструкций, возводимых во влажных грунтах.
- Раствор марки М10 на основе цемента М150 – 1 часть связующего, 1 часть извести, 9 частей песка.
- Раствор марки М50 на основе цемента М300 – 1 часть связующего , 0,6 частей извести, 6 частей печка.
- Раствор М100 на основе цемента М400 – 1 часть связующего, 0,4 части извести, 4,5 части песка.

- Раствор М150 на основе цемента М500 – 1 часть связующего, 0,3 части извести, 4 части песка.
- Раствор М300 на основе цемента М400 – 1 часть связующего, 0,7 частей извести, 1,8 частей песка.
Как приготовить цементный раствор своими руками, сделать цементный раствор: способы
Оглавление
- Марка строительной смеси имеет значение
- Пропорции для приготовления раствора
- Ручное замешивание цементного состава
- Приготовление раствора бетономешалкой
- Несколько полезных рекомендаций
Как изготовить цементный раствор – вопрос, актуальный для начинающего строителя или обычного владельца частной недвижимости, дачи или квартиры, требующей ремонта. Состав применяется для кирпичной и каменной кладки, оштукатуривания стеновых и потолочных поверхностей, заливки основания здания.
В соответствии со сферой использования раствор отличается составом. Целевое назначение цементной смеси определяет характеристики и соотношение, вяжущего компонента с остальными добавками. Распространенной является смесь из цемента и песка разведенных с добавлением воды.
Распространенной является смесь из цемента и песка разведенных с добавлением воды.
Марка строительной смеси имеет значение
Основным показателем прочности бетона считается его марка. Высокие числовые характеристики позволяют получать качественный и надежный цементный раствор. В соответствии с данным параметром можно выделить:
- М75 – раствор, используемый для обустройства тонких стяжек, кладки не несущих кирпичных и каменных стен;
- М100 – смесь для стяжки пола, заливки межпанельных швов, возведения стен из кирпича и камня;
- М150 – отличается высокими показателями прочности и применяется в обустройстве фундамента, гидроизоляции бассейна и возведения многоэтажных строений;
- М200 – популярна в заливке оснований зданий, заполнении межпанельных швов, оштукатуривании плит из бетона, обустройстве дорожек в саду;
- М250 – подходит для прочных стяжек, укрепленных фундаментов, монолитных перекрытий;
- М300 – прочный раствор, используемый в возведении каркасно-монолитных конструкций.

В зависимости от марки цемента определяется количество песка, воды и других наполнителей. Изменяя пропорции основных ингредиентов можно использовать раствор для разных видов строительных и отделочных работ. Этот показатель влияет на прочность получаемых конструкций и надежность кирпичной или каменной кладки. Обычно инструкцию по приготовлению строительной смеси можно найти на упаковке.
Пропорции для приготовления раствора
На качество готового состава влияют не только использованные компоненты, но и правильный выбор их пропорций. Перед тем как приготовить цементный раствор, важно грамотно определить количество песка, цемента, воды и щебня в соответствии с маркой необходимого для работы бетона.
Массовое и объемное соотношение ингредиентов для приготовления строительного раствора в зависимости от марки цемента приведены в таблице.
| Марка | М400 | |||
| Пропорции компонентов* | Пропорции на 10 литров раствора | Пропорции компонентов* | Пропорции на 10 литров раствора | |
| 100 | 1:4,6:7 | 41:61 | 1:5,8:8,1 | 53:71 |
| 150 | 1:3,5:5,7 | 32:50 | 1:4,5:6,6 | 40:58 |
| 200 | 25:42 | 1:3,5:5,6 | 32:49 | |
| 250 | 1:2,1:3,9 | 19:34 | 1:2,6:4,5 | 24:39 |
| 300 | 1:1,9:3,7 | 17:32 | 1:2,4:4,3 | 22:37 |
| 400 | 1:1,2:2,7 | 11:24 | 1:1,6:3,2 | 14:28 |
| 450 | 1:1,1:2,5 | 10:22 | 1:1,4:2,9 | 12:25 |
| * – Цемент : Песок : Щебень, кг | ||||
Ручное замешивание цементного состава
Чтобы приготовить небольшое количество строительной смеси, подойдет ручной способ замешивания. С этой целью необходимо подготовить большую емкость для засыпки и перемешивания компонентов, лопату и мерную тару (обычно это ведро).
С этой целью необходимо подготовить большую емкость для засыпки и перемешивания компонентов, лопату и мерную тару (обычно это ведро).
Инструкция как сделать цементный раствор вручную:
- Подготовленная емкость наполняется сухими компонентами в подходящих пропорциях. Для удобства перемешивания можно сделать слоеный пирог из цемента и песка.
- Сухие компоненты тщательно вымешиваются, пока состав не приобретет характерный серый цементный оттенок.
- Сухая смесь разбавляется водой. Первоначально добавляется 2/3 от необходимого объема.
- В процессе перемешивания контролируется консистенция раствора. Густой состав разбавляется водой.
Качественно приготовленный раствор медленно сползает с лопаты без следов расслоения. Если состав некачественный он будет липнуть к инструменту и трескаться после высыхания.
Приготовление раствора бетономешалкой
Ускорить и упростить процесс замешивания бетона поможет бетономешалка.
Инструкция как изготовить цементный раствор в бетономешалке:
- Бетономешалка включается в сеть. Засыпка необходимых компонентов происходит во вращающийся барабан. Важно соблюдать правила безопасности.
- Первой заливается вода. Ее объем должен быть меньше на 15-20% от запланированного. Это позволит контролировать густоту получаемого состава.
- Засыпается сухой цемент. Его объем также должен быть меньше на 10-15 процентов.
- Загружается необходимое количество песка. Состав перемешивается в течение 3-4 минут до однородной консистенции.
- По необходимости добавляется вода или цемент в зависимости от требуемой густоты.
По времени перемешивание не должно превышать 10 минут. Если этим пренебречь готовый раствор будет расслаиваться. Рекомендовано всю приготовленную смесь выгружать из барабана бетономешалки. Подготавливая раствор важно четко придерживаться правил иначе, из-за низкого качества полученного материала может пострадать прочность возводимых стен или фундамента.
Подготавливая раствор важно четко придерживаться правил иначе, из-за низкого качества полученного материала может пострадать прочность возводимых стен или фундамента.
Несколько полезных рекомендаций
Несмотря на простоту замешивания цементного раствора, существуют рекомендации позволяющие улучшить качество бетона:
- Нельзя с целью экономии приобретать даже минимально просроченный цемент. Свежий состав гарантирует соответствие заявленным характеристикам.
- При замешивании используется чистая вода и песок без большого содержания глины. Последняя влияет на пластичность и текучесть готовой смеси. Из-за этого после высыхания бетона результат бывает непредсказуемым.
- Перед приготовлением раствора нужно изучать инструкцию к добавляемым присадкам. Важно всегда соблюдать пропорции и очередность внесения ингредиентов.
- Для кладки кирпича нужно подбирать состав, соответствующий марке штучного материала.
- Чтобы замешать качественную бетонную смесь для фундамента, нужно следовать пропорциям и последовательности загрузки песка и щебня.

Для приготовления строительного раствора в домашних условиях не потребуются специальные навыки или профессиональное оборудование. Бетонный состав для заливки фундамента, оштукатуривания стен или кладки кирпича можно приготовить своими силами. Главное следовать инструкциям производителя цемента, чтобы получить качественный состав.
Автор статьи
Виктор Филонцев
Образование:
НИУ МСГУ, Кафедра Технологии вяжущих веществ и бетонов, 2003.
Опыт работы:
12 лет в сфере производства бетона.
Текущая деятельность:
независимые консультации в сфере строительства.
Подробнее
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества Кр 2 О 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 2 ·2Н 2 О, разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
Для приготовления определенного объема раствора, содержащего определенную концентрацию растворенное вещество, нам сначала нужно вычислить количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде. ) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества.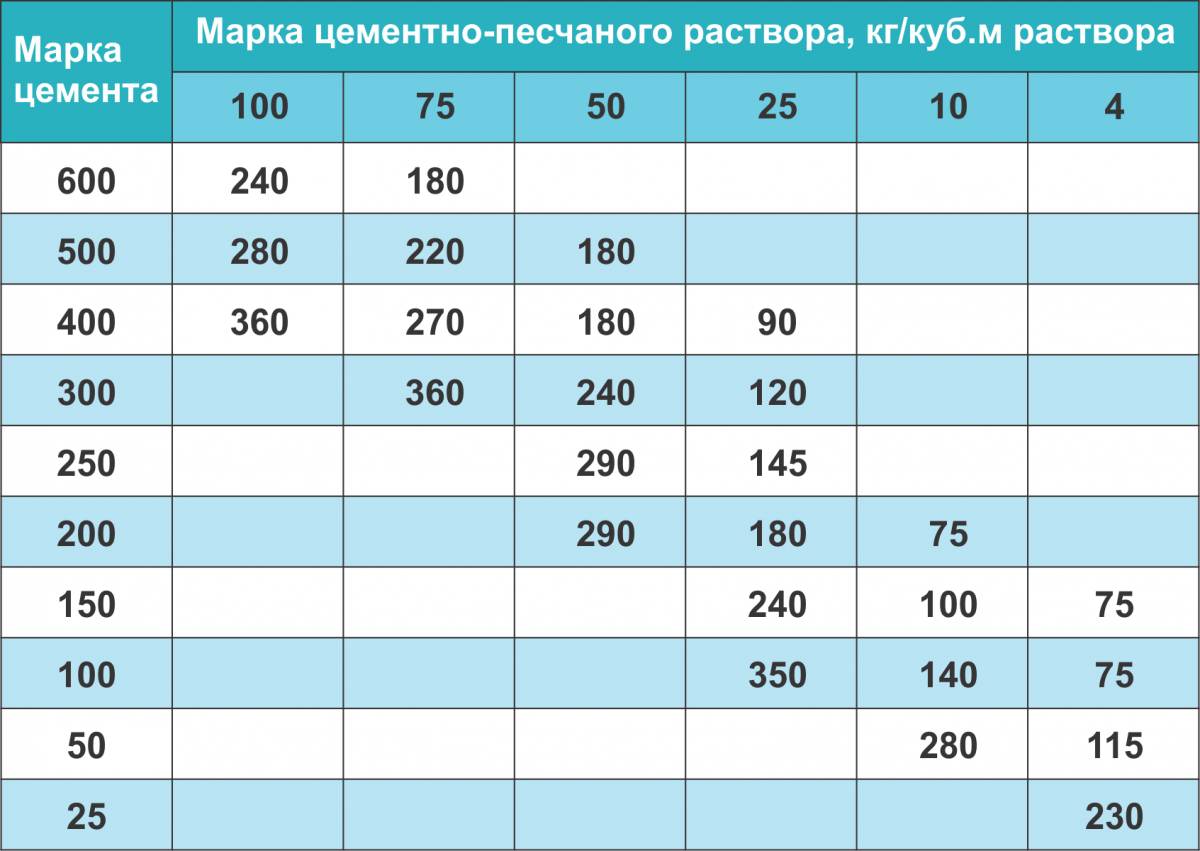 Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления исходного раствора0053 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, на умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рисунок 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 900 54 O 7 производит раствор, содержащий 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионов составляет 2 × 1,43 М = 2,86 М. Поскольку единица формулы (NH 4 ) . 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 М = 4,29 М.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионов составляет 2 × 1,43 М = 2,86 М. Поскольку единица формулы (NH 4 ) . 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 М = 4,29 М.
Пример 12.1.4
9002 3 Каковы концентрации всех видов полученные из растворенных веществ в этих водных растворах?- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. — (водн.) \)
— (водн.) \)
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3 + и три иона NO 3 − , поэтому 0,032 М В (№ 3 ) 3 раствор содержит 0,032 М In 3 + и 3 × 0,032 М = 0,096 М NO 3 – — то есть [In 3 902 98 + ] = 0,032 М и [NO 3 − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М 12.
- Концентрации растворов обычно выражаются в молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств есть инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги

- Метод разбавления
- Метод взвешивания
- Напишите химическую формулу
- Сахароза: C 12 H 22 O 11
- Определить общую молярную массу вещества
- C = 12 u атомных вес x 12 атомов углерода = 144 единицы
- H = 1 атомная масса u x 22 водорода = 22 единицы
- O = 16 атомная масса u x 11 атомов кислорода = 176 единиц
- Общая молекулярная масса = 342 единицы или 342 грамма на моль
- Присвойте значение концентрации
- 50% x 342 грамма = 171 грамм = 0,5 M при растворении в 1 л воды
- М 9005 3 1 – желаемая молярность разведенного раствора
- V 1 – желаемый объем разбавленного раствора
- M 2 – молярность концентрированного маточного раствора
- V 2 – объем концентрированного маточного раствора.

- Этап 1: Установите желаемую молярную концентрацию (M 1 ) разбавленного раствора при заданном желаемом объеме (V 1 ).
- Этап 2: Рассчитайте объем исходного раствора (V 2 ), который необходимо добавить для достижения желаемой концентрации разведения.
- Шаг 3: Тщательно измерьте объем маточного раствора. Используйте пипетку для более точных и точных измерений.
- Шаг 4: Смешайте новый раствор в колбе.
- Шаг 1. Установите молярность раствора, который вы хотите приготовить.
- Шаг 2. Определите молярную массу вещества в граммах на основе химической формулы.

- Этап 3. Взвесьте эквивалентное количество чистого вещества в граммах.
- Этап 4. Растворить вещество в воде.
- Шаг 5. Добавляйте воду до нужного объема.
- Na – 23 ед.
- O – 16 ед.
- H – 1 ед.
- Всего: 40 ед. или 40 граммов на моль
 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 12. 1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
Как приготовить стандартный раствор
Стандартный раствор — это химический раствор, в котором известна концентрация определенного элемента или соединения. Его готовят из стандартного вещества путем его взвешивания и смешивания с определенным объемом растворителя для достижения желаемой концентрации. Существует два основных метода приготовления стандартного раствора:
Стандартные растворы очень важны в аналитической химии, поскольку они могут помочь определить количество вещества в растворе неизвестной концентрации. Лабораторные аналитические методы, такие как титрование, зависят от стандартных растворов для получения точных и достоверных результатов.
Концентрация стандартного раствора обычно измеряется в молях на литр или моль/л, что обычно обозначается просто М. Также могут использоваться другие единицы, такие как моли на кубический дециметр и киломоли на кубический метр. Меньшие единицы используются для небольших образцов, в то время как более крупные единицы, как правило, используются для больших образцов, например, в случае химического производства.
Меньшие единицы используются для небольших образцов, в то время как более крупные единицы, как правило, используются для больших образцов, например, в случае химического производства.
Стандартные растворы также могут служить реагентами и буферами. Их готовят из первичных стандартов, которые представляют собой чрезвычайно чистые вещества. Чистое вещество стабильно, негидратировано и имеет высокую молекулярную массу. Не все вещества можно использовать в качестве первичного стандарта.
В этом посте:
Исходные расчеты
Основным параметром, который необходимо рассчитать при приготовлении стандартного раствора, является концентрация растворенного вещества по отношению к растворителю.
Это можно сделать, предварительно измерив массу стандартного вещества и объем растворителя. Измерение должно основываться на требуемой молярной концентрации раствора. Молярная концентрация — это просто отношение числа молей растворенного вещества, выраженного в молярной массе (граммы), к объему растворителя в литрах.
Эту формулу также можно записать так:
Для стандартных растворов объем растворенного вещества фиксируется равным 1 л, что эквивалентно 1 дм3. Это упрощает расчеты и поддерживает высокий уровень точности.
Для приготовления стандартного раствора вам также необходимо знать общую молярную массу вещества. Вы можете рассчитать это, написав химическую формулу, а затем добавив атомные массы составляющих элементов, как указано в периодической таблице.
Важно помнить разницу между атомным весом и атомной массой. Первое относится к средневзвешенной массе всех изотопов в элементе, а второе — к массе одного атома.
В качестве примера возьмем сахарозу или столовый сахар. Для расчета молекулярной массы сахарозы вам потребуется:
Если вам нужна молярная концентрация столового сахара 50 %, вам потребуется половина общего количества граммов молярного числа вещества, растворенного в одном литре воды.
Примечание: один моль равен 6,022 × 10²³ единиц этого вещества.
Приготовление стандартного раствора методом разбавления
Стандартный раствор можно приготовить, используя так называемый метод разбавления. Это включает добавление дополнительного растворенного вещества к веществу известной концентрации для уменьшения молярной концентрации раствора.
Однако этот метод не изменяет число молей вещества, поскольку остается то же количество частиц. Это означает, что вы можете использовать закон сохранения массы для расчета разбавления. Кислоты стенда — соляная кислота, серная кислота и азотная кислота — все готовятся из концентрированных исходных растворов с использованием метода разбавления.
М 1 В 1 = М 2 В 2
Где:
Процесс метода разбавления
Процесс приготовления стандартного раствора методом разбавления выглядит следующим образом:
Пример – разбавление кислоты
На самом деле не имеет значения, какой тип раствора вы хотите приготовить, при условии, что вы знаете концентрацию исходного раствора и установили желаемую концентрацию разбавленного раствора.
Предположим, вы хотите приготовить 50 мл 1,0 М раствора серной кислоты из исходного концентрированного раствора 2,0 М. Это можно рассчитать по формуле M 1 V 1 = M 2 В 2 .
Это можно рассчитать по формуле M 1 V 1 = M 2 В 2 .
Простым преобразованием можно выделить V 2 .
V 2 = M1V1 /M2
V 2 = (1,0 M)(50 мл)/2,0 M
V 2 = 25 мл маточного раствора
9 0031 Приготовление стандартного раствора методом взвешиванияДругим способом приготовления стандартного раствора является метод взвешивания. Обычно используемый для приготовления основных стандартных растворов метод взвешивания требует чистого вещества, которое можно растворить в растворителе, таком как вода.
Процесс метода взвешивания
Процесс приготовления стандартного раствора методом взвешивания выглядит следующим образом:
Пример – Базовый раствор
Вы можете установить желаемую концентрацию перед приготовлением раствора. В отличие от метода разбавления, метод взвешивания требует от вас расчета молярной массы вещества, которое вы готовите.
Например, если вы готовите гидроксид натрия (NaOH), молярная масса представляет собой сумму всех атомных весов составляющих атомов:
Если вы установите концентрацию 1 М NaOH, вам потребуется растворить 40 граммов NaOH в одном литре. воды.
Заявление об отказе от ответственности
Блог на сайтеchemicals.






 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.

 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?