Как рассчитать количество раствора: Как рассчитать раствор для стяжки пола — калькулятор стяжки
Как рассчитать количество раствора для кирпичной кладки Могилев
Если Вы планируете класть кирпичную кладку своими руками, необходимо рассчитать сколько раствора понадобится на кирпичную кладку 1м3. Некачественная кладка стены приведет к возникновению мостиков холода. В них зачастую образуется плесневый грибок, что вредно для здоровья человека. К тому же, через мостики холода будет уходить тепло. В итоге возрастут затраты на отопление помещения.
Чтобы не потратить деньги на излишнее количество раствора для кирпичной кладки, который попросту пропадет, и чтобы не пришлось в процессе строительства останавливать работу и ехать докупать и замешивать новую смесь, нужно заранее все рассчитать. Для этого Вам понадобится калькулятор расчета и рулетка.
В строительстве используются разные смеси, в зависимости от вида работ. Если кладка кирпичная, то подойдет цемент М50 и М100.
От чего зависит расход
Наибольшее значение имеет вид раствора. Он бывает 4 типов:
– Известняковая смесь. Роль цемента в ней занимает негашеная известь. Ее нельзя применять для наружных работ, поскольку от влаги она быстро повреждается.
– Смесь с пластификатором. Это цементно-песчаная смесь, в которую добавляют полимерную добавку, увеличивающую пластичные свойства раствора.
– Цементно-песчаный. Раствор изготавливают из песка, цемента и воды. Если наносить его правильно, он долго продержится и не будет трескаться.
– Смешанный. В смешанном растворе сочетаются положительные стороны известняковых и цементно-песчаных смесей. Однако, только в том случае, если ее правильно замешать.

Свойства, размеры и материал кирпича тоже влияют на количество требующегося раствора для кладки. Если стена толстая, то и расход будет больше. При кладке из пустотелых кирпичей, так же будет больший расход смеси.
Расход раствора для кирпичной кладки на 1м3
Есть стандарты, определяющие количество раствора на кубометр
Расход раствора для кладки стандартного полнотелого кирпича с размерами 250х120х65:
– половинный (120×120×65) – 0,189 м3;
– одинарный (250×120×65) – 0,221 м3;
– полуторный (380×120×65) – 0,234 м3;
– двойной (510×120×65) – 0,240 м3;
– двойной с половиной (640×120×65) – 0,245 м3.
Из этого получается, что на один полнотелый кирпич раствора уйдет 0,0006305 м3. Тогда 1м2 кирпичной кладки шириной 120 мм требует примерно 75 литров раствора.
Расход раствора для модулированных кирпичей размером 250х120х88:
– половинный (120х120х88) – 0,160 м3;
– полуторный (380х120х88) – 0,216 м3;
– двойной (510х120х88) – 0,222 м3;
– двойной с половиной (640х120х88) – 0,227 м3.

Видно, что тут расход раствора для кирпичной кладки получается немного меньше, чем для полнотелого кирпича. А для пустотелых кирпичей он будет больше.
Что бы рассчитать необходимое количество раствора для кирпичной кладки, рассчитывается общий метраж площади строительства и умножается на расход на 1м3.
Если правильно и точно подсчитать количество раствора для кирпичной кладки
Калькулятор расхода стяжки пола: примеры расчетов
Основное предназначение цементной стяжки – сделать прочное и ровное основание пола. Если все сделать правильно, то у вас будет не только идеальное напольное покрытие, но существенная экономия средств за счет рационального использования строительных материалов. Но чтобы все вышло удачно, нужен точный расчет стяжки пола, а как его сделать знают немногие. Поэтому мы расскажем вам обо всех нюансах правильных расчетов и предоставим удобный онлайн калькулятор стяжки для пола.
Содержание
- Основные виды и функции стяжки
- Онлайн калькулятор стяжки пола
- Как произвести расчеты самостоятельно?
- Как определить толщину стяжки?
- Как определить нулевой уровень?
- Расчет стяжки при разных видах напольного покрытия
- Какие материалы потребуются?
- Как правильно заливать стяжку?
Основные виды и функции стяжки
Существует несколько методов устройства стяжки, которые различаются по используемым материалам (песок, цемент, керамзит, фибра) или способам изготовления. К примеру, стяжка может затворяться с использованием воды или только с применением сухих стройматериалов. «Мокрые» стяжки, в свою очередь, различаются по типу используемого вяжущего вещества – цемента или гипса.
Теперь перечислим основные функции стяжки пола:
- придание напольному покрытию заданного уклона;
- выравнивание поверхности под ламинат, линолеум, паркет и другие виды напольного покрытия;
- улучшение тепло- и звукоизоляционных свойств пола: утепление и поглощение ударных, воздушных, бытовых шумов;
- сокрытие инженерных коммуникаций и трубопроводов;
- распределение теплоэнергии в системах «теплый пол».

Правильная основа – залог качества будущего напольного покрытия.
Онлайн калькулятор стяжки пола
Данный калькулятор позволяет произвести расчеты, необходимого количества смесей и материалов для различных видов стяжки пола:
| Ширина помещения | |
| Длина помещения | |
| Высота стяжки | |
| Цемент | кг. |
| Песок | кг. |
| Вода | л. |
С помощью нашего калькулятора вы сможете определить точный расход песка, цемента, пескобетона, фибры и других строительных материалов для устройства стяжки пола.
Как произвести расчеты самостоятельно?
Чтобы рассчитать, какое количество смеси вам потребуется, необходимо, прежде всего, замерить помещение при помощи рулетки и лазерного уровня. Так мы узнаем площадь пола и увидим, где какие перепады. При помощи простых расчетов узнаем количество квадратных метров и рассчитываем количество строительных материалов, необходимых для стяжки.
К примеру, нам необходимо сделать стяжку в комнате площадью 25 м 2 толщиной 5 см.
- На 1 м 2 при толщине 1 см уходит примерно 22 кг смеси.
- Умножаем 5 см стяжки на 22 кг смеси (5 х 22 = 110). Значит 110 кг будет весить 1 м 2 нашей 5-сантиметровой основы.
- Теперь 25 м 2 умножаем на 110 кг смеси (25 х 110 = 2 750). Значит 2 750 кг будет весить стяжка 5 см на площади 25 м 2.
- Далее 2 750 кг делим на вес мешка сухой смеси (2 750кг. 50кг = 55). Значит 55 мешков смеси весом по 50 кг нам понадобится.
Остальной материал легко рассчитается по площади пола.
Как определить толщину стяжки?
По стандартам СНиП, толщина стяжки должна быть не менее 40 мм, однако если помещение не требует повышенной теплоизоляции, например прихожая или кладовка, то в таких комнатах допускается устройство основания толщиной 30 мм, но ни в коем случае не ниже, иначе прочность и долговечность стяжки существенно уменьшатся.
Если же вы хотите оборудовать пол с подогревом, то для такого покрытия заливают стяжку толщиной 40 мм, для электрического обогрева толщину увеличивают на 10 мм – то есть 50 мм, а если вы решили сделать водяной подогрев, тогда необходимо делать стяжку толщиной от 70 мм до 100 мм.
Чтобы звукоизоляция помещения была лучше, нужно залить раствор в два этапа. Первый слой в 20 мм, а второй – 25-30 мм. Между этими слоями, необходимо проложить утеплитель или другой материал для шумоизоляции, поверх стяжек обязательно нужно положить специальную пленку. Поэтому при расчете стяжки обязательно учитывайте ее толщину.
Как определить нулевой уровень?
Прежде чем произвести расчет стяжки, нужно найти и установить нулевой уровень при помощи специального прибора – лазерного или водяного уровня. Прибор перемещают по периметру пола, делая отметки, которые потом соединяют прямой линией. Только так можно определить правильную горизонтальную плоскость, то есть нулевой уровень.
От получившейся линии до нижнего уровня нужно измерить расстояние в разных точках. Все показатели записываются, и определяется максимальная и минимальная высота. При помощи этих данных, рассчитывают среднюю высоту стяжки.
Все показатели записываются, и определяется максимальная и минимальная высота. При помощи этих данных, рассчитывают среднюю высоту стяжки.
К примеру:
наибольшая высота – 1 см, наименьшая – 0,7 см, получается, что разница между ними (1 – 0,7 = 0,3) это и есть средняя толщина, которую обязательно надо учитывать. Слой стяжки составляет 3 см, значит 3 + 0,3 = 3,3. Вывод, покупать смесь следует из расчета в 3,3 см на ширину.
Расчет стяжки при разных видах напольного покрытия
Иногда даже в пределах одной комнаты используется несколько видов напольного покрытия – плитка и ламинат, доски и линолеум и т.д. В этом случае, необходимо продумать тот момент, что при устройстве такого пола будут образовывать большие перепады. Чтобы пол получился ровным, нужно залить стяжку с учетом перепадов на стыках при использовании разных материалов напольного покрытия.
К примеру, для укладывания паркета используют клей, фанеру, мастику и паркет, а для керамической плитки используют только клей и плитку. Получается, что толщина значительно отличается.
Получается, что толщина значительно отличается.
Так вот, правильный расчет:
Паркет -15 мм, клей – 1 мм, фанера – 10 мм, мастика – 2 мм. В итоге – 28 мм.
Плитка – 10 мм, клей – 5 мм. В итоге – 15 мм.
Следующее действие: 28-15=13 мм, получается, что на стыке этих двух материалов перепад будет равен 13 мм. Специалисты рекомендуют в таком случае добавить еще несколько миллиметров, так как в большинстве случаев при укладке паркета он может приподняться.
То есть стяжку под плитку нужно залить на 13-15 мм выше, чем под паркет.
Какие материалы потребуются?
Для правильной стяжки необходимо заранее изучить ее состав, в который входит не только цемент, песок и вода, но и другие компоненты, предназначенные для выполнения определенных функций. В раствор можно добавить полистирол в гранулах или керамзит для утепления, армирующая сетка для большего скрепления и т.д. Но помните, что соотношение цемента и наполнителя 50% на 50%.
Для устройства стяжки нам потребуется:
- профиль для маяков (маяки)
- сухая смесь (цемент, гипс)
- строительный песок
- фиброволокно (по желанию)
- пластификатор (по желанию)
- кромочная лента
- грунтовка или бетоноконтакт
- армирующая сетка
- пароизоляционная пленка
- вода.

Как правильно заливать стяжку?
Когда все материалы посчитаны, куплены и привезены на объект, можно приступать к работе:
- Прежде всего, нужно подготовить к заливке стяжки плиту перекрытия, очистив ее от мусора и прогрунтовав.
- После высыхания грунтовки или бетоноконтакта, к стене крепится кромочная лента, чтобы снять напряжение стяжки.
- После этого на заранее вымеренной высоте устанавливаются маяки.
- При необходимости армирующую сетку приподнимают и закрепляют чуть ниже центра стяжки.
- Затем готовится смесь: на 10 кг (цемент + наполнитель) – 0,8-1,3 л воды, тщательно перемешивают до однородной массы. Использовать смесь необходимо в течение 50-60 минут.
- Раствор выливают на поверхность и ровной рейкой стягивают ее по маякам до полной заливки пола.
- Через 2-3 дня стяжку нужно полить водой и накрыть пароизоляционной пленкой.
Затем стяжке дают просохнуть и затвердеть в течение 25-30 дней и покрытие готово к дальнейшим работам!
3.4: Концентрации растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 221455
- Эллисон Сульт
- Университет Кентукки
Результаты обучения
- Определение концентрации.
- Используйте термины «концентрированный» и «разбавленный» для описания относительной концентрации раствора.
- Рассчитайте молярность раствора.
- Расчет процентной концентрации (м/м, об/об, м/об).
- Опишите раствор с концентрацией в \(\text{ppm}\) или \(\text{ppb}\).

- Используйте единицы измерения концентрации в расчетах.
- Определите эквиваленты для иона.
- Завершите расчеты относительно эквивалентов молей, объемов или массы.
- Завершить расчет разбавления.
Существует несколько способов выражения количества растворенного вещества в растворе.

Концентрация в процентах
Одним из способов описания концентрации раствора является процентная доля раствора, состоящего из растворенного вещества. Этот процент может быть определен одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленная на объем раствора, или (3) масса растворенного вещества. растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
Массовый процент
Когда растворенное вещество в растворе является твердым, удобным способом выражения концентрации является массовый процент (масса/масса), который представляет собой граммы растворенного вещества на \(100 \: \text{g} \) решения.
\[\text{Проценты по массе} = \frac{\text{масса растворенного вещества}}{\text{масса раствора}} \times 100\%\]
Предположим, что раствор был приготовлен путем растворения \ (25,0 \: \text{г}\) сахара в \(125 \: \text{г}\) воды. Процент по массе будет рассчитываться следующим образом: 93 \: \text{g} \right)\), чтобы вычислить массу воды, которую необходимо добавить.
Объемный процент
Процентное содержание растворенного вещества в растворе легче определить по объему, когда растворенное вещество и растворитель являются жидкостями. Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
\[\begin{align} \text{Проценты по объему} &= \frac{\text{объем растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{ 40 \: \text{мл этанола}}{240 \: \text{мл раствора}} \times 100\% \\ &= 16,7\% \: \text{этанол} \end{align}\]
Часто , на этикетках ингредиентов пищевых продуктов и лекарств количества указаны в процентах (см. рисунок ниже).
рисунок ниже).
Следует отметить, что, в отличие от массы, нельзя просто сложить объемы растворенного вещества и растворителя, чтобы получить окончательный объем раствора. При совместном добавлении растворенного вещества и растворителя масса сохраняется, но не всегда сохраняется объем. В некоторых случаях, как в приведенном выше примере, раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240 \: \text{мл}\) этанола. решение. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
Массово-объемный процент
Массово-объемный процент также используется в некоторых случаях и рассчитывается аналогично предыдущим двум процентам. Процент массы/объема рассчитывается путем деления массы растворенного вещества на объем раствора и выражения результата в процентах.
Например, если раствор готовится из \(10 \: \ce{NaCl}\) в воде, достаточной для приготовления раствора \(150 \: \text{мл}\), массовая концентрация будет равна
\[\begin{align} \text{Объемно-массовая концентрация} & \frac{\text{масса растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{10 \: \text{g} \: \ce{NaCl}}{150 \: \text{мл раствора}} \times 100\% \\ &= 6,7\% \end{align}\]
Части на миллион и Части на миллиард
Двумя другими единицами концентрации являются части на миллион и части на миллиард. Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Например, \(32 \: \text{ppm}\) может быть записано как \(\frac{32 \: \text{мг растворенного вещества}}{1 \: \text{L раствор}}\), а \(59 \: \text{ppb}\) можно записать как \(\frac{59 \: \mu \text{g раствор}}{1 \: \text{L раствор}}\).
Молярность
Химикам в первую очередь необходимо, чтобы концентрация растворов выражалась таким образом, чтобы учитывалось количество присутствующих частиц, которые могут реагировать в соответствии с конкретным химическим уравнением. Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях.
 Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.\[\text{Молярность} \: \left( \text{M} \right) = \frac{\text{моли растворенного вещества}}{\text{литры раствора}} = \frac{\text{ mol}}{\text{L}}\]
Обратите внимание, что объем указан в литрах раствора, а не в литрах растворителя. Когда сообщается молярность, единицей измерения является символ \(\text{M}\), который читается как «молярность». Например, раствор, обозначенный как \(1,5 \: \text{M} \: \ce{NH_3}\), представляет собой «1,5 молярный раствор аммиака».
Пример 8.1.1
Раствор готовят путем растворения \(42,23 \: \text{g}\) \(\ce{NH_4Cl}\) в количестве воды, достаточном для получения \(500,0 \: \text{мл }\) решения. Вычислите его молярность.
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Масса \(\ce{NH_4Cl} = 42,23 \: \text{g}\)
- Молярная масса \(\ce{NH_4Cl} = 53,50 \: \text{г/моль}\)
- Объем раствора \(= 500,0 \: \text{мл} = 0,5000 \: \text{л}\)
Неизвестно
- Молярность \(= ? \: \text{M}\)
Массу хлорида аммония сначала переводят в моли. Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
\[42,23 \: \text{g} \: \ce{NH_4Cl} \times \frac{1 \: \text{моль} \: \ce{NH_4Cl}}{53,50 \: \text{g} \: \ce{NH_4Cl}} = 0,7893 \: \text{моль} \: \ce{NH_4Cl}\]
\[\frac{0,7893 \: \text{моль} \: \ce{NH_4Cl}}{0,5000 \: \text{L}} = 1,579 \: \text{M}\]
Шаг 3: Подумайте о своем результате .
Молярность \(1,579 \: \text{M}\), что означает, что литр раствора будет содержать 1,579 моль \(\ce{NH_4Cl}\). Уместно наличие четырех значащих цифр.
Рисунок 8.1.3: Мерные колбы бывают разных размеров, каждая из которых предназначена для приготовления разного объема раствора.Разведения
При добавлении дополнительного количества воды к водному раствору концентрация этого раствора уменьшается. Это связано с тем, что количество молей растворенного вещества не меняется, а общий объем раствора увеличивается.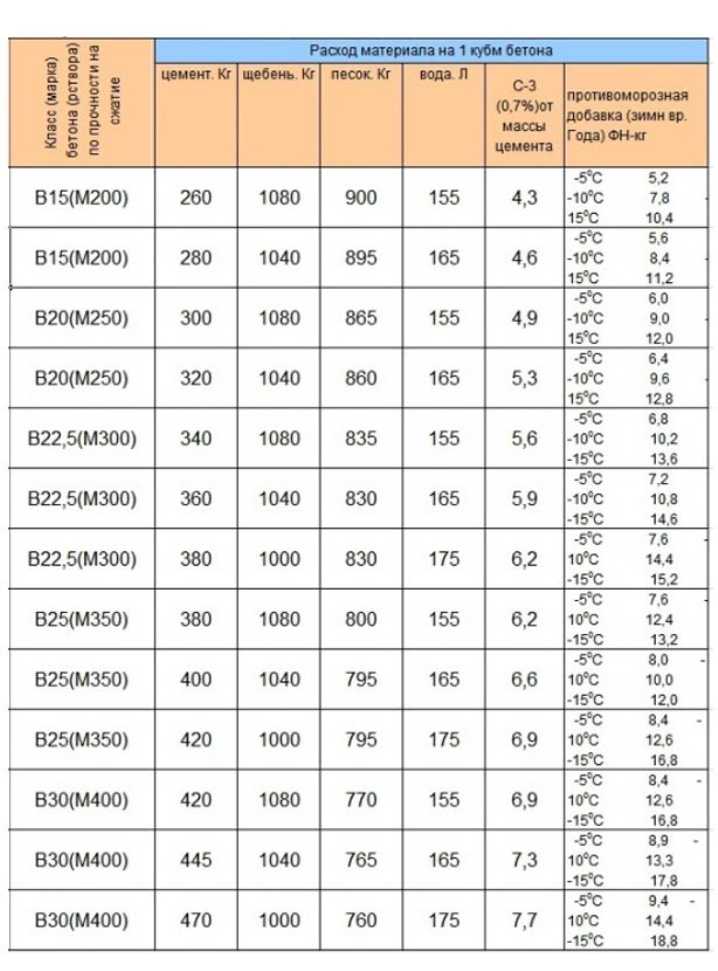
\[\text{моль}_1 = \text{моль}_2\]
Поскольку моль растворенного вещества в растворе равна молярности, умноженной на объем в литрах, мы можем установить их равными.
\[M_1 \times L_1 = M_2 \times L_2\]
Наконец, поскольку две части уравнения установлены равными друг другу, объем может быть в любых выбранных нами единицах, если эта единица является одинаково с обеих сторон. Наше уравнение для расчета молярности разбавленного раствора принимает следующий вид:
\[M_1 \times V_1 = M_2 \times V_2\]
Кроме того, концентрация может быть выражена в любых других единицах, если \(M_1\) и \( M_2\) находятся в одном блоке.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \frac{M_1 \times V_1}{V_2} = \frac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl}\]
Раствор разбавлен в пять раз, так как новый объем в пять раз больше исходного оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения. Другая распространенная проблема разбавления заключается в том, чтобы решить, сколько высококонцентрированного раствора требуется для получения желаемого количества раствора с более низкой концентрацией. Высококонцентрированный раствор обычно называют исходным раствором.
Пример 8.1.2
Азотная кислота \(\left( \ce{HNO_3} \right)\) является мощной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Запас \(\ce{HNO_3} \: \left( M_1 \right) = 16 \: \text{M}\)
- \(V_2 = 8.00 \: \text{L}\)
- \(М_2 = 0,50 \: \текст{М}\)
Неизвестно
- Объем запаса \(\ce{HNO_3} \: \left( V_1 \right) = ? \: \text{L}\)
Неизвестным в уравнении является \(V_1\), необходимый объем концентрированного маточного раствора.
Шаг 2: Решить.
\[V_1 = \frac{M_2 \times V_2}{V_1} = \frac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M} } = 0,25 \: \text{L} = 250 \: \text{мл}\]
Шаг 3: Подумайте о своем результате.
\(250 \: \text{мл}\) исходного \(\ce{HNO_3}\) раствора необходимо разбавить водой до конечного объема \(8,00 \: \text{л}\ ). Разбавление от \(16 \: \text{M}\) до \(0,5 \: \text{M}\) равно 32.
Эквиваленты
много способов. Также очень важно использовать единицы с любыми значениями, чтобы обеспечить правильную дозировку лекарств или сообщать об уровнях веществ в крови, и это только два. 9{2-}} & 2 \end{array}\]
9{2-}} & 2 \end{array}\]
Эквиваленты используются, потому что концентрация зарядов важнее, чем идентичность растворенных веществ. Например, стандартный раствор для внутривенного введения не содержит тех же растворенных веществ, что и кровь, но концентрация зарядов такая же.
Иногда концентрация ниже, и в этом случае миллиэквиваленты \(\left( \text{mEq} \right)\) являются более подходящей единицей измерения. Так же, как метрические префиксы, используемые с базовыми единицами, милли используются для изменения эквивалентов, поэтому \(1 \: \text{Eq} = 1000 \: \text{mEq}\). 9+}\]
Авторы
Эта страница под названием 3.4: Concentrations of Solutions распространяется по незаявленной лицензии и была создана, изменена и/или курирована Эллисон Сульт.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Эллисон Сульт
- Показать страницу TOC
- № на стр.

- Теги
- концентрация
- частей на миллион
- источник[1]-chem-155677
- источник[2]-chem-58828
- источник[3]-хим-155677
- источник-хим-58828
5.2: Растворы и разведения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98550
Цели обучения
- Количественное описание концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4. 5.1} \]
5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube (opens in new window) [youtu. be]
be]
Концентрации также часто указываются в пересчете на массу (m/m) или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующих молей растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0032
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующих молей растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0032
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М исходного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \номер\]
При определении необходимого объема маточного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного изображения раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.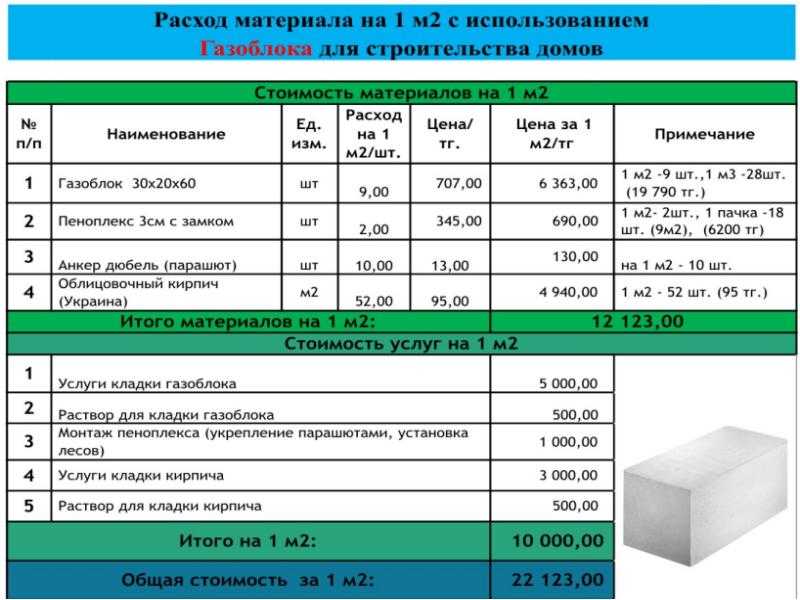
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — также должен быть 1,43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 . Производит три ионов при растворенных воде (2NH 4 + + 1CR 2 O 7 2 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444).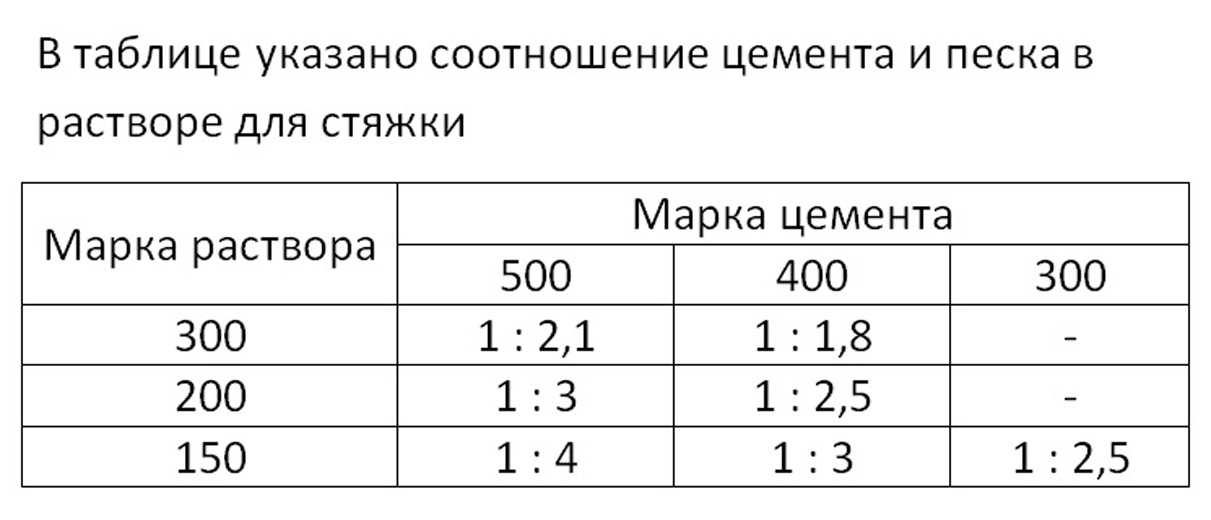 в растворе 3 × 1,43 М = 4,29 М.
в растворе 3 × 1,43 М = 4,29 М.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH дает один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
B Одна единица формулы IN (№ 3 ) 3 производит один в 3 + Ion и три NO 3 — ION, SO A. 0.032 M 2 — 44444444444 гг. 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 — — это, [в 3 + 44444444444444444444444444444444444444444 44444 4444444444444 4444444 44444444 4444444 444444 444444 4444 — это. − ] = 0,096 М.
− ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер\]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора.