Газоблок калькулятор онлайн: Онлайн калькулятор расчета количества газобетонных блоков
Калькулятор закона идеального газа (давление–объем–температура–количество) • Термодинамика — теплота • Онлайн-конвертеры единиц измерения
Этот калькулятор закона идеального газа определяет одно из четырех значений в уравнении идеального газа (давление, объем, температура или количество), если известны еще три.
Пример: Рассчитайте давление в паскалях 800 моль метана, хранящегося при 30 °C в 70-литровом баке автомобиля, работающего на метане.
Больше примеров задач уравнения идеального газа и их решения вы найдете под калькулятором.
Выберите «Неизвестное», чтобы решить уравнение идеального газа:
P V T N
Абсолютный давление
(PAS (МПа)килопаскаль (кПа)гектопаскаль (гПа)ньютон/метр² (Н/м²)бар (бар)килограмм-сила/метр² (кгс/м²)торр (торр)psi (psi)миллиметр ртутного столба (0°C) (мм рт.ст. )мм водяного столба (4°C) (мм вод. ст. )атмосфера техническая (ат)стандартная атмосфера (атм)
)атмосфера техническая (ат)стандартная атмосфера (атм)
Объем
В метр³ (м³)дециметр³ (дм³)сантиметр³ (см³)литр (л)миллилитр (мл)галлон (США) (гал)кварт (США) (кварт)жидкая унция (США) ( жидкие унции)жидкие унции (Великобритания) (жидкие унции)фут³ (фут³)дюйм³ (дюйм³)
Температура
T градус Цельсия (°C)градус Фаренгейта (°F)градус Ренкина (°R)кельвин ( K)
Количество в молях
n моль
ИЛИ
Молярная масса
M грамм на моль (г/моль) килограмм на моль (кг/моль)
Масса
m миллиграмм (мг) грамм (г) килограмм (кг) унция (унция) фунт (фунт) )
Share
Для расчета выберите неизвестное значение и введите известные три из четырех доступных значений (давление, объем, температура и количество). Нажмите кнопку Calculate , чтобы вычислить неизвестное значение. Вы можете ввести количество в молях или в виде комбинации молярной массы и массы газа. Используйте наш калькулятор молярной массы, чтобы определить молярную массу любого газа. Если вы хотите определить молярную массу смеси газов, например сухого воздуха, вам необходимо определить молярные массы каждого газа и умножить их на мольные доли каждого газа.
Используйте наш калькулятор молярной массы, чтобы определить молярную массу любого газа. Если вы хотите определить молярную массу смеси газов, например сухого воздуха, вам необходимо определить молярные массы каждого газа и умножить их на мольные доли каждого газа.
Практические задачи с идеальным газом
Определения и формулы
Идеальный газ
Закон об идеальном газе
Закон Бойля ( T=const, n=const )
Pconst 90)
Закон Шарля ( P=const, n=const )
Закон Гей-Люссака ( V=const, n=const )
Практические задачи с идеальным газом
50 Задача 0 6: При нормальных условиях 0 °С и абсолютное атмосферное давление 100 кПа), плотность воздуха 1,28 кг/м³. Определить среднюю молярную массу воздуха.Решение: Из данной плотности воздуха мы знаем, что масса одного кубического метра воздуха равна 1,28 кг. Нажмите кнопку Сбросить и введите данные проблемы в калькулятор:
- Выберите n (Количество в молях) в селекторе Выберите неизвестный .

- Введите абсолютное давление P = 100 кПа.
- Введите объем V = 1 м³.
- Введите температуру T = 0 °C.
- Щелкните или нажмите кнопку Вычислить 9кнопка 0006.
- Будет рассчитано количество 1 м 3 воздуха в молях.
- Введите массу m = 1,28 кг и щелкните или нажмите кнопку Рассчитать .
- Будет рассчитана молярная масса воздуха M = 0,029 кг/моль
Задача 2: Молярная масса газообразного кислорода (O₂) равна M = 32 г/моль. Определить абсолютную температуру 128 г кислорода в 4-литровом сосуде при давлении Р = 3 МПа.
Решение: Нажмите кнопку Сброс и введите данные о проблеме в калькулятор:
- Выберите T (Температура) в селекторе Выберите неизвестный селектор.
- Введите молярную массу кислорода M = 32 г/моль.
- Введите массу кислорода m = 128 г.
- Будет рассчитано количество кислорода в молях.
- Введите объем V = 4 л и давление P = 3 МПа.

- Щелкните или нажмите кнопку Вычислить .
- Считайте температуру в кельвинах.
Задача 3: Сосуд высокого давления заполнен газом с давлением P = 0,5 МПа и температурой T = 15 °C. Объем газа V = 5 л. Рассчитайте объем этой массы газа при нормальных условиях (P = 100 кПа, T = 0 °С).
Решение: Нажмите кнопку Сбросить и введите данные проблемы в калькулятор:
- Выберите n (Количество в молях) в Выберите неизвестный селектор .
- Введите давление P = 500 кПа.
- Введите температуру T = 15 °C.
- Введите объем V = 5 л.
- Щелкните или нажмите кнопку Рассчитать .
- Калькулятор рассчитает количество в молях, которое будет использовано позже.
- Изменить Выберите неизвестный селектор на Volume .
- Введите давление и температуру для нормальных условий P = 100 кПа, T = 0 °C и щелкните или нажмите кнопку Кнопка «Рассчитать «.

- Будет рассчитан объем V = 23,69 л при нормальных условиях.
Задача 4: Рассчитайте давление в паскалях 12,8 кг метана (молекулярная масса 16 г/моль), хранящегося при 30 °C в 70-литровом баке автомобиля, работающего на метане.
Определения и формулы
Идеальный газ
Идеальный газ — это теоретическая модель газа, в которой газ представлен множеством случайно движущихся точечных частиц, которые взаимодействуют друг с другом только идеально упруго, то есть при столкновении любых двух частиц, их кинетическая энергия остается неизменной и не преобразуется ни в какую другую форму энергии, такую как потенциальная энергия или теплота. Частицы газа называются точечными, потому что предполагается, что они не занимают никакого пространства. Эта теоретическая модель полезна, поскольку упрощает многие расчеты и потому, что идеальный газ подчиняется законам Ньютона. Его можно представить как совокупность совершенно твердых сфер, которые сталкиваются и не взаимодействуют друг с другом.
В обычных условиях, таких как стандартные условия (температура 273,15 К и давление 1 стандартная атмосфера), большинство реальных газов ведут себя как идеальные газы. Вообще говоря, газ ведет себя как идеальный газ при более низком давлении и более высоких температурах, когда расстояния между молекулами газа относительно велики. В этих условиях потенциальная энергия за счет межмолекулярных сил много меньше кинетической энергии частиц. Размер молекул также незначителен по сравнению с расстоянием между ними. При более низких температурах и более высоких давлениях, а также для тяжелых газов модель идеального газа не работает. Когда температура становится еще ниже, а давление выше, реальный газ может стать жидким или даже твердым, т. е. претерпевать фазовый переход. В то же время модель идеального газа не допускает жидкого или твердого состояния.
Закон идеального газа
Идеальный газ, как и любой газ, можно охарактеризовать четырьмя переменными и одной константой. These are:
These are:
- pressure ( P ),
- volume ( V ),
- quantity in moles ( n ),
- temperature ( T ), and
- gas constant ( R )
Эти четыре переменные и одна константа объединены в следующем уравнении, которое называется законом идеального газа :
Это уравнение также известно как уравнение Клапейрона, поскольку оно было впервые сформулировано в 1834 году французским инженером Эмилем Клапейроном (1799–1864). В этом уравнении:
- P — это абсолютное давление, измеренное в СИ в паскалях (Па),
- V — это объем, измеренный в СИ в кубических метрах (м³),
- 5 — это4 количество вещества (газа) в молях (моль). Один моль любого соединения, измеренный в граммах, численно равен средней массе одной молекулы соединения в единых атомных единицах массы. Например, один моль кислорода с атомной массой 16 соответствует 16 граммам.
 Один моль идеального газа при стандартных условиях занимает 22,4 литра.
Один моль идеального газа при стандартных условиях занимает 22,4 литра. - T — это абсолютная температура.
- R — газовая постоянная . , также называемая идеальной, молярной или универсальной газовой постоянной, — физическая константа пропорциональности уравнения идеального газа.
Приведенное выше уравнение показывает, что для нулевой абсолютной температуры существует нулевой объем. Однако это не означает, что объем реального газа действительно исчезает. При очень низких температурах все газы становятся жидкостями, а уравнение идеального газа к жидкостям неприменимо.
Газовая постоянная соответствует работе, которую совершает один моль идеального газа при нагревании на 1 К при постоянном давлении. Его размерность — это работа на количество на температуру, а константа точно определена как 8,31446261815324 Дж⋅К⁻¹⋅моль⁻¹. Газовая постоянная также определяется как постоянная Авогадро N A , умноженная на постоянную Больцмана k :
Постоянная идеального газа была открыта и введена в закон идеального газа вместо многих конкретных газовых постоянных Дмитрием Менделеева в 1877 г.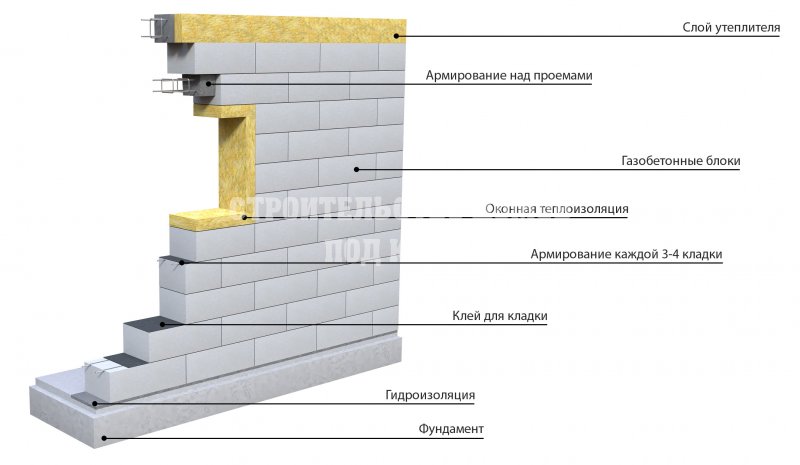 Поэтому уравнение закона идеального газа иногда, особенно в русскоязычных учебниках, называют уравнением Менделеева-Клапейрона.
Поэтому уравнение закона идеального газа иногда, особенно в русскоязычных учебниках, называют уравнением Менделеева-Клапейрона.
Химическое количество газа в молях иногда удобнее заменить указанием массы газа. Химическое количество газа в молях n , его масса m в граммах и его молярная масса M в граммах на моль получаются как
. Уравнение газового закона выше, мы получаем:
Чтобы определить молярную массу элемента, его относительную атомную массу умножают на константу молярной массы в кг/моль
Например, молярная масса элементарного кислорода в единицах СИ равна
Теперь, вводя плотность ρ = m/V , получаем:
Теперь введем удельную газовую постоянную как отношение газовой постоянной R к молекулярной массе M :
Например, удельная газовая постоянная сухого воздуха приблизительно равна 287 Дж·кг⁻¹·K⁻¹. Переписав уравнение идеального газа с использованием удельной газовой постоянной, получим:
Закон идеального газа объединяет четыре эмпирических простых закона газа, открытых несколькими учеными, которые тщательно измеряли свойства газа в 17-19 веках.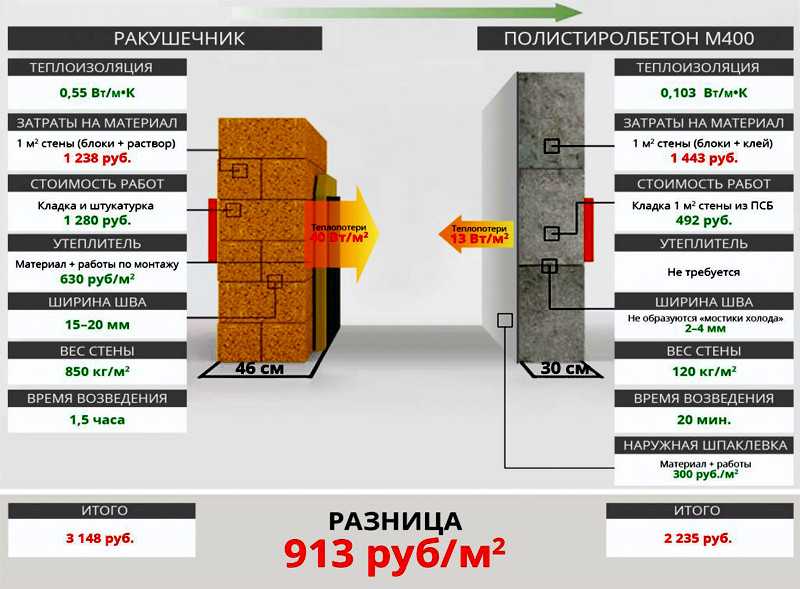 Законы простого газа можно вывести из приведенного выше уравнения идеального газа ( PV=nRT ). Поскольку в этом уравнении R является константой, мы можем написать
Законы простого газа можно вывести из приведенного выше уравнения идеального газа ( PV=nRT ). Поскольку в этом уравнении R является константой, мы можем написать
Поскольку PV/NT является константой, мы можем переписать это в виде: и конечные состояния газа в системе. Мы будем использовать это уравнение ниже для описания четырех газовых законов.
Обратите внимание, что исторически эмпирические газовые законы, описанные ниже, привели к выводу идеального газового закона. Эти законы были открыты несколькими учеными, которые проводили эксперименты, в которых изменялись только две переменные состояния газа, а две другие оставались постоянными.
Закон Бойля (
T=const, n=const )Роберт Бойль
Теперь, для приведенного выше уравнения, для фиксированного количества газа в молях n при постоянной температуре T мы получаем
или
Edme Mariotte
Это Закон Бойла , в котором описывается взаимосвязь между томом V и давлением P фиксированного количества газа в Moles N AT постоянной температуры . Т . При изменении объема и давления изменение давления обратно пропорционально изменению объема газа. Он был сформулирован англо-ирландским химиком и физиком Робертом Бойлем в 1662 г. В России и континентальной Европе этот закон называют законом Бойля-Мариотта в знак признания вклада французского физика и священника Эдма Мариотта в открытие этого закона.
Т . При изменении объема и давления изменение давления обратно пропорционально изменению объема газа. Он был сформулирован англо-ирландским химиком и физиком Робертом Бойлем в 1662 г. В России и континентальной Европе этот закон называют законом Бойля-Мариотта в знак признания вклада французского физика и священника Эдма Мариотта в открытие этого закона.
Закон Авогадро (
T=const, P=const )Амедео Авогадро
Если температура и давление постоянны, то мы можем написать
и давление, равные объемы всех газов содержат одинаковое количество молекул. Это уравнение показывает, что если количество газа увеличивается, объем газа увеличивается пропорционально. Другими словами, количество атомов или молекул газа не зависит от их размеров или молекулярной массы газа. Закон назван в честь итальянского ученого Амедео Авогадро, опубликовавшего свою гипотезу о зависимости между объемом газа и его количеством в молях в 1811 году. Его имя носит и постоянная Авогадро.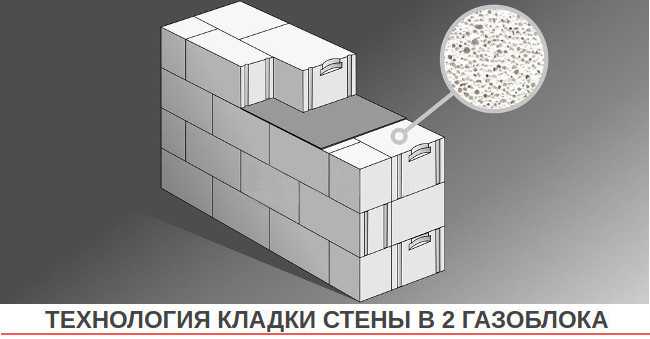
Закон Шарля (
P=const, n=const )Жак Шарль
Для фиксированного количества газа в молях, когда его давление поддерживается постоянным, объем газа в системе прямо пропорционален абсолютному температура системы или
Этот закон также называют законом объемов . Проще говоря, закон Шарля описывает, что любой газ расширяется, когда его абсолютная температура увеличивается. Закон был сформулирован в неопубликованной работе французского ученого Жака Шарля в 1780-х годах. Французский химик и физик Жозеф Луи Гей-Люссак опубликовал этот закон в 1803 году и приписал открытие Жаку Шарлю. Поэтому этот закон иногда можно назвать законом Гей-Люссака. Например, в российских учебниках этот закон называется законом Гей-Люссака (русский: закон Гей-Люссака), а итальянские ученые называют его первым законом Гей-Люссака (итал. prima legge di Gay-Lussac).
Закон Гей-Люссака (
V=const, n=const )Жозеф-Луи Гей-Люссак
Закон Гей-Люссака или закон давления-температуры утверждает, что давление данного количества газа в молях, если его объем постоянен, прямо пропорционален абсолютной температуре газа:
Закон сформулирован Гей-Люссаком в 1802 году. В разных странах этот закон также называют законом Амонтона, потому что его открыл французский ученый Гийом Амонтон. закон на 100 лет раньше Гей-Люссака и описал его количественно. Иногда этот закон называют вторым законом Гей-Люссака и законом Шарля, потому что сам Гей-Люссак считал, что закон был открыт Шарлем. Закон давления-температуры был также независимо открыт английским химиком и физиком Джоном Дальтоном в 1801 году. аналогичные исследования и получили те же результаты.
В разных странах этот закон также называют законом Амонтона, потому что его открыл французский ученый Гийом Амонтон. закон на 100 лет раньше Гей-Люссака и описал его количественно. Иногда этот закон называют вторым законом Гей-Люссака и законом Шарля, потому что сам Гей-Люссак считал, что закон был открыт Шарлем. Закон давления-температуры был также независимо открыт английским химиком и физиком Джоном Дальтоном в 1801 году. аналогичные исследования и получили те же результаты.
По мере того, как воздух в оболочке воздушного шара нагревается, его плотность становится меньше, чем у наружного воздуха, что делает воздушный шар плавучим.
Эту статью написал Анатолий Золотков
Cv Calculator | Свагелок
Распечатать страницу Страница электронной почты
С помощью этого калькулятора можно выбрать клапан с достаточной пропускной способностью для данного применения. Коэффициент расхода клапана (C v ) — это удобный способ представить пропускную способность клапана для ряда жидкостей и параметров процесса. Калькулятор C v вычислит либо C v , либо расход, используя предоставленные дополнительные параметры жидкости, входное и выходное давление и температуру жидкости. Расчеты могут выполняться как для жидкости, так и для газа. Выбираем вентиль с С 9Значение 0305 v , значительно превышающее расчетное значение C v , поможет обеспечить ожидаемую производительность потока.
Коэффициент расхода клапана (C v ) — это удобный способ представить пропускную способность клапана для ряда жидкостей и параметров процесса. Калькулятор C v вычислит либо C v , либо расход, используя предоставленные дополнительные параметры жидкости, входное и выходное давление и температуру жидкости. Расчеты могут выполняться как для жидкости, так и для газа. Выбираем вентиль с С 9Значение 0305 v , значительно превышающее расчетное значение C v , поможет обеспечить ожидаемую производительность потока.
Единицы измерения давления газа – абсолютное давление, за исключением PSIG.
Безопасный выбор продукта: При выборе продукта необходимо учитывать конструкцию всей системы, чтобы обеспечить безопасную и бесперебойную работу. Функционирование, совместимость материалов, соответствующие характеристики, правильная установка, эксплуатация и техническое обслуживание являются обязанностями проектировщика и пользователя системы.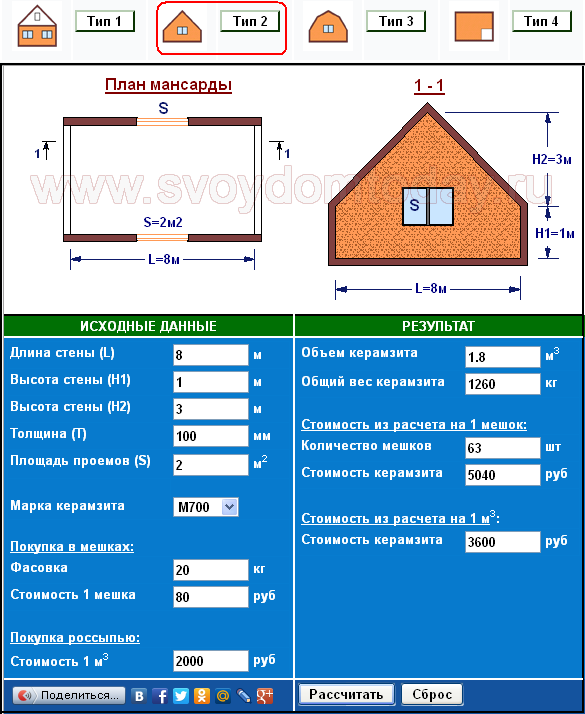 |
Для получения дополнительной информации или ресурсов:
- Просмотрите наш обширный ассортимент высококачественных клапанов, чтобы найти клапан, подходящий для вашего применения
- Используйте наш генератор кривых расхода регулятора, чтобы получить уникальную кривую расхода на основе набора заданных пользователем параметров применения для регуляторов давления серии RHPS
- Обратитесь в авторизованный центр продаж и обслуживания Swagelok
Тип расчета
- резюме
- Поток
Средний тип
- Жидкость
- Газ
Давление на входе (P1)
Это поле обязательно к заполнению
PSIAkPabarmPaPSIG
Давление на выходе (P2)
Это поле обязательно к заполнению
PSIAkPabarmPaPSIG
Для точного показания давления P1 должен быть больше, чем P2.
Скорость потока (Q)
Это поле обязательно к заполнению
SCFMstdl/minstdm3/hstdm3/мгпмл/гл/мл/см3/ч
Температура
Это поле обязательно к заполнению
ºФаренгейтаºЦельсияºКельвина
Системный носитель АцетонСпирт, Этиловый спирт, МетилбензолБензинКеросинМорская водаВодаАцетиленВоздухАммиакАргонБутанУглекислый газГелийВодородМетанАзот
Удельный вес Это поле обязательно к заполнению
Единицы расхода SCFMstdl/minstdm3/hstdm3/мгпмл/гл/мл/см3/ч
Значение резюме:
Значение потока:
Пожалуйста, введите температуру.



 Один моль идеального газа при стандартных условиях занимает 22,4 литра.
Один моль идеального газа при стандартных условиях занимает 22,4 литра.