Чтобы раствор не замерзал: Можно ли в бетон добавлять соль? Зачем?
Какая минимальная температура замерзания цементного раствора для кладки?
Давайте по порядку. В состав цементных растворов неизменно входит вода, которая при температуре ниже нуля замерзает, замедляя гидратационное твердение раствора. Образование цементного камня происходит при химическом взаимодействии воды с цементом, при этом вода становится химически связанная и ей мороз не страшен. Та часть воды, которая замерзла не успев прореагировать, при замерзании обращается в лед, что сопровождается расширением системы. Поэтому, начальная прочность раствора обеспечиваемая связанной водой, для предотвращения его разрушения за счет внутренних напряжений при расширении воды, должна быть больше этих напряжений. Поэтому в общем случае температура не должна быть ниже нуля, хотя бы до момента набора начальной прочности. Время набора начальной прочности определяется типом цемента, его составом, водотвердым отношением и наличием пластификаторов и добавок. Оно может быть от нескольких часов до 2 суток.
Пути решения проблемы при беспрогревочном способе кладки.
Согласно табл. 2 ГОСТ 28013-98, регламентирующему кладочные растворы, предусмотрено повышение температуры раствора для кладки путем его подогревания (добавления теплой воды) в зависимости от типа кладочного материала, температуры окружающей среды и скорости ветра.
Согласно табл. 7 свода проектирования СП 82-101-98 при температуре ниже нуля предусмотрено введение добавок повышающих скорость реакции и сохраняющих жидкую фазу, т.н. катализаторов твердения: нитрита натрия; нитрата кальция с мочевиной; поташа в зависимости от температуры. Возможны их соединения. Но эти добавки для жилых помещений не допускаются.
Еще один путь — добавление пластификаторов на основе лигносульфонатов, редуцирующих воду, что повышает подвижность растворов при уменьшении доли воды, а чем меньше воды, тем плотнее и крепче раствор, меньше вероятность разрушения. Рынок переполнен такими продуктами, в основном химическими аналогами СП-6.
Рынок переполнен такими продуктами, в основном химическими аналогами СП-6.
И наконец добавки ориентированные на снижение температуры замерзания воды в растворе, например аммиачная вода, гидрозим.
В основном добавки имеют комплексное воздействие.
Как не дать цементу замерзнуть зимой?
Всем известно, что минус на дворе – это ключевая проблема всех строительных работ, которые ведутся в холодное зимнее время. Особенно это касается вопроса бетонирования, ведь именно на цементе низкие температуры отражаются наихудшим образом – материал твердеет и схватывается быстрее, чем положено по нормативам, что приводит к его растрескиванию и потере функциональных характеристик.
Как провести правильное бетонирование в зимний период?
Если вы не знаете, какие особенности у бетонирования зимой, то приготовьтесь запоминать важнейшие нюансы. Кстати, если вы еще не выбрали цементный раствор, то советуем вам обратить внимание на цемент Мастер Универсал ЦЕМ II/А-К (Ш-И) 42,5Н. Итак, первое, о чем следует побеспокоиться при укладке фундамента в холодную пору, – создании таких условий, в которых материал не замерзнет. Это важно по одной простой причине – нельзя, чтобы цемент потерял всю влагу. Поэтому вашим приоритетным направлением в работе станет обеспечение материалу такой температуры, при которой вода в растворе не заледенеет.
Итак, первое, о чем следует побеспокоиться при укладке фундамента в холодную пору, – создании таких условий, в которых материал не замерзнет. Это важно по одной простой причине – нельзя, чтобы цемент потерял всю влагу. Поэтому вашим приоритетным направлением в работе станет обеспечение материалу такой температуры, при которой вода в растворе не заледенеет.
Чтобы добиться такого эффекта, придется запастись так званым «набором прочности», который включает:
- электрообогреватели;
- незамерзайку (антифриз) для бетонных смесей;
- материалы для застилки бетона;
- тепловую пушку.
Самым удобным из всех вышеуказанных материалов, безусловно, является антифриз. Нередко его можно найти встретить в составе «зимнего» цемента. Однако, если на упаковке о таком ингредиенте ничего не сказано, лучше приобрести раствор дополнительно и смешать с бетоном. Такой метод подогрева подойдет тем, кто самостоятельно производит небольшие строительные работы.
На больших строительных объектах принято использовать метод электроподогрева при помощи специальных установок-обогревателей. Дороговизна такого метода нередко заставляет прибегнуть к альтернативе – укрыванию теплоизоляционным материалом фундамента. Чаще всего таким изолятором становится утеплитель или пленка.
Дороговизна такого метода нередко заставляет прибегнуть к альтернативе – укрыванию теплоизоляционным материалом фундамента. Чаще всего таким изолятором становится утеплитель или пленка.
Самое главное – следите за тем, чтобы бетонный раствор не был холоднее, недели 3 градуса тепла.
Кладка кирпича в холодное время года
Обычно строительство стараются закончить к первым морозам. Однако и зимой работа может продолжаться, правда, не так интенсивно как летом. Поэтому бывает так, что, не успев сделать все в теплое время года, приходится завершать начатое в холода.
При работе с кладкой, одним из главных элементов является раствор, а в его состав входит вода. При низкой температуре она замерзает и это вызывает некоторые сложности. Помимо этого, существуют и другие проблемы, но с ними можно справиться.
Итак, вариантов кладки кирпича зимой может быть несколько. Один из них это замораживание. Этот способ позволит раствору замерзнуть сразу же после окончания укладки, а после повышения температуры, он немного подтает и застаивание продолжится.
Чтобы раствор не замерзал, зачастую применяют различные химические добавки, например, хлористый кальций и натрий. Таким образом, затвердевает он намного медленнее. Этот метод довольно популярен, так как очень прост и не требует больших затрат. Но стоит учесть тот факт, что работать с таким материалом можно при морозе до -5°С. Не стоит делать
Также есть метод, который называются «термос». Его суть состоит в том, что перед тем как класть кирпич на раствор, его сильно прогревают. Как только определенное количество уложено, кирпичи накрывают теплоизоляционным материалом, чтобы как можно дольше сохранить тепло. Возможно, некоторые подумают, что при сильном ветре и морозе остывание произойдет слишком быстро, но это не так. Такое могло случиться с одним кирпичом, но если их будет несколько, то тепло не только сохраниться, но и раствор схватится намного крепче.
Как только определенное количество уложено, кирпичи накрывают теплоизоляционным материалом, чтобы как можно дольше сохранить тепло. Возможно, некоторые подумают, что при сильном ветре и морозе остывание произойдет слишком быстро, но это не так. Такое могло случиться с одним кирпичом, но если их будет несколько, то тепло не только сохраниться, но и раствор схватится намного крепче.
Существует метод электроподогрева. Нашивные электроды прикрепляют к возведенной кирпичной стене так, чтобы они касались раствора. Далее включают электричество, раствор нагревается и передает тепло кирпичам. Этот процесс длится до того состояния, когда раствор хорошо пристанет.
Если же морозы очень сильные, то пользуются теплоизоляционными материалами, которыми максимально покрывают площадь. Чтобы эффект был хорошим, необходимо прогреть нижние ряды кирпичей, которые призваны стать основанием. В этом случае можно применять паяльную лампу, однако не перетрудитесь, так как слишком горячий 
Кроме того, иногда в местах, где ведутся строительные работы, устанавливают временное отопление. Таким образом, получается своеобразный парниковый эффект. Тщательно закрывают всевозможные щели и проемы, затем начинается прогревание участка. Это один из самых дорогостоящих способов, так как зачастую используют не печи «буржуйки», хотя и такой вариант возможен, а электрообогреватели.
Как видите, кладка зимой намного труднее, чем в летний период. Может произойти много неожиданностей, однако теперь вы о них знаете и сможете подготовиться к экстренной ситуации.
защита от замерзания дезинфицирующего раствора
Устройство дезбарьера, зимний подогрев дезинфицирующего раствора и необходимость его установки в животноводческих хозяйствах регламентируются Сводом правил СП 289.1325800.2017 «Сооружения животноводческих, птицеводческих и звероводческих предприятий. Правила проектирования». Приведём два пункта СП, представляющие интерес для нашей статьи:
6.
6.6.2 Въездной дезбарьер, как правило, размещается под навесом и представляет собой бетонную ванну, заполненную дезраствором.
Габариты ванны:
— длина по зеркалу дезраствора не менее 9 м
— длина по днищу не менее 6 м
— глубина ванны не менее 0,2 м
— ширина ванны должна быть не менее ширины ворот.
Приведём также строительный разрез устройства типового дезбарьера:
При проектировании любой кабельной электрической системы обогрева (КЭСО) поверхностей, как и в нашем случае, одним из главных решаемых вопросов является обоснованное определение и назначение установленной удельной мощности (Вт/м²).
Решаем задачу определения теплопотерь водного дезраствора, находящегося в бетонной ванне, соответствующей представленным схемам.![]() Пусть температура окружающего воздуха будет −20…-30 °С, а температура обогреваемого грунта на глубине 1…1,5 м составит приблизительно +5 °С. Основные потери тепла происходят здесь путём конвективной передачи тепла с поверхности воды, небольшие — за счёт излучения и теплопередачи через бетонные стенки ванны в грунт. Коэффициент теплоотдачи с поверхности раствора лежит в диапазоне 17…23 Вт/(м²•К). Известная формула даёт нам оценку необходимой удельной мощности: р
Пусть температура окружающего воздуха будет −20…-30 °С, а температура обогреваемого грунта на глубине 1…1,5 м составит приблизительно +5 °С. Основные потери тепла происходят здесь путём конвективной передачи тепла с поверхности воды, небольшие — за счёт излучения и теплопередачи через бетонные стенки ванны в грунт. Коэффициент теплоотдачи с поверхности раствора лежит в диапазоне 17…23 Вт/(м²•К). Известная формула даёт нам оценку необходимой удельной мощности: р
Для обеспечения такой сравнительно большой мощности обогрева удобно воспользоваться двухжильным нагревательным кабелем, также обладающим большой линейной мощностью теплоотдачи — DEVIsnow™ 30T (30 Вт/м). Установка его с шагом укладки 7,5 см обеспечит руд = 400 Вт/м²; при шаге укладки 6 см удельная мощность составит 500 Вт/м².
В представленных таблицах приведена номенклатура этих нагревательных кабелей, снабжённых на производстве «холодными» соединительными кабелями для подключения к промышленной сети питания переменного тока 230 В~ или 400 В~. Эти же типы кабелей можно приобрести в варианте поставки на бобинах: при поставке необходимо предварительно рассчитать требуемую длину нагревательных секций и подобрать необходимый код товара, чтобы изготовленная нагревательная секция имела достаточно большую линейную мощность (не более 30 Вт/м для DEVIsnow™ и не более 20 Вт/м для DEVIbasic™). Соединительные кабели требуемой длины можно подсоединить к нагревательному кабелю в этом варианте при помощи термоусадочных ремонтных наборов.
Терморегуляторы для автоматического управления обогревом дезинфицирующего раствора представлены двумя моделями: DEVIreg™ 330 и DEVIreg™ 610.
(PDF) Задачи к разделу Коллигативные свойства растворов
Extent of Metallization Poor iron Ore Raw Materials in the Context of local
conditions// IJARSET. Vol. 6, Issue 2, February 2019. pp. 8240 – 8242.
42. Юсупходжаев А.А., Арибжонова Д.Е., Толибова Х.Г., Маликова Ф.У.
Возможности расширения сырьевой базы Алмалыкского горно-
металлургического комбината на базе использования местных вторичных
техногенных образований// Актуальная наука. Россия, г. Волгоград, № 3.
2018. С. 28-30.
43. Юсупходжаев А.А., Арибжонова Д.Е., Матмусаев И. Технология
переработки вторичных техногенных образований в цветной металлургии//
12-я международная конференция по проблемам горной промышленности,
строительства и энергетики «Социально-экономические экологические
проблемы горной промышленности, строительства и энергатики», Том 1,
Тула-Минск-Донецк, 2-3 ноября 2016 г. С. 327-331.
С. 327-331.
44. Арибжонова Д.Е., Орифжонова Г.Б. Исследование путей повышения
эффективности работы мартеновских печей// Материалы VIII-
международной научно-технической конференции горно-металлургический
комплекс: достижения, проблемы и современные тенденции развития, Навои,
Узбекистан, 19-21 ноября, 2015 г. С. 235-237.
45. Арибжонова Д.Е., Орифжонова Г.Б. Исследование методов
подготовки к металлургической переработке шеелитовых концентратов//
Материалы VIII-международной научно-технической конференции горно-
металлургический комплекс: достижения, проблемы и современные
тенденции развития, Навои, Узбекистан, 19-21 ноября, 2015 г. С. 237-239.
46. Хожиев Ш.Т., Нусратуллаев Х.К., Акрамов У.А., Ирсалиева Д.Б.,
Мирсаотов С.У. Минералогический анализ шлаков медеплавильного завода
Алмалыкского горно-металлургического комбината// “Студенческий
вестник”: научный журнал, № 43(93). Часть 5. Москва, Изд. «Интернаука»,
Часть 5. Москва, Изд. «Интернаука»,
Ноябрь 2019. С. 62 – 64.
47. Хожиев Ш.Т., Зайниддинов Н.Ш., Мирсаотов С.У., Ирсалиева Д.Б.,
Мамараимов С.С., Муносибов Ш. Термогравитационное обеднение шлаков
медного производства // “Студенческий вестник”: научный журнал, № 43(93).
Часть 5. Москва, Изд. «Интернаука», Ноябрь 2019. С. 65 – 68.
48. Хожиев Ш.Т., Эркинов А.А., Абжалова Х.Т., Мирсаотов С.У.,
Мамараимов С.С. Использование металлургических техногенных отходов в
качестве сырье // “Студенческий вестник”: научный журнал, № 43(93). Часть
5. Москва, Изд. «Интернаука», Ноябрь 2019. С. 69 – 71.
49. Sh.T. Khojiev, A.A. Yusupkhodjaev, D.Y. Aribjonova, G.B. Beknazarova,
D.N. Abdullaev. Depletion of Slag from Almalyk Copper Plant with Aluminum
Containing Waste // International Journal of Innovative Technology and Exploring
Engineering, Volume-9, Issue-2, December 2019. P. 2831 – 2837. DOI:
DOI:
10.35940/ijitee.B7200.129219
50. Hojiyev Sh.T., Norqobilov Y.F., Raxmataliyev Sh.A., Suyunova M.N.
Yosh metallurg [Matn[: savol-javoblar, qiziqarli ma’lumotlar va metallar ishlab
chiqarish texnologik jarayonlari. – Toshkent: “Tafakkur” nashriyoti, 2019 . — 140 b.
ISBN 978-9943-24-273-9
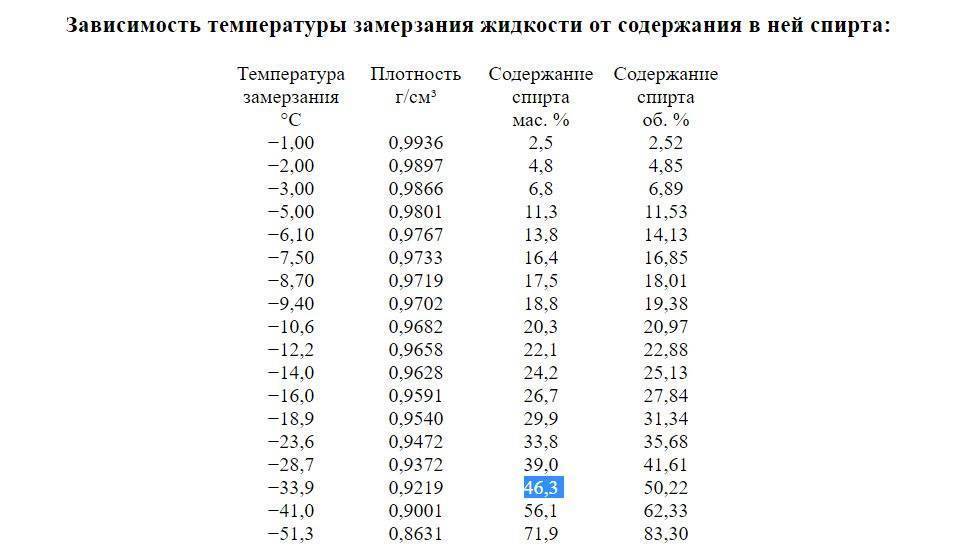
Поваренная соль, раствор, температура замерзания
В табл. 11 приведены температуры замерзания (начала кристаллизации) растворов поваренной соли. [c.48]Растворив в 100 л воды 30,1 кг поваренной соли, мы можем довести температуру замерзания рассола до —21,2°С. Однако дальнейшее повышение концентрации рассола вызывает уже не снижение, а повышение температуры замерзания. Раствор, имеющий наинизшую температуру замерзания, называется эвтектическим (рис. 14). [c.42]
В качестве холодильных рассолов используют водные растворы поваренной соли, хлористого магния и хлористого кальция.
 Кривые температур замерзания этих растворов показаны на рис. 9.14. По этим кривым выбирают растворы и их концентрации. Например, соответственно приведенным данным раствор хлористого натрия можно рекомендовать для температур не ниже —15°С. Рабочую концентрацию растворов надо выбирать по левой ветви кривой замерзания. Она должна быть на несколько процентов меньше концентрации, соответствующей криогидратной точке. [c.199]
Кривые температур замерзания этих растворов показаны на рис. 9.14. По этим кривым выбирают растворы и их концентрации. Например, соответственно приведенным данным раствор хлористого натрия можно рекомендовать для температур не ниже —15°С. Рабочую концентрацию растворов надо выбирать по левой ветви кривой замерзания. Она должна быть на несколько процентов меньше концентрации, соответствующей криогидратной точке. [c.199]Наиболее низкую температуру замерзания —21,2° С имеет раствор поваренной соли, содержащий 22,4% Na l. При этой температуре раствор указанного состава полностью замерзает. Из растворов более высокой концентрации при охлаждении сначала кристаллизуется поваренная соль, а из более разбавленных растворов сначала вымерзает вода и, когда концентрация достигает 22,4%) Na l, раствор полностью замерзает. Температуры начала кристаллизации растворов поваренной соли даны в приложении 5. [c.34]
Определение температуры замерзания растворов поваренной соли [c. 166]
166]
Коллигативные свойства можно использовать для определения молекулярной массы вещества. Например, если, зная массу т растворенного вещества, определить температуру замерзания (кипения) раствора, то. найдя понижение, повышение) температуры замерзания (кипения) раствора, можно вычислить число молей п раств оренного вещества, а затем и саму молекулярную массу вещества М = т1п. Таким образом можно определить степень диссоциации или ассоциации вещества в растворе. В этом случае следует умножить правую часть уравнений (355) и (356) на введенный Вант-Гоффом в соответствии с уравнением (322) коэффициент . Понижение температуры замерзания раствора повареной соли примерно в два раза больше, чем для раствора сахарозы той же моляльной концентрации. На практике чаще используют криоскопический метод, так как он более прост в экспериментальном исполнении, а кроме того, как правило, криоскопическая константа для одного и того же растворителя больше, чем эбулиоскопическая. Для растворителя камфары, например, =40 К-кг/моль. [c.281]
[c.281]
Однако на этом этапе ситуация усложнилась. Логично было предположить, что при растворении, например в воде, вещество распадается на отдельные молекулы. Однако наблюдаемое понижение температуры замерзания соответствовало предполагаемому только в тех случаях, когда растворялся неэлектролит, например сахар. При растворении электролита типа поваренной соли ЫаС1 понижение температуры замерзания вдвое превышало ожидаемое, т. е. число частиц, содержащихся в растворе, должно было быть в два раза больше числа молекул соли. А при растворении хлорида бария ВаСи число частиц, находящихся в растворе, должно было превышать число молекул втрое. [c.119]
Во избежание просаливания рыбы при замораживании применяют раствор поваренной соли с температурой, близкой к точке его замерзания, т. е. осмотически пассивный и почти исключающий возможность проникновения соли в ткани рыбы. Криогидратная температура раствора поваренной соли равна —21,2°, а следовательно, практически рассол может быть охлажден только до температуры —18°, при которой рыба обычно замораживается до [c.
 121]
121] Водные растворы солей. Классическим примером бинарной смеси с одним компонентом в одной из фаз может служить водный раствор поваренной соли (рис. 13,г). В состоянии А раствор концентрации = 1а при температуре tл является жидким. При / = 0° С и р = 1 атм он еще не замерзает, и только при более низкой температуре в точке Я образуются первые кристаллы льда, часть воды, вымерзая, переходит в твердую фазу, концентрация остаточного раствора постепенно увеличивается, и точка замерзания понижается. В точке Я устанавливается равновесие между жидким раствором концентрации и первыми кристаллами чистого льда ( = 0), причем обе фазы имеют одинаковые температуру и давление. Состояние смеси при дальнейшем охлаждении постепенно изменяется (от точки Я до Р) и тогда выпадает новая порция льда, а жидкая часть становится более концентрированной и достигает точки О, где раствор снова находится в равновесии, но уже при более низкой температуре. Кривая равновесия ВНОЕ — является кривой льда (40]. [c.37]
[c.37]
Все химически чистые вещества имеют определенные температуры (точки) замерзания и кипения вода замерзает при 0° и кипит ири 100 С (имеется в виду нормальное давление). У растворов этого пе наблюдается, они отличаются от чистых растворителей по свойствам. Присутствие растворенного вещества понижает температуру замерзания и повышает температуру кппенпя раствора. Поэтому водные растворы замерзают прп более низкой температуре, чем чистая вода. Чем копцентрированнее раствор, тем ниже точка его замерзания. Например, если в 100 г воды растворено 10 г поваренной соли, то раствор замерзает при —13,6 , а если растворить 30 г Na l, то он будет замерзать при —21,2 °С. Подобно этому, температура кипения водных растворов лежит выше 100 °С и зависит от копцептрацпи. Так, если в 100 г воды растворить 21 г хлористого кальция, то раствор закипит при 104 , а если растворить 69 г a L, — то при 120 °С. [c.113]
Для этой цели пользуются в качестве охлаждающей жидкости водными растворами солей, чаще всего поваренной соли. Такие растворы замерзают при температурах ниже 0°. Чем больше концентрация раствора соли, тем ниже (до известного предела) температура его замерзания. Обычно пользуются рассолом, содержащим около 20% соли и замерзающим при температуре —18°. Рассол предварительно охлаждают в специальной холодильной установке до температуры от —12° до —15° и затем подают в рубашки или змеевики охлаждаемых аппаратов. Воду и рассол вводят в рубашку или змеевик снизу, а отводят сверху. [c.97]
Такие растворы замерзают при температурах ниже 0°. Чем больше концентрация раствора соли, тем ниже (до известного предела) температура его замерзания. Обычно пользуются рассолом, содержащим около 20% соли и замерзающим при температуре —18°. Рассол предварительно охлаждают в специальной холодильной установке до температуры от —12° до —15° и затем подают в рубашки или змеевики охлаждаемых аппаратов. Воду и рассол вводят в рубашку или змеевик снизу, а отводят сверху. [c.97]
В погружных испарителях в качестве вторичного теплоносителя применяют водный раствор поваренной соли с удельным весом 1,16 и температурой замерзания —18,2°. При закрытых испарителях используют водный раствор хлористого кальция с удельным весом 1,22 и температурой замерзания —25,7°. [c.375]
В 1753—1756 гг. М. В. Ломоносов провел экспериментальные исследования водных растворов. Он был одним из первых ученых, поставивших себе целью изучить растворимость солей в воде при различных температурах. Им была изучена растворимость многих солей при различных температурах. М. В. Ломоносов наблюдал зависимость температуры замерзания растворов от количества растворенной соли. Он опытным путем установил, например, что растворы поваренной соли (а также морская вода) замерзают тем ниже, чем концентрированнее раствор. [c.17]
Им была изучена растворимость многих солей при различных температурах. М. В. Ломоносов наблюдал зависимость температуры замерзания растворов от количества растворенной соли. Он опытным путем установил, например, что растворы поваренной соли (а также морская вода) замерзают тем ниже, чем концентрированнее раствор. [c.17]
Хлорид натрия Na l (поваренная соль, галит, каменная соль) — белые кристаллы. Получается путем выпаривания рассолов и добычи в твердом состоянии. Используется без всякой обработки или в виде приготовленного солевого раствора при заканчивании и капитальном ремонте скважин (см. главу 10) для приготовления насыщенного водного раствора для разбуривания каменной соли для снижения температуры замерзания бурового раствора для повышения плотности (в виде взвешенной твердой фазы) в качестве закупоривающего материала в насыщенных растворах, а также в повышающих устойчивость ствола буровых растворах на углеводородной основе (см. главы 8 и 9). Концентрации от 30 до 360 кг/м . Потребление в 1978 г. 60 тыс. т. [c.496]
Потребление в 1978 г. 60 тыс. т. [c.496]
Температура кипения и з аме р з а н и я растворов. Растворы твердых веществ закипают при более высокой температуре и замерзают при более низкой температуре, чем чистые растворители. Морская вода, воды соленых озер замерзают несколько ниже 0°, а кипят несколько выше 100°. Лед может существовать при 0°, но известно, что если лед посыпать поваренной солью, то он начнет таять. Температура замерзания раствора поваренной соли лежит ниже той температуры, при которой находится лед, поэтому он ве может оставаться в твердом состоянии вместе с поваренной солью и тает. При таянии льда происходит большое поглощение теплоты, вызывающее сильное охлаждение. Это обстоятельство часто используется в химических и других работах для искусственного получения низких температур. С этой целью готовят специальные охлаждающие смеси . Смесью 3 весовых частей снега или толченого льда с одной весовой частью поваренной соли Na l достигается снижение температуры до—22°. Смесью одной части снега с 1,4 части хлорида кальция a lj eHjO достигается снижение температуры до —55°. [c.64]
Смесью одной части снега с 1,4 части хлорида кальция a lj eHjO достигается снижение температуры до —55°. [c.64]
При отрицательной температуре воздуха гидравлические испытания аппаратов производят с помощью подогретой паром воды или специальных водных растворов, имеющих низкую температуру замерзания. Обычно для этих целей используют растворы хлористого кальция или хлористого натрия (поваренную соль) [c.42]
Температура таяния льдосоляной смеси и ее охлаждающий эффект, т. е. холодопронзводительность, зависят от количества и сорта соли, находящейся в смеси. При использовании технической поваренной соли (ЫаС1) температура охлаждения может достигнуть — 16-г—18 С, при использовании хлористого кальция (СаС12) — более низких температур (—46- —48° С). С повышением содержания соли в льдосоляной смеси температура ее плавления и равная ей температура замерзания раствора соответствующей концентрации понижается. Раствор соли с наи-низшей температурой замерзания называется эвтектическим, а температура замерзания эвтектического раствора, называется криогидратной температурой или криогидратной точкой. [c.28]
Раствор соли с наи-низшей температурой замерзания называется эвтектическим, а температура замерзания эвтектического раствора, называется криогидратной температурой или криогидратной точкой. [c.28]
Известно, что растворенные в воде вещества, в том числе поваренная соль и сахар (сахароза), понижают температуру замерзания растворов. Поэтому можно не бояться охлаждения банок с вареньем или солеными огурцами на 1—2 градуса ниже нуля, это не принесет вреда. Но при сильном морозе консервы могут замерзнуть, и хотя пищевая ценность при этом не изменится, внешний вид и вкус продукта пострадают непоправимо кристаллы льда повредят оболочки растительных клеток, сок вытечет, фрукты и овощи станут мягкими и дряблыми. Перемороженные огурцы годятся разве что на рассольник. [c.68]
Экспериментально измеренное осмотическое давление растворов солей, кислот и оснований оказывается всегда больше теоретически рассчитанного. Наоборот, молекулярный вес этих веществ, рассчитанный по повышению температуры кипения или по понижению температуры замерзания растворов, меньше теоретического. Так, теоретический молекулярный вес (масса) поваренной соли 58,5, а измеренный криоскопическим методом — 30,1. Молекулярный вес хлористого калия, вычисленный по повышению температуры кипения раствора, равен 38,7, а теоретический — 74,5. [c.172]
Так, теоретический молекулярный вес (масса) поваренной соли 58,5, а измеренный криоскопическим методом — 30,1. Молекулярный вес хлористого калия, вычисленный по повышению температуры кипения раствора, равен 38,7, а теоретический — 74,5. [c.172]
Свойство поваренной соли понижать в растворе температуру замерзания воды с древних времен используется для борьбы с гололедом на дорогах. Предприятия коммунального и дорожного хозяйства в зимнее время года давно применяют поваренную соль для посыпки дорог, для предупреждения аварий и травматизма. На посыпку дорог используется в основном попутная соль калийных производств. По данным ГИПРОДОРНИИ, потребность в поваренной соли только для автодорожных предприятий РСФСР к 1990 г. составит 1,8 млн. т/год. [c.16]
Температура охлаждающей воды, текущей по змеевикам и другим охлаждающим элементам, не может быть ниже 0°, так как при олее низкой температуре она замерзает. При необходимости иметь более низкие температуры пользуются в качестве охлаждающей жидкости не чистой водой, а водными растворами солей, чаще всего поваренной соли. Такие растворы замерзают при температурах ниже 0°, причем чем крепче раствор, тем ниже (До извест ного предела) его температура замерзания. На практике обычно пользуются рассолами крепостью приблизительно 20%, замерзающими при температуре около —18°. Охлаждение таких рассолов производится на специальных холодильных установках, откуда рассол с температурой обыч.чо от —12° до —15° подается центробежными насосами в охлаждающие элементы аппаратов — змеевики, рубашки, 228 [c.228]
Такие растворы замерзают при температурах ниже 0°, причем чем крепче раствор, тем ниже (До извест ного предела) его температура замерзания. На практике обычно пользуются рассолами крепостью приблизительно 20%, замерзающими при температуре около —18°. Охлаждение таких рассолов производится на специальных холодильных установках, откуда рассол с температурой обыч.чо от —12° до —15° подается центробежными насосами в охлаждающие элементы аппаратов — змеевики, рубашки, 228 [c.228]
Известно, что температура замерзания растворителя понижается при растворении в нем нелетучего вещества. Например, вода, замерзающая при О °С, не замерзает при той же температуре в том случае, когда в нее добавлена поваренная соль или хлористый кальций, температура замерзания понижается. Вообще, растворы замерзают при более низких температурах, чем чистые растворители. Эффект понижения температуры замерзания жидкости при растворении в ней твердого вещества используется в методе криоскопии. Заметим, что величина, на которую понижается температура замерзания, зависит от числа молекул растворенного вещества в единице объема раствора и не зависит от их размеров (массы) и химической природы. Это означает, что если метод криоскохши применяют для определения молекулярной массы полимера, то получается среднечисловая молекулярная масса М . Если обозначить снижение температуры замерзания как ДГотв> то его связь с М и концентрацией определяется следующим уравнением [c.304]
Заметим, что величина, на которую понижается температура замерзания, зависит от числа молекул растворенного вещества в единице объема раствора и не зависит от их размеров (массы) и химической природы. Это означает, что если метод криоскохши применяют для определения молекулярной массы полимера, то получается среднечисловая молекулярная масса М . Если обозначить снижение температуры замерзания как ДГотв> то его связь с М и концентрацией определяется следующим уравнением [c.304]
Для выполнения эксперимента необходимы следующее оборудование и реактивы прибор для определения понижения температуры замерзания водных растворов бюретка для титрования — 2 шт. пипетка на 15 мл пипетка на 10 мл колба для титрования на 100 мл снег или лед поваренная соль раствор 0,6 М USO4 в 5 М растворе аммиака раствор HG1 0,1 М раствор NaOH 0,1 М раствор метилоранжа 20%-ный раствор KI раствор ЫагЗгОз 0,1 М раствор крахмала. [c.353]
При замерзании рассола с концентрацией ниже криогидратной точки сна-члт выделяется лед, поэтому левую ветвь можно назвать кривой выделения льда. Например, если охлаждать раствор поваренной соли, имеюпщй концентрацию 15%, то до температуры —11°С (точка а) концентрация его будет постоянной, а при дальнейшем охлажде- W 20 30 40 НИИ начнется выделение льда. Концентрация оставшегося жидкого раствора р с. и. Диаграмма темпера-будет увеличиваться по левой ветви кри- тур затвердевания рассолов, вых, а температура затвердевания будет [c.35]
Например, если охлаждать раствор поваренной соли, имеюпщй концентрацию 15%, то до температуры —11°С (точка а) концентрация его будет постоянной, а при дальнейшем охлажде- W 20 30 40 НИИ начнется выделение льда. Концентрация оставшегося жидкого раствора р с. и. Диаграмма темпера-будет увеличиваться по левой ветви кри- тур затвердевания рассолов, вых, а температура затвердевания будет [c.35]
В качестве рассолов применяют водные растворы хлористого натрия N801 (поваренной соли) и хлористого кальция СаСЬ, которые имеют достаточно низкие температуры замерзания и дешевы. Растворы пригодны для использования лишь при температурах, превышающих те, при которых они замерзают как однородная смесь, образуя соленый лед (криогидратная точка). Криоги-дратной точке для раствора ЫаС1 с концентрацией 22,4% (по весу раствора) соответствует температура минус 21,2° С, а для раствора СаСЬ с концентрацией 29,9%—температура минус 55° С. Поэтому для получения низких температур применяется СаСЬ. [c.245]
[c.245]
Характерным для рассолов, как это показано на рис. 7.1, является следующее. При температуре замерзания из рассолов, концентрация которых менее 22,4% Na I, выпадают кристаллы льда, не содержащие поваренной Обсоли. Поэтому по мере охлаждения gg таких рассолов концентрация Na l в растворе возрастает, при ми-нус 21,2 °С содержание поварен-ной соли в растворе достигает [c.227]
При колонковом буренпп скважин в устойчивых породах может быть применена промывка водой. При бурении скважин в породах малоустойчивых (пористых и сыпучих) промывка осуществляется глинистым раствором. При бурении в вечной мерзлоте приходится пршменять сильно охлажденные растворы поваренной соли в глинистом растворе с температурой замерзания более низкой, чем температура почвы. [c.8]
Таким образом, замерзание растворов солей, а следовательно, и плавление льдосоляных смесей, происходит при переменной температуре, величина которой связана с концентрацией соли в жидкой фазе. Только раствор состояния 3, имеющий эвтектическую концентрацию д, при достаточном охлаждении замерзает при постоянной температуре 4, а замороженный раствор эвтектической концентрации, называемый эвтектическим льдом или звтек-тиком, плавится при этой же постоянной и наинизшей температуре для смесей льда и данной соли. Так, смесь льда и хлорида калия, содержащая 19,3% по массе соли, представляет собой эвтектическую смесь, плавящуюся при температуре —11,Г С эвтектическая смесь льда и поваренной соли содержит 23,1% соли и плавится при температуре —21,2° С эвтектическая смесь льда и хлорида кальция, в составе которой 29,9% соли, плавится при —55° С. На рис. 10.6 область Л Р между линией А и изотермой эвтектической температуры t , отвечает сосуществованию двух фаз льда и раствора. Соотношение между массами отдельных фаз определяется, как в любых двухфазных системах, по правилу рычага. В свою очередь, область С + Р соответствует двухфазному состоянию смеси соли и раствора. При температурах ниже эвтектической смеси льда и соли могут существовать только в твердом состоянии.
Только раствор состояния 3, имеющий эвтектическую концентрацию д, при достаточном охлаждении замерзает при постоянной температуре 4, а замороженный раствор эвтектической концентрации, называемый эвтектическим льдом или звтек-тиком, плавится при этой же постоянной и наинизшей температуре для смесей льда и данной соли. Так, смесь льда и хлорида калия, содержащая 19,3% по массе соли, представляет собой эвтектическую смесь, плавящуюся при температуре —11,Г С эвтектическая смесь льда и поваренной соли содержит 23,1% соли и плавится при температуре —21,2° С эвтектическая смесь льда и хлорида кальция, в составе которой 29,9% соли, плавится при —55° С. На рис. 10.6 область Л Р между линией А и изотермой эвтектической температуры t , отвечает сосуществованию двух фаз льда и раствора. Соотношение между массами отдельных фаз определяется, как в любых двухфазных системах, по правилу рычага. В свою очередь, область С + Р соответствует двухфазному состоянию смеси соли и раствора. При температурах ниже эвтектической смеси льда и соли могут существовать только в твердом состоянии. Область Л + Э является зоной существования смеси льда и эвтектика, а область С + Э — смеси соли и эвтектика. [c.322]
Область Л + Э является зоной существования смеси льда и эвтектика, а область С + Э — смеси соли и эвтектика. [c.322]
Штукатурные растворы для зимних работ.
Цементно-песчаные растворы для зимней штукатурки и других работ имеют различные химические добавки. Для оштукатуривания стен снаружи используются цементные растворы, которые приготавливаются на хлористой воде. Полученные растворы хорошо «ложатся» при разных штукатурных работах даже при температуре воздуха до -27 ºС без дополнительного обогрева штукатурки.
● Для начала необходимо приготовить
хлорированную воду — для этого в большую
ёмкость (котёл или бочку) наливается вода и
подогревается до температуры +35 ºС, далее к
подогретой воде добавляется хлористая известь
(хлорка) из расчёта 12-15 частей хлористой
извести на 100 литров воды и размешивается до
тех пор, пока не растворится вся хлорка. Полученное таким образом «молока» отстаивается
не менее 1-2 часов. Запрещается использовать
воду, которая не отстоялась положенное время —
если в штукатурку попадёт ил или муть
хлорированного молока, то это приведёт к
появлению трещин во время высыхания
оштукатуренной поверхности.
Полученное таким образом «молока» отстаивается
не менее 1-2 часов. Запрещается использовать
воду, которая не отстоялась положенное время —
если в штукатурку попадёт ил или муть
хлорированного молока, то это приведёт к
появлению трещин во время высыхания
оштукатуренной поверхности.
● После приготовления водяного раствора можно приступать к приготовлению самого цементного раствора, с которым можно будет начать работы по оштукатуриванию кирпичных, шлакоблочных и деревянных поверхностей. Для оштукатуривания этих поверхностей растворы с добавлением хлорированного молока приготавливаются на следующих составах:
— 1 часть цемента;
— 1 часть известкового теста;
— 6 частей песка
или
— 1 часть цемента;
— 1,5 части — смесь молотого шлака и глины;
— 6 частей песка.
● Подобные растворы применяются для оштукатуривания различных поверхностей, но необходимо помнить, что во время приготовления цементных и других растворов температура хлорированной воды была не менее +10 ºС. При отрицательных температурах окружающей среды строительные растворы приготавливаются в отапливаемых помещениях.
● При
температуре окружающего воздуха ниже 0 ºС
невозможно использовать обычные строительные
растворы — вода в них замерзает и
прекращаются вызывающие твердение химические реакции. Чтобы раствор не замерзал, в него
вводят специальные противоморозные добавки,
способствующие уменьшению температуры замерзания: поташ, нитрит
натрия, аммиачную воду и др. Применяются также
растворы на молотой негашёной извести, но только
в том случае, когда тепловыделение от гашения
извести достаточно для того, чтобы предотвратить
замерзание раствора.
● Растворы с добавлением поташа используются при температуре до -30 ºС. Поташ или карбонат калия представляет собой гигроскопичный и легко растворяющийся в воде порошок белого цвета. Водный раствор поташа является сильной щёлочью и может вызвать ожог. Работать с ним нужно осторожно. В растворы поташ добавляется вместе с водой затворения. Дозировка поташа зависит от температуры наружного воздуха. При температуре наружного воздуха от 0 до -5 ºС добавляют 5% поташа от массы цемента, при температуре от -6 до -10 ºС добавляют 10% и от -16 до -30 ºС — 15 %.
● Поташ добавляется в цементные и цементно-глиняные растворы, приготовляемые на портландцементе при соблюдении определённых условий:
— цементные растворы
должны быть такого состава, чтобы на одну часть
цемента приходилось не менее трёх частей
заполнителя;
— в цементных растворах количество
глиняного теста не должно превышать 40% объёма
цемента.
● Растворы с использованием поташа приготавливаются на составляющих, подогретых с таким расчётом, чтобы температура раствора при укладке была 5-10 ºС. Эти растворы используются не позднее, чем через час после их приготовления. Работать с ними нужно в комбинезонах, очках и осторожно с соблюдением правил безопасности.
● Растворы с нитритом натрия применяются при
температуре до -15 ºС. На строительные объекты нитрит
натрия поступает в виде порошка или
концентрированного раствора. В растворные смеси
его вводят в виде раствора малой концентрации с
водой затворения. Количество добавляемого
нитрита натрия зависит от температуры наружного
воздуха. При температуре воздуха до -5 ºС
добавляют 5%, при температуре от -6 до -9 ºС — 8%, от -10 до -15
ºС добавляют 10%.
● Добавлять нитрит натрия лучше всего в растворы на портландцементе. Использование нитрита натрия в растворах на шлакопортландцементе уменьшает скорость нарастания их прочности. Не допускается применять нитрит натрия в растворах на глинозёмистом цементе.
● При использовании нитрита натрия необходимо строго соблюдать правила безопасности. Все ёмкости с растворами нитрита натрия должны иметь предупредительную надпись «Яд». Растворы с аммиачной водой используют при температуре наружного воздуха до -15 ºС. Растворы затворяют аммиачной водой 6%-ной концентрации. Если доставленная на стройку аммиачная вода более высокой концентрации, её разбавляют водой. На аммиачной воде можно приготовлять только цементные и цементно-известковые растворы.
● Температура аммиачной воды, как и температура
растворов, приготовленных на ней, должна быть
2-5 ºС, так как
при более высокой температуре растворённый в
воде аммиак начинает быстро
улетучиваться. @»C»# при нормальном давлении.
@»C»# при нормальном давлении.
Теперь разница между температурой замерзания чистого растворителя и температурой замерзания раствора определяется разницей точки замерзания , которую можно рассчитать с помощью уравнения
#color(blue)(|bar(ul(color(white)(a/a)DeltaT_f = i * K_f * bcolor(white)(a/a)|)))#
Здесь
#DeltaT_f# — депрессия точки замерзания;
#i# — фактор Вант-Гоффа
#K_f# — криоскопическая константа растворителя;
#b# — моляльность раствора
Задача дает вам криоскопическую постоянную для воды
#K_f = 1.(-)#
Обратите внимание, что каждый моль йодида натрия, растворенный в растворе, дает два моля частиц растворенного вещества, то есть ионов.
Это означает, что коэффициент Вант-Гоффа, который говорит вам об отношении, существующем между тем, сколько молей растворенного вещества вы растворяете, и числом молей частиц растворенного вещества, образующихся в растворе, будет равен #2#
#i = 2 -># один моль растворенного вещества, два моля образовавшихся ионов
Моляльность раствора определяется как число молей растворенного вещества, присутствующего в в одном килограмме растворителя . {\circ} \mathrm{C}. При какой температуре замерзнет лимонный сок, если его эффективная моляльность эквивалентна 10,0 м3 раствора глюкозы?
{\circ} \mathrm{C}. При какой температуре замерзнет лимонный сок, если его эффективная моляльность эквивалентна 10,0 м3 раствора глюкозы?
Стенограмма видео
добрый день. Тема о отрицательных свойствах. При добавлении салюта в растворитель. Образующийся раствор обладает свойствами, отличными от свойств чистого растворителя. В частности, раствор замерзает при более низкой температуре, чем мол, определяя как таковую точку замерзания.Депрессия является одним из совместных свойств среди многих. Когда мы растворяем неэлектролитические и нелетучие вещества, это означает, что я приветствую то, что не растворяется в железе, и приветствую то, что не испаряется из раствора. Тогда давление паров, а точнее температура замерзания раствора, который носится с ним, решается следующим образом. У нас температура замерзания раствора равна температуре замерзания растворителя. Вычислите skf, умноженное на M, где K F — константа температуры замерзания, значение которой зависит от природы растворителя и M. Теперь мораль. Итак, давайте предположим, что у нас есть раствор лимонного сока, который мы можем принять, чтобы иметь эффективную модальность, равную на 10 больше, чем это. Я лимонный сок состоит в основном из воды, поэтому мы берем растворитель в этом типе раствора как воду и хотим найти точку замерзания раствора. Таким образом, лимонный сок не является электролитическим и нелетучим. Таким образом, мы можем использовать решение для формулы, которую мы установили выше, которая является F. Решение равно TF растворителя минус K. F. Спасибо им.Там, где точка замерзания растворителя, которым является вода, равна 0 ° C, как мы знаем, это точка замерзания воды при нормальных атмосферных условиях, для которых они есть, постоянная точки замерзания составляет 1,86. Исследование было квадратным Морганом. Итак, опять же, это зависит от природы растворителя. Если это так, но если растворитель не вода, то мы имеем другое значение KF. И мораль на 10 больше, чем дано. Теперь нам просто нужно заменить это.
Теперь мораль. Итак, давайте предположим, что у нас есть раствор лимонного сока, который мы можем принять, чтобы иметь эффективную модальность, равную на 10 больше, чем это. Я лимонный сок состоит в основном из воды, поэтому мы берем растворитель в этом типе раствора как воду и хотим найти точку замерзания раствора. Таким образом, лимонный сок не является электролитическим и нелетучим. Таким образом, мы можем использовать решение для формулы, которую мы установили выше, которая является F. Решение равно TF растворителя минус K. F. Спасибо им.Там, где точка замерзания растворителя, которым является вода, равна 0 ° C, как мы знаем, это точка замерзания воды при нормальных атмосферных условиях, для которых они есть, постоянная точки замерзания составляет 1,86. Исследование было квадратным Морганом. Итак, опять же, это зависит от природы растворителя. Если это так, но если растворитель не вода, то мы имеем другое значение KF. И мораль на 10 больше, чем дано. Теперь нам просто нужно заменить это. Сделайте то же самое для TF решения, и мы получим ноль минус 1.86. Я стану Когда это равно минусу 18,6. Отсюда, как и следовало ожидать, температура замерзания порядка температуры замерзания раствора ниже нуля, что в данном случае отрицательно 18,6. Надеюсь, это поможет.
Сделайте то же самое для TF решения, и мы получим ноль минус 1.86. Я стану Когда это равно минусу 18,6. Отсюда, как и следовало ожидать, температура замерзания порядка температуры замерзания раствора ниже нуля, что в данном случае отрицательно 18,6. Надеюсь, это поможет.
Понижение температуры замерзания – это снижение равновесной температуры замерзания. или температура плавления растворенных веществ в жидкой фазе. Растворенные вещества в жидкая фаза также повышает равновесную температуру кипения.Давление также влияет на температуру замерзания (немного) и температуру кипения (сильно). На этой странице дается простое, не математическое объяснение всех этих последствия. Хотя явления более общие, вода дается как знакомый пример, из-за вопросов типа:
 ) )Почему вещества плавятся и кипятят?Если немного упростить, температура является мерой того, сколько энергии содержится в молекулярном движении. Чтобы начать с явного примера, давайте рассмотрим воду. Когда вода молекулы достаточно холодные, у них не так много тепловой энергии, поэтому они не толкаться вокруг слишком много. Следовательно, они могут собираться вместе в очень организованная структура, называемая льдом. При достаточно высоких температурах они имеют так много энергии, что они могут избежать притяжения своих соседей.Так они образуют пар, в котором молекулы разлетаются во все стороны в очень беспорядочный путь. При средних температурах это означает, что молекулы иметь умеренное количество энергии (и если давление высокое достаточно*) они образуют жидкую воду. Здесь у молекул достаточно энергии передвигаться, но недостаточно, чтобы полностью сбежать от соседей. Молекулы в жидкой воде более упорядочены, чем в паре, но менее упорядочены.
чем лед.(На примере порядка в жидкости можно заметить, что
центр каждой молекулы находится на расстоянии примерно одного молекулярного диаметра от центра
его ближайших соседей.) Молекулы в жидкой воде более упорядочены, чем в паре, но менее упорядочены.
чем лед.(На примере порядка в жидкости можно заметить, что
центр каждой молекулы находится на расстоянии примерно одного молекулярного диаметра от центра
его ближайших соседей.)Почему перемена такая внезапная? При атмосферном давлении вода плавится при 0°С и кипит при 100°С. От чего зависит температура плавления и кипения точка? Ответ — компромисс между молекулярной энергией (которую мы замечаем как температура) и молекулярный порядок: разница между высоко организованная структура во льду, достаточно плотная упаковка в жидкой воде и почти полная дезорганизация в паре.При 0°С и 100°С порядок эффект и энергетический эффект точно сбалансированы, поэтому лед и вода сосуществуют при 0°C, вода и пар сосуществуют при 100°C (при атмосферном давление).
 размеры, поэтому на рисунках ниже схематично показан более простой
кристаллическая, жидкая и паровая фазы. Узорчатые круги представляют
упрощенно то вещество, при плавлении и испарении которого мы
интересно.Цветные круги представляют собой молекулы воздуха, которые
в основном азот. Черные кружки (следующее изображение) обозначают растворенные вещества.
Эскизы не в масштабе. размеры, поэтому на рисунках ниже схематично показан более простой
кристаллическая, жидкая и паровая фазы. Узорчатые круги представляют
упрощенно то вещество, при плавлении и испарении которого мы
интересно.Цветные круги представляют собой молекулы воздуха, которые
в основном азот. Черные кружки (следующее изображение) обозначают растворенные вещества.
Эскизы не в масштабе.Воздействие растворенных веществЧто произойдет, если вместо чистого жидкая вода, мы кладем немного соли или сахара в воду? Другими словами, что если наша жидкая фаза является раствором? Это делает жидкое состояние менее организованы, потому что молекулы сахара или ионы соли могут свободно перемещаться почти случайно.Таким образом, молекулы жидкой воды более разупорядочены (менее регламентировано) в растворе. Лед и пар остаются нетронутыми, однако: сахар и соль почти не растворяются во льду и не испаряться около 100°С. Как это влияет на компромисс между молекулярной энергией и молекулярный порядок? Прирост беспорядка при испарении теперь меньше, т.к. жидкая вода в растворе более неупорядочена. Энергетический эффект – это почти не изменились, поэтому энергетический эффект теперь преобладает над чуть большей диапазон: молекулы воды в растворе должны иметь несколько больше энергия (немного более высокая температура), чтобы два эффекта были в балансе.Поэтому температура кипения раствора выше. И наоборот, когда мы смотрим на плавление, эффект беспорядка больше для раствор: при плавлении в раствор молекулы воды переходят из верхней порядок кристаллического льда в еще более неупорядоченное состояние, чем чистый жидкость. Поэтому эффект беспорядка может доминировать даже при более низких температурах. Так температура замерзания ниже для раствора. Выше я упомянул равновесные температуры замерзания и кипения. Водный раствор имеет более высокую температуру кипения и более низкую температуру замерзания точка, чем чистая вода.Если раствор не слишком концентрированный, эти два эффекта примерно не зависят от растворенного вещество: молекула сахара имеет почти такой же эффект, как ион соли. Так, при условии, что вы не забываете считать каждый ион отдельно, эффект концентрации при повышении температуры кипения или понижении температуры замерзания. почти то же самое для всех малых растворенных веществ в воде.(Макромолекулы, такие как
полимеры ведут себя по-разному, потому что у них много соседних растворителей
молекулы и поэтому влияют на растворитель гораздо больше, чем простые растворенные вещества.) почти то же самое для всех малых растворенных веществ в воде.(Макромолекулы, такие как
полимеры ведут себя по-разному, потому что у них много соседних растворителей
молекулы и поэтому влияют на растворитель гораздо больше, чем простые растворенные вещества.) Антифриз. Итак, можно ожидать, что антифриз в
радиатор не только предотвращает его замерзание, но и помогает предотвратить его закипание.
Однако реальная ситуация сложнее: у антифриза
Недостаток в том, что он не так хорошо переносит тепло, как вода.Этиленгликоль является антифризом. Соль используется для таяния снега и льда на
дорогах в холодных странах, но в радиаторах не используется, т.к.
вызывает коррозию и легко кристаллизуется. Сахар не используется в некоторых
приложений, потому что концентрированные растворы сахара вязкие, и
потому что они поддерживают ошибки. Однако многие организмы используют сахара и другие
небольшие органические молекулы в качестве антифриза. Интересное наблюдение: концентрация растворенных веществ в крови меньше, чем в морской воде, поэтому равновесная температура замерзания крови обычно выше, чем у морской воды.Следовательно, некоторые арктические и антарктические рыбы живут при температурах ниже равновесной температуры замерзания нормальной крови. Биоантифриз в их крови — это белок, который работает иначе, чем антифриз, используемый в автомобильных радиаторах: белок антифриза связывается с замерзающими ядрами и, таким образом, позволяет крови оставаться переохлажденной. Эффект давленияОбратите внимание, что выше я включил оговорку «при атмосферном давлении» несколько раз.Причина давления важно то, что в паровой фазе данное количество вещества занимает гораздо больший объем, чем в жидком состоянии. Часть энергии необходимое для испарения, оно направлено на то, чтобы «вытолкнуть воздух с дороги», чтобы освободить место для испарившегося количества. (объем выполненной работы равен
произведение давления P на изменение объема ΔV. Технически там
является членом PΔV в скрытой теплоте.) Таким образом, при низком давлении легче
образуют паровую фазу, поэтому температура кипения ниже.Зависимость
температура перехода от давления — эффект Клаузиуса-Клапейрона.
(Опять же, будучи немного техническим, отметим, что этот эффект включает в себя энергию —
работа, совершаемая при вытеснении воздуха, тогда как эффект растворенного вещества включает
энтропия — неупорядоченность жидкой фазы.) (объем выполненной работы равен
произведение давления P на изменение объема ΔV. Технически там
является членом PΔV в скрытой теплоте.) Таким образом, при низком давлении легче
образуют паровую фазу, поэтому температура кипения ниже.Зависимость
температура перехода от давления — эффект Клаузиуса-Клапейрона.
(Опять же, будучи немного техническим, отметим, что этот эффект включает в себя энергию —
работа, совершаемая при вытеснении воздуха, тогда как эффект растворенного вещества включает
энтропия — неупорядоченность жидкой фазы.)Вода сильно расширяется при кипячении: один килограмм воды равен одному литру жидкой воды, а превращается примерно в 1700 литров пара при атмосферном давление.Это означает, что даже незначительное увеличение высоты может заметно снизить температуру кипения. Некоторые люди жалуются, что это влияет приготовление и даже вкус чая на высоте. Верно и то, что давление меняет температуру плавления. Вода является одним из очень редких веществ, расширяющихся при замерзании. (вот почему лед плавает). Следовательно, его температура плавления очень незначительно падает при повышении давления.
 Его часто записывают как dP/dT = L/T*Δv. (Как мы могли бы иметь
угадывается из соображений размерности, т. е. просто пишется уравнение с соответствующими параметрами, чтобы единицы измерения были правильными.) Его часто записывают как dP/dT = L/T*Δv. (Как мы могли бы иметь
угадывается из соображений размерности, т. е. просто пишется уравнение с соответствующими параметрами, чтобы единицы измерения были правильными.) Вес фигуриста, скажем, 1 кН. Я не фигурист, но давайте начнем с оценки площади контакта конька со льдом, скажем, 100 мм 2 . (Значение зависит от того, насколько далеко конек врезается в лед. Скажем, 200 мм в длину и 0,5 мм в ширину: конькобежцы, разумно ли это?) Таким образом, с этим значением давление увеличивается на (1 кН)/100 мм 90 196 2 = 10 МПа или 100 атмосфер. Килограмм воды (один литр) замерзает, чтобы дать
около 1,1 литра льда, поэтому изменение удельного объема составляет примерно
10 -4 м 3 кг -1 .Скрытая теплота
плавления льда 330 кДж.кг -1 . Таким образом, пропорциональное изменение
по температуре
(10 МПа)(10 -4 м 3 кг -1 )/(330 кДж. Если оставить в стороне эффект Клаузиуса-Клапейрона и в условиях лишь небольшого приложенного давления, можно ожидать, что поверхность льда уже несколько
скользко. На поверхности льда у молекул воды есть только возможности для водорода
связи со своими соседями «с одной стороны», так сказать. Следовательно, их энергия
не так низко, как в насыпном льду.Значит, в равновесии они должны иметь более высокое
энтропия. Так, даже при отрицательных температурах лед должен иметь на поверхности тонкий водообразный слой,
толщина, как ожидается, будет увеличиваться при температурах, близких к температуре плавления. [ ПС. Спустя несколько лет после написания этой статьи я рад сообщить, что недавнее научное исследование подтверждает идею о том, что поверхностный слой льда делает его скользким, а не понижение точки замерзания. Сопоставимый расчет изменения точки кипения немного больше. сложный.Скрытая теплота в этом случае больше (2,3 МДж -1 ), но изменение удельного объема значительно больше (обычно в несколько раз 10 -2 м 3 кг -1 ). Итак, изменения в высота может изменить температуру кипения, а подъем в гору может уменьшить его на несколько градусов. Когда температура кипения и температура замерзания равный? Что происходит тогда?Для всех веществ при понижении давления кипение температура падает гораздо быстрее, чем температура замерзания.(Для воды температура замерзания немного повышается при низком давлении.) Отсюда очевидный вопрос: являются ли температура кипения и замерзания температура всегда одинаковая? Да. * Это объясняет, почему выше я писал, что жидкая вода существует только в том случае, если
давление достаточно высокое. При давлении ниже 611 Па
только две фазы, а лед возгоняется с образованием пара напрямую, минуя
через жидкую фазу. (В этом контексте обратным словом «возвышать» является
а не, как можно было бы надеяться, «высмеивать».При низком давлении пар
конденсируется, образуя лед. |
Расслабьтесь, приготовив домашние смузи
Ключевые понятия
Химия
Пищевая наука
Замораживание
Решение
Введение
Вы любите ледяные напитки? Слякоть настолько близка к жидкому льду, насколько это вообще возможно: холоднее, чем вода, но более пригодна для питья, чем лед! Используя некоторые предметы домашнего обихода, немного терпения и помощь науки, вы можете приготовить этот вкусный сладкий напиток дома.Попробуйте это занятие, и вы будете вознаграждены восхитительным угощением!
Фон
Слаши — это густой ледяной напиток, напоминающий толщину тающего снега. Смузи можно приготовить двумя способами: можно ароматизировать мелко измельченный лед или изменить процесс замораживания ароматизированной воды так, чтобы образовались рыхлые ледяные кристаллы. Встряхивание жидкости при сохранении температуры замерзания делает именно это.
Температура замерзания вещества – это температура, при которой вещество переходит из жидкого состояния в твердое.Для чистой воды (h3O) это 0 градусов по Цельсию или 32 градуса по Фаренгейту. При этой температуре частицы воды начинают слипаться и образовывать решетку или кристаллическую твердую структуру.
Растворение соли в чистой воде снижает ее температуру замерзания. Это происходит потому, что частицы соли мешают склеиванию частиц воды. Это явление называется депрессией точки замерзания. Соль — не единственное вещество, понижающее температуру замерзания воды, но очень эффективное и общедоступное.Растворение других частиц, таких как сахар, имеет аналогичный, но меньший эффект. Как правило, чем больше частиц плавает в фиксированном объеме воды, тем ниже будет ее температура замерзания.
Любопытно узнать, как понижение температуры замерзания может помочь нам в приготовлении слякоти в домашних условиях? Выполните это задание, чтобы узнать!
Материалы
- Вода
- Поваренная соль
- Мерные стаканы
- Чайная ложка
- Маленькая чаша для смешивания
- Четыре пакета для сэндвичей на молнии
- Морозильник
- Перчатки или полотенце
- Два шейкера для смузи или пищевых контейнеров на 32 унции с крышкой, предпочтительно полупрозрачной или прозрачной
- Фруктовый сок — например, апельсиновый, яблочный или виноградный сок (Не используйте версию без сахара.
 )
) - Пищевой краситель (по желанию)
- Термометр, показывающий –12°C или 10°F (дополнительно)
- Газированная вода или фруктовый сироп (по желанию)
Подготовка
- Налейте полстакана воды в миску. Добавьте одну чайную ложку соли и перемешайте, пока она не растворится. Если у вас есть пищевой краситель, вы можете добавить одну или две капли. Это придаст вашему специальному льду приятный цвет и облегчит обнаружение вытекшего раствора соленой воды в слякоти.
- Высыпьте содержимое в пакет с застежкой-молнией. Закройте пакет и отложите его в сторону.
- Повторите предыдущие два шага еще три раза, пока не получите четыре пакета с застежкой-молнией с раствором соленой воды.
- Храните пакеты не менее пяти часов или на ночь в морозильной камере. Убедитесь, что пакеты не касаются друг друга, чтобы они не смерзлись.
- Храните как минимум одну чашку сока и одну чашку воды в холодильнике.

Процедура
- Через пять часов проверьте, не замерзли ли четыре пакета с раствором соленой воды в морозильной камере.Если нет, подождите еще несколько часов, прежде чем продолжить.
- Выньте замороженные пакеты с раствором морской воды из морозильной камеры, используя перчатки или полотенце, чтобы защитить руки. Для каждого мешка откройте молнию, выпустите воздух из пакетов и снова закройте молнию.
- Ненадолго коснитесь пакета со льдом пальцами. Если у вас есть термометр, измерьте, насколько холоден этот лед. Обычные кубики льда имеют температуру 0 градусов по Цельсию (32 градуса по Фаренгейту). Этот лед кажется холоднее, чем обычные кубики льда? Подтвердил ли термометр ваши ощущения? Зачем вам нужен этот особый лед для приготовления слякоти?
- Возьмите сок и воду из холодильника.Налейте одну чашку сока в шейкер или пищевой контейнер. Промойте мерный стакан и налейте один стакан воды в другой шейкер или пищевой контейнер.

- Поместите два запечатанных пакета с застежкой-молнией с замороженным раствором морской воды в каждый контейнер перед тем, как закрыть крышку.
- Встряхните один контейнер пару раз. Посмотрите по бокам контейнера. Повторите с другим контейнером. Каким образом жидкости стекают со стенок контейнера?
- Поставьте контейнеры и медленно сосчитайте до 20, прежде чем повторить предыдущий шаг.Делайте это в течение нескольких минут. Изменяется ли способ стекания жидкости со стенок контейнеров? Почему это произошло? Это происходит одновременно в обоих контейнерах?
- Откройте контейнер примерно через три минуты. Вы видите намеки на слякоть? Вы видите одинаковую сумму в обоих контейнерах?
- Закройте контейнеры и продолжайте периодически встряхивать.
- Как только вы увидите, что по стенкам контейнера сползает густая масса, снова откройте контейнер и загляните внутрь. У тебя есть слякоть? Как изменился специальный лед в мешках? Почему он изменился?
- Если в специальном пакете со льдом все еще есть твердые кусочки льда, вы можете закрыть контейнер и продолжать периодически встряхивать, чтобы получить более плотную слякоть.
 Почему, однако, не стоит продолжать, если особый лед растаял?
Почему, однако, не стоит продолжать, если особый лед растаял? - Если специальный лед растаял, достаньте пакеты с соленой водой и отложите их в сторону. Если в слякоть просочилась соленая вода, выбросьте слякоть, заморозьте пакеты с молнией в растворе соленой воды после их полоскания и повторите попытку.
- Возможно, сок так и не превратился в слякоть. Если ваш сок не замерз, повторно заморозьте пакеты с застежкой-молнией в солевом растворе после ополаскивания снаружи и растворения в каждом дополнительно половине чайной ложки соли. Как вы думаете, почему ваш сок не превратился в жижу? Как вы думаете, можно решить, добавив больше соли в раствор в мешках? Почему или почему нет?
- Вылейте мутное содержимое в стакан.Если вы разбавили сироп или содовую, налейте немного на слякоть, приготовленную только из воды, хорошо перемешайте и выпейте. Пейте сок жидким, как есть. Одно слякоть лучше другого?
- Дополнительно: Узнайте, что проще: сначала смешать сироп с водой и сделать из смеси кашицу или добавить сироп после того, как вы сделали кашицу только из воды.
 Почему это так? Какой способ вкуснее?
Почему это так? Какой способ вкуснее? - Экстра : Попробуйте другие соки. Какой сок легче всего превратить в слякоть?
- Extra : Можете ли вы найти способ сделать большую слякоть?
- Extra : узнайте, что произойдет, если добавить в воду больше соли для создания специального льда. Какой самый холодный особый лед можно приготовить?
- Extra : Проверьте и посмотрите, что произойдет, если вы не встряхнете контейнеры во время приготовления слякоти.
Наблюдения и результаты
Вода превратилась в жижу быстрее, чем сок? Сок замерзает при более низкой температуре по сравнению с водой, поэтому его необходимо охлаждать в течение более длительного периода, прежде чем появятся кристаллы льда.
Чистая вода замерзает при температуре 0 градусов по Цельсию (32 градуса по Фаренгейту). Добавление частиц в воду заставляет ее замерзать при более низкой температуре. Вот почему соленая вода, приготовленная вами в этом упражнении, казалась такой холодной, когда вы доставали ее из морозильной камеры. Создавая слякоть, он поглощал тепло жидкостей в контейнерах. Этот процесс растопил морской лед, охлаждая жидкости.
Вот почему соленая вода, приготовленная вами в этом упражнении, казалась такой холодной, когда вы доставали ее из морозильной камеры. Создавая слякоть, он поглощал тепло жидкостей в контейнерах. Этот процесс растопил морской лед, охлаждая жидкости.
Фруктовый сок состоит из фруктовых сахаров, растворенных в воде вместе с некоторыми другими частицами, такими как витамины и минералы.Поскольку фруктовый сок содержит чистую воду с растворенными в ней частицами, он замерзает при более низкой температуре, чем чистая вода. Чаще всего ее температура замерзания не такая низкая, как у созданной вами соленой воды, поэтому замороженная соленая вода все же могла заморозить сок, хотя и медленнее, чем могла бы заморозить воду.
Очистка
Если вы хотите сделать больше смузи позже, вы можете повторно использовать пакеты с застежкой-молнией с раствором соленой воды после их полоскания и повторного замораживания.Чтобы избавиться от них, вы можете избавиться от них в раковине.
Еще для изучения
Приготовьте мороженое в пакете, от Science Buddies
Заморозьте свои фрукты с помощью науки!, от Scientific American
Химия приготовления мороженого: снижение температуры замерзания воды, от Science Buddies
What Заставляет лед таять быстрее?, из Scientific American
Научные мероприятия для всех возрастов!, из Science Buddies
Это задание было предложено вам в сотрудничестве с Science Buddies
Руководство по замораживанию пищевых продуктов — публикации
■ Введение
Замораживание — один из самых простых, быстрых, универсальных и самых удобных способов сохранения продуктов.Правильно замороженные продукты сохраняют больше своего первоначального цвета, вкуса и текстуры и, как правило, больше питательных веществ, чем продукты, консервированные другими способами.
Хорошее управление морозильной камерой имеет важное значение. Следующие советы помогут вам получить максимальную отдачу от вашего морозильного доллара.
- Поместите морозильник в прохладное сухое место с постоянной температурой.
- Держите морозильник заполненным как минимум на ¾ для эффективной работы.
- Продолжайте использовать и заменять продукты. Не просто храните их.
- Как можно реже открывайте дверцу морозильной камеры.
- Правильно используйте функции энергосбережения вашего морозильника.
- Содержите уплотнители дверей в чистоте и проверяйте их герметичность. Замените при необходимости.
- Регулярно размораживайте морозильники с ручным управлением.
- Содержите змеевики конденсатора в чистоте.
■ Факторы, влияющие на качество
Состояние продуктов во время замораживания определяет конечное качество замороженных продуктов. Замороженные продукты не могут быть лучше, чем они были до заморозки.Замораживание не стерилизует продукты, как консервирование. Он просто задерживает рост микроорганизмов и замедляет химические изменения, влияющие на качество или вызывающие порчу продуктов.
Ферменты
Замораживание, нагревание и химические соединения могут контролировать действие ферментов. Замораживание замедляет активность ферментов, поэтому многие замороженные продукты, такие как мясо и многие фрукты, будут удовлетворительно храниться при незначительной дополнительной обработке или без нее.
Ферменты в овощах инактивируются нагреванием во время рекомендуемого процесса бланширования.Ферменты во фруктах, вызывающие потемнение и потерю витамина С, контролируются химическими соединениями (антиоксидантами).
Воздух
Кислород в воздухе может вызвать изменение вкуса и цвета, если пища неправильно упакована.
Микроорганизмы
Микроорганизмы не растут при температуре морозильной камеры, но большинство из них не уничтожаются и будут размножаться так же быстро, как и всегда, когда замороженные продукты оттаивают и оставляют стоять при комнатной температуре.
Ледяные кристаллы
Желательно образование мелких кристаллов льда при замораживании. Быстрая заморозка — наиболее практичный способ образования мелких кристаллов льда. Крупные кристаллы льда, связанные с медленным замораживанием, имеют тенденцию разрывать клетки, вызывая нежелательное изменение текстуры.
Быстрая заморозка — наиболее практичный способ образования мелких кристаллов льда. Крупные кристаллы льда, связанные с медленным замораживанием, имеют тенденцию разрывать клетки, вызывая нежелательное изменение текстуры.
Температура морозильной камеры
Поддерживайте температуру 0 градусов по Фаренгейту или ниже, чтобы сохранить замороженные продукты высшего качества. Срок хранения продуктов сокращается при повышении температуры. Например, такая же потеря качества замороженных бобов, хранившихся при 0 F в течение одного года, произойдет через три месяца при 10 F, через три недели при 20 F и через пять дней при 30 F.
Колебания температуры приводят к увеличению размера кристаллов льда, дополнительно повреждая клетки и делая продукт более мягким. Изменения температуры также могут вызвать миграцию воды из продукта.
Испарение влаги
Неправильно защищенные продукты теряют влагу, цвет, вкус и текстуру. Испарение кристаллов льда с участка на поверхности приводит к морозильному ожогу, который представляет собой сухую, зернистую, коричневатую область, которая становится жесткой. Морозильный ожог не делает пищу небезопасной, только менее желательной.
Морозильный ожог не делает пищу небезопасной, только менее желательной.
Упаковочные материалы
Основной целью упаковки является предотвращение высыхания пищевых продуктов и сохранение питательной ценности, вкуса, текстуры и цвета. На этикетках на упаковках указано, подходит ли продукт для хранения в морозильной камере. Хороший упаковочный материал должен иметь следующие характеристики:
- Влаго/паростойкий или по крайней мере влагостойкий.
- Изготовлен из пищевого материала, т.е. предназначен для использования в пищевых продуктах.
- Прочный и герметичный.
- Не становится хрупким и не трескается при низких температурах.
- Устойчив к маслу, жиру или воде.
- Защитите продукты от посторонних привкусов и запахов.
- Легко наполняется и закрывается.
- Легко маркировать и хранить.
Выбор упаковки зависит от типа замораживаемых продуктов, личных предпочтений и доступности. Для достижения удовлетворительных результатов не замораживайте фрукты и овощи в контейнерах объемом более 1,5 галлона.
Упаковка, недостаточно влаго/паростойкая для длительного хранения в морозильной камере, включает обычную вощеную бумагу и картонные коробки из-под мороженого и молока.
Жесткие контейнеры
Жесткие контейнеры изготовлены из пластика, стекла, алюминия и сильно вощеного картона и подходят для всех упаковок. Они часто многоразовые. Прямые или заостренные стороны жестких контейнеров значительно облегчают извлечение замороженных продуктов.
Стеклянные банки, используемые для замораживания, должны быть изготовлены для этой цели. Обычные стеклянные банки могут не выдержать перепадов температур. Не используйте обычные консервные банки с узким горлышком для замораживания продуктов, упакованных в жидкость. Расширение жидкости может привести к разрыву горлышка банки.
Банки, такие как консервные банки и банки из-под кофе, подходят для упаковки деликатных пищевых продуктов. Выровняйте банку с пакетом для хранения продуктов и заклейте крышку морозильной лентой, потому что они негерметичны.
Формы для выпечки можно использовать для замораживания, разогрева и сервировки. Блюда можно накрыть толстой алюминиевой фольгой, обмотанной липкой лентой. Чтобы повторно использовать форму для запекания после того, как продукты заморозятся, заверните продукты в форму для запекания.
Лотки для льдаподходят для замораживания продуктов в небольших количествах.Заморозьте продукты, пока они не затвердеют, а затем переложите в пакеты для заморозки.
Гибкие пакеты или упаковка
Мешки и листы из влаго/паростойких материалов и сверхпрочной фольги подходят для сухой упаковки овощей и фруктов, мяса, рыбы или птицы. Мешки также можно использовать для жидких упаковок. Защитные картонные коробки можно использовать для защиты мешков и листов от разрывов и для облегчения штабелирования.
Ламинированная бумага, изготовленная из различных комбинаций бумаги, металлической фольги и/или целлофана, подходит для сухой упаковки овощей и фруктов, мяса, рыбы и птицы. Ламинированные бумаги также используются в качестве защитной обертки.
Ламинированные бумаги также используются в качестве защитной обертки.
Упаковка, запечатывание и маркировка
- Охладите все продукты и сироп перед упаковкой. Это ускоряет замораживание и помогает сохранить естественный цвет, вкус и текстуру продуктов.
- Упаковывайте продукты в количествах, которые будут использоваться за один раз.
- Для большинства продуктов требуется свободное пространство между упакованными продуктами и крышкой для расширения при замерзании продуктов. Овощи в свободной упаковке, такие как спаржа и брокколи, костлявые куски мяса, продукты на лотках и хлеб не нуждаются в свободном пространстве над головой.
- Плотно упакуйте продукты, чтобы уменьшить количество воздуха в упаковке.
- Проведите неметаллическим предметом, например, резиновой ручкой скребка, вокруг внутренней части контейнера, чтобы устранить воздушные карманы.
- При заворачивании пищи выдавливайте как можно больше воздуха и формируйте обертку как можно ближе к пище.

- При упаковке продуктов в пакеты выдавливайте воздух из пакетов. Начиная с нижней части пакета, плотно прижмите его к верхней части, чтобы предотвратить повторное попадание воздуха, или вытесните воздух, поместив наполненный пакет в миску с холодной водой, следя за тем, чтобы вода не попала в пакет.Запечатайте любым способом, скрутив и отогнув верхнюю часть пакета (гусиная шея) и закрепив шнуром, качественной резинкой, полоской проволоки с покрытием или другим запечатывающим устройством. Многие мешки могут быть заварены термосваркой, а в некоторые из них встроено шпунтовое соединение.
- Не допускайте попадания влаги или пищи на уплотнительные края, чтобы они хорошо закрывались.
- При использовании ленты это должна быть лента для замораживания, предназначенная для использования в морозильной камере. Клей сохраняет свою эффективность при низких температурах.
- Маркируйте каждую упаковку с названием продукта, датой, количеством и добавленными ингредиентами.
 Используйте ленту для замораживания, маркеры или мелки для маркировки замораживания или этикетки с клеевым покрытием, специально предназначенные для замораживания.
Используйте ленту для замораживания, маркеры или мелки для маркировки замораживания или этикетки с клеевым покрытием, специально предназначенные для замораживания.
■ Загрузка морозильной камеры
- Замораживайте продукты при температуре 0 F или ниже. Чтобы обеспечить более быстрое замораживание, установите морозильную камеру на минус 10 F примерно за 24 часа до добавления незамороженных продуктов.
- Замораживайте продукты, как только они упакованы и запечатаны.
- Не перегружайте морозильник незамороженными продуктами. Добавляйте только то количество, которое замерзнет в течение 24 часов. Обычно это 2 или 3 фунта пищи на кубический фут пространства для хранения.Перегрузка замедляет скорость замораживания, и продукты, которые замораживаются слишком медленно, могут потерять свое качество.
- Поместите пакеты на морозильные пластины или катушки. Оставьте пространство между пакетами, чтобы воздух мог свободно циркулировать. После заморозки хранить пакеты близко друг к другу.

- Разложите пакеты так, чтобы в первую очередь использовались те, которые дольше всего находились в морозильной камере.
■ Инвентарь морозильной камеры
Составьте список всех продуктов в морозильной камере. Обновляйте список каждый раз, когда вы кладете продукты или достаете их из морозильной камеры.Использование инвентаря может предотвратить чрезмерное хранение продуктов и потерю качества.
См. образец.
■ Размораживание продуктов
Большинство изменений, проявляющихся при оттаивании, являются результатом замораживания и хранения. Когда пища размораживается, кристаллы льда тают, жидкость либо впитывается обратно в пищу, либо вытекает из нее. Медленное, хорошо контролируемое размораживание обычно приводит к лучшему возврату влаги в продукт и делает его более похожим на исходный продукт, чем быстрое размораживание.
Размораживание в холодильнике — самый безопасный метод размораживания. Нахождение пищи при комнатной температуре дает микроорганизмам возможность роста и активности.
См. Оттаивание фруктов.
■ Что делать, если морозильная камера останавливается?
Основой безопасности при повторном замораживании пищевых продуктов является температура, при которой выдерживались размороженные пищевые продукты, и время, в течение которого они выдерживались после размораживания. Вы можете безопасно повторно заморозить продукты, которые все еще содержат кристаллы льда или если они все еще холодные, т.е.е. ниже 40 F и выдерживали при этой температуре не более одного-двух дней после оттаивания. В общем, если безопасно есть, безопасно и повторно замораживать.
К сожалению, вы часто не знаете время и температуру. В этих случаях необходимо учитывать следующие моменты.
- Не открывать дверь для проверки предметов; сначала составить план.
- Попробуйте определить, если это возможно, когда морозильник перестал работать.
- Продукты в закрытой, полностью загруженной морозильной камере хранятся два дня.
- Продукты в закрытой морозильной камере, загруженной менее чем наполовину, не могут храниться дольше одного дня.

- Мясо из-за плотности остается замороженным дольше, чем выпечка.
Если морозильная камера не будет работать в течение дня или двух:
Используйте сухой лед, если он доступен. Двадцать пять фунтов сухого льда в морозильной камере объемом 10 кубических футов должны удерживать температуру ниже точки замерзания в течение двух-трех дней при менее чем половинной загрузке и от трех до четырех дней в полностью загруженном шкафу, если вы получаете сухой лед быстро после отключения морозильной камеры. операция.
Поместите сухой лед на доски или плотный картон поверх упаковок. Открывайте морозильную камеру только при необходимости. Не беритесь за сухой лед голыми руками, так как это вызовет ожоги. При использовании сухого льда убедитесь, что помещение проветривается.
Если сухой лед недоступен, другие варианты:
— Накройте морозильник газетами и одеялами. Прикрепите одеяла подальше от вентиляционного отверстия. Вентиляционное отверстие должно быть открыто, потому что морозильнику нужен воздух, когда включается электричество. Одеяло поможет даже при использовании сухого льда.
Прикрепите одеяла подальше от вентиляционного отверстия. Вентиляционное отверстие должно быть открыто, потому что морозильнику нужен воздух, когда включается электричество. Одеяло поможет даже при использовании сухого льда.
— Найдите другую морозильную камеру на заводе шкафчиков или у друзей и соседей. Перемещайте продукты в изолированных коробках или хорошо оберните слоями газет.
■ Повторное замораживание
Повторное замораживание должно быть выполнено быстро. Очистите морозильную камеру перед повторным наполнением. Если в морозильной камере есть регулятор температуры, поверните его в самое холодное положение.
Проверяйте каждую упаковку или контейнер с пищевыми продуктами. Вы часто можете проверить нежесткие контейнеры, не открывая их, сжав их, чтобы нащупать кристаллы льда.Если их нужно открыть, их следует тщательно завернуть.
По возможности кладите более теплые упаковки на охлаждаемую поверхность, но оставляйте пространство между упаковками для циркуляции воздуха.
Ухудшение качества повторно замороженных продуктов.
Маркируйте и используйте повторно замороженные продукты как можно скорее.
■ Что повторно замораживать
В размороженных продуктах не осталось кристаллов льда. Если размороженные продукты нагрелись выше температуры холодильника (40 F), их нельзя замораживать повторно, за исключением продуктов с очень высокой кислотностью, таких как фрукты.
Многие размороженные продукты, т. е. те, которые все еще содержат много кристаллов льда или твердое ядро льда в центре, можно безопасно повторно заморозить.
Любые признаки порчи, постороннего запаха или цвета в любой пище указывают на то, что вы должны утилизировать пищу, не пробуя ее на вкус.
Помните, однако, что нельзя полагаться на внешний вид и запах. Некоторые продукты могут хорошо выглядеть и пахнуть, но если они слишком долго находились при комнатной температуре, бактерии, вызывающие пищевое отравление, могли размножиться достаточно, чтобы вызвать заболевание.
Мясо , такое как говядина, свинина, телятина, баранина и птица, могут быть повторно заморожены, когда они еще твердые с кристаллами льда. Мясо, все еще пригодное для употребления в пищу, можно приготовить и повторно заморозить. Откажитесь от мяса, если оно имеет какие-либо признаки порчи, такие как изменение цвета или неприятный запах.
Фрукты обычно начинают бродить, когда начинают портиться, что не делает их опасными для употребления в пищу, но портит вкус. Размороженные фрукты с приятным запахом и вкусом можно заморозить повторно.
Овощи следует повторно замораживать, только если они содержат много кристаллов льда.
Моллюски , готовые пищевые продукты или остатки не подлежат повторной заморозке после размораживания. Если состояние еды плохое или даже сомнительное, избавьтесь от нее. Это может быть опасно.
Никогда не замораживайте повторно растаявшее мороженое, пироги с кремом, эклеры или подобные продукты.
Незамороженные торты, пироги с фруктами, хлеб и булочки можно замораживать повторно.
Инвестиции в продукты в морозильной камере могут быть значительными, но столь же значительны и преимущества подачи безопасных продуктов.
■ Плохо замораживаемые продукты
ИЗМЕНЕНИЕ ВКУСА
- Приправы из перца, гвоздики, имитации ванили, чеснока (особенно сырого), шалфея и сельдерея могут стать сильными и/или горькими.
- Карри может иметь затхлый привкус.
- Лук меняет вкус при заморозке.
- Соль теряет вкус и имеет тенденцию повышать прогорклость любого жиросодержащего продукта.
- Добавляйте искусственные подсластители и заменители соли во время подачи, чтобы быть в безопасности.
ИЗМЕНЕНИЕ ТЕКСТУРЫ
- Вареные яичные белки становятся жесткими и эластичными.
- Мягкие меренги затвердевают и сжимаются.
- Майонез и заправки для салатов на основе вареных яиц или сливок при отдельном замораживании отделяются друг от друга.

- Молочные соусы или подливы, загущенные пшеничной мукой, могут расслаиваться или свертываться.
- Половинки, сметана и творог разделяются и могут стать зернистыми и водянистыми при замораживании отдельно. Пахта и йогурт реагируют одинаково, но их можно использовать для выпечки.
- Начинки из заварного крема или крема имеют тенденцию расслаиваться и становиться комковатыми и водянистыми.
- Вареная или воздушная глазурь, приготовленная из яичных белков, становится липкой и жидкой.
- Приготовленные макаронные изделия теряют текстуру и, как правило, кажутся подогретыми, если их просто заморозить.
- Большинство желатиновых блюд имеют тенденцию к слезотечению при оттаивании.
- Начинка из сыра или крошки размокает.
- Жареные продукты, за исключением картофеля фри и луковых колец, теряют хрустящую корочку и становятся сырыми.
- Салат, помидоры, сельдерей, огурцы, петрушка, редис и аналогичные овощи с высоким содержанием воды становятся мягкими и водянистыми.

- Картофель может потемнеть и изменить текстуру при добавлении в замороженные супы и тушеные блюда. Молодой картофель замерзает лучше, чем старый.
- Консервированная ветчина может стать жесткой и водянистой.
- Фаршированную птицу нельзя безопасно замораживать.
■ Сохранение питательных веществ
Недавние исследования показали, что содержание питательных веществ в замороженных, свежих готовых к употреблению и консервированных продуктах практически сопоставимо. Содержание питательных веществ является самым высоким, когда продукты консервируются или съедаются как можно скорее после сбора урожая.
■ Замораживание овощей
Свежие, нежные овощи прямо с грядки лучше всего подходят для заморозки.Если овощи нельзя заморозить сразу после сбора урожая, храните их в холодильнике, чтобы сохранить свежесть, пока их можно будет подготовить и заморозить.
См. таблицу 1 для приблизительного выхода замороженных овощей из свежих.
Не все овощи хорошо замораживаются. Обязательно свяжитесь с офисом расширения вашего округа для получения информации о рекомендуемых сортах овощей для Северной Дакоты, чтобы обеспечить хороший урожай для заполнения морозильной камеры.
Бланширование
Бланширование – кратковременное ошпаривание овощей водой или паром.Это очень важный этап заморозки овощей, поскольку он замедляет или останавливает действие ферментов. Эти ферменты необходимы для роста и созревания. Если действие фермента не остановить перед замораживанием, овощи могут продолжать созревать, приобретать неприятный привкус, обесцвечиваться или становиться жесткими, что может привести к тому, что через короткое время они станут неаппетитными.
Этот процесс нагревания также способствует вялению или размягчению овощей и облегчает их упаковку. Некоторые микроорганизмы погибают, а цвет становится ярче.
Время бланширования зависит от размера и вида овощей.Рекомендуемое время достаточно, чтобы остановить или разрушить ферменты. Обязательно соблюдайте рекомендуемое время бланширования.
Обязательно соблюдайте рекомендуемое время бланширования.
Недостаточное побледнение может стимулировать активность некоторых ферментов и хуже, чем полное отсутствие побледнения. Перебланширование приводит к потере витаминов, минералов, вкуса и цвета.
Бланширование в кипящей воде
Используйте бланширователь с корзиной для бланширования и крышкой или вставьте проволочную корзину в большой котел с крышкой. Мешок из марли – еще один вариант.Используйте не менее 1 галлона воды на каждый фунт овощей. Положите овощи в корзину или мешок и опустите корзину в кипящую воду. Накройте и сразу же начинайте отсчитывать время. Держите высокую температуру и продолжайте варить в течение времени, указанного для овощей, которые вы замораживаете. Если кипение прекращается, значит, вы бланшируете слишком большое количество за один раз.
Одну и ту же воду можно использовать несколько раз для бланширования; только не забудьте довести его до сильного кипения, прежде чем добавлять овощи.
Бланшировать в паре
Налейте от 1 до 2 дюймов воды в чайник и доведите до кипения. Подвесьте овощи тонким слоем в проволочной корзине или марле над быстро кипящей водой. Накройте крышкой, поддерживайте сильный огонь и бланшируйте овощи на пару в течение времени, рекомендованного в таблице.
Бланширование в микроволновой печи
Овощи, бланшированные в микроволновой печи, не так приемлемы, как овощи, бланшированные водой или паром. Использование микроволновой печи для бланширования овощей не позволяет существенно сэкономить время.Это связано с тем, что время, необходимое при использовании воды или пара, очень короткое.
Если вы решите использовать микроволновую печь для бланширования овощей, ознакомьтесь с рекомендациями производителя печи.
Охлаждение
После того, как овощи подогреты, их следует быстро и тщательно охладить, чтобы остановить приготовление. Сразу же после нагревания погрузите корзину с овощами в большое количество холодной воды. Чаще меняйте воду или используйте холодную проточную или ледяную воду. Если используется лед, вам понадобится около 1 фунта льда на каждый фунт овощей.Охлаждение овощей занимает примерно столько же времени, сколько и их разогрев. Когда овощи остынут, выньте их из воды и тщательно слейте.
Чаще меняйте воду или используйте холодную проточную или ледяную воду. Если используется лед, вам понадобится около 1 фунта льда на каждый фунт овощей.Охлаждение овощей занимает примерно столько же времени, сколько и их разогрев. Когда овощи остынут, выньте их из воды и тщательно слейте.
■ Способы упаковки овощей
При использовании жестких контейнеров оставьте свободное пространство над головой (см. ниже). Еда расширяется при замерзании, и крышка может оторваться от контейнера, если он слишком полный.
При использовании пакетов для заморозки выдавите воздух из незаполненной части пакета, запечатайте и заморозьте. Если на сумке есть поворотная застежка, обязательно скрутите сумку и сложите ее обратно, прежде чем закрепить поворот.Если этого не сделать, воздух будет устремляться обратно в мешок.
Овощи могут быть упакованы как цельными, так и насыпными.
Твердая упаковка: Поместите высушенные овощи в контейнеры для морозильной камеры. Плотно упакуйте, чтобы сократить количество воздуха в контейнере или пакете. Запечатать и заморозить.
Плотно упакуйте, чтобы сократить количество воздуха в контейнере или пакете. Запечатать и заморозить.
Индивидуальная или лотковая упаковка: Позволяет выливать из большой упаковки столько, сколько нужно. Разложите обсушенные овощи в один слой на подносе и заморозьте. Как только они заморозятся, перелейте их в жесткие контейнеры или пакеты для морозильной камеры, запечатайте и верните в морозильную камеру.Удаляйте их по мере необходимости.
■ Как использовать замороженные овощи
Большинство замороженных овощей следует готовить без предварительного размораживания. Кукуруза в початках является исключением — ее следует частично разморозить, чтобы к моменту приготовления кукурузы початок прогрелся. Это занимает около 10 минут.
Не пережаривайте овощи. Варить только до готовности. Большинство овощей частично готовятся после бланширования, поэтому для приготовления требуется меньше времени, чем для свежих овощей. Варить в небольшом количестве воды; около ½ стакана достаточно.
Примечание: Микроволновая печь отлично справляется с приготовлением замороженных овощей. Следуйте рекомендациям производителя по выбору времени и мощности.
■ Замораживание фруктов
Большинство фруктов можно удовлетворительно заморозить, но качество замороженного продукта зависит от вида фруктов, стадии зрелости и типа упаковки.
Выберите сорт, подходящий для заморозки. Выбирайте фрукты с твердой текстурой и хорошо развитым вкусом и относитесь к ним с уважением.Стирайте небольшими порциями (от 2 до 3 литров) за один раз, чтобы избежать синяков. Промойте несколько раз холодной водой, вынимая продукты из воды, чтобы грязь не осела на фруктах. Не давайте продуктам замачиваться.
Плоды готовятся к заморозке примерно так же, как и к подаче. Лучше всего приготовить достаточно фруктов только для 2-3 литров за один раз.
Если фрукты нужно измельчить, подберите метод для фруктов. Для измельчения мягких фруктов можно использовать проволочную картофелемялку, вилку для теста или шумовку. Твердые фрукты легче измельчить измельчителем. Для приготовления пюре пригодится дуршлаг, пищевой пресс или сито. Блендеры и кухонные комбайны слишком сильно разжижают фрукты.
Твердые фрукты легче измельчить измельчителем. Для приготовления пюре пригодится дуршлаг, пищевой пресс или сито. Блендеры и кухонные комбайны слишком сильно разжижают фрукты.
Не используйте оцинкованную посуду с фруктами или фруктовыми соками, потому что кислота во фруктах растворяет ядовитый цинк. Металлические привкусы могут возникать в результате использования железной посуды, сколов эмалированной посуды или плохо законсервированной жестяной посуды.
Предотвращение обесцвечивания
Некоторые фрукты, такие как персики, яблоки, груши и абрикосы, быстро темнеют на воздухе и при замораживании.
Во время приготовления держите очищенные, разрезанные пополам, на четвертинки, нарезанные ломтиками или кубиками плоды, которые темнеют в растворе аскорбиновой кислоты. Эта процедура также полезна для предотвращения обесцвечивания концов черешни и винограда. Вы можете получить аскорбиновую кислоту в нескольких формах:
Чистая порошкообразная форма — сезонно в наличии среди консервных запасов в супермаркетах. Одна чайная ложка без горки чистого порошка весит около трех граммов. Используйте одну чайную ложку на галлон воды в качестве лечебного раствора.
Одна чайная ложка без горки чистого порошка весит около трех граммов. Используйте одну чайную ложку на галлон воды в качестве лечебного раствора.
Витамин С в таблетках — экономичен и доступен круглый год во многих магазинах. Купить 500-миллиграммовые таблетки; раздавите и растворите шесть таблеток на галлон воды в качестве лечебного раствора.
Коммерчески приготовленные смеси аскорбиновой и лимонной кислот — сезонно в наличии среди консервных запасов в супермаркетах. Порошок лимонной кислоты продается в супермаркетах, но он менее эффективен в борьбе с обесцвечиванием. Если вы решите использовать эти продукты, следуйте инструкциям производителя.
Выбор пакета
Существует несколько типов фруктовых упаковок, пригодных для замораживания: упаковка с сиропом, упаковка с сахаром, несладкая упаковка, упаковка на лотках или упаковка с заменителем сахара.
Большинство фруктов имеют лучшую текстуру и вкус, если они упакованы в сахар или сироп. Некоторые фрукты могут быть удовлетворительно упакованы без подсластителей, но потери витамина С самые большие, когда фрукты упакованы без сахара. Тип упаковки будет зависеть от предполагаемого использования. Фрукты, упакованные в сироп, обычно лучше всего подавать в сыром виде; те, что упакованы в сухой сахар или несладкие, лучше всего подходят для большинства кулинарных целей, потому что в продукте меньше жидкости.Неподслащенные пакеты и пакеты заменителей сахара часто используются людьми на специальных диетах.
Некоторые фрукты могут быть удовлетворительно упакованы без подсластителей, но потери витамина С самые большие, когда фрукты упакованы без сахара. Тип упаковки будет зависеть от предполагаемого использования. Фрукты, упакованные в сироп, обычно лучше всего подавать в сыром виде; те, что упакованы в сухой сахар или несладкие, лучше всего подходят для большинства кулинарных целей, потому что в продукте меньше жидкости.Неподслащенные пакеты и пакеты заменителей сахара часто используются людьми на специальных диетах.
Упаковка сиропа
Соотношение сахара и воды зависит от сладости фруктов и вкусовых предпочтений пользователя. Для большинства фруктов рекомендуется 40-процентный сироп. Для фруктов с мягким вкусом желательны более легкие сиропы, чтобы предотвратить маскировку вкуса. Для очень кислых фруктов можно использовать более тяжелые сиропы.
Чтобы приготовить сироп, растворите сахар в теплой воде, пока раствор не станет прозрачным.Охладите сироп перед использованием.
Используйте достаточное количество холодного сиропа, чтобы покрыть подготовленные фрукты после того, как они остынут в банке (от 1/2 до 3/4 стакана сиропа на пинту). Чтобы фрукты оставались под сиропом, поместите сверху небольшой кусочек мятой вощеной бумаги или другого водостойкого упаковочного материала и прижмите фрукты к сиропу, прежде чем закрыть, запечатать и заморозить.
Неподслащенная упаковка
Фрукты можно упаковать сухими. Положите чистые фрукты в картонную коробку, накройте и заморозьте или залейте водой, содержащей аскорбиновую кислоту, или залейте несладким соком.Фрукты, упакованные в воду или сок, погрузите в воду, используя небольшой кусочек скомканного водостойкого материала, как в случае пакетов с сиропом и сахаром. Плотно закрыть и заморозить.
Неподслащенные пакеты обычно дают продукт более низкого качества, чем пакеты с сахаром. Однако некоторые фрукты, такие как малина, черника, ошпаренные яблоки, крыжовник, смородина, клюква и ревень дают хорошее качество без сахара.
Пакет с сахаром
Положите фрукты в миску или неглубокую кастрюлю. Посыпьте фрукты сахаром и осторожно перемешайте, пока не вытечет сок и не растворится сахар.Для перемешивания используйте большую ложку или лопатку для блинов.
Мягкие нарезанные фрукты, такие как персики, клубника, сливы и вишни, дадут достаточное количество сиропа для покрытия, если фрукты посыпать сахаром и оставить на 15 минут. Некоторые целые фрукты могут быть покрыты сахаром и заморожены.
Упакуйте фрукты и соки в контейнер. Сверху положите небольшой кусочек мятой водостойкой бумаги, чтобы фрукты оставались в соку. Запечатать и заморозить.
Набор подносов
Это хорошая упаковка для фруктов, упомянутых выше в разделе упаковки без сахара.Разложите подготовленные фрукты в один слой на неглубоких противнях. Быстро заморозьте и упакуйте в пакеты для заморозки. Кусочки фруктов остаются свободными. Позже пакет можно открыть, вынуть необходимое количество, а пакет снова закрыть и вернуть в морозильную камеру.
Пакет для замены сахара
Заменители сахара можно использовать при заморозке фруктов. Они дадут сладкий вкус, но не обеспечат полезных эффектов сахара, таких как защита цвета и густой сироп. Фрукты, замороженные с заменителями сахара, будут мерзнуть сильнее и оттаивать медленнее, чем фрукты, консервированные с сахаром.
Следуйте указаниям на этикетке подсластителя, чтобы определить необходимое количество подсластителя. Не содержащие сахара подсластители можно добавлять во время подачи, а не в процессе замораживания.
■ Упаковка
Используйте контейнеры, предназначенные для замораживания. Оставьте свободное пространство между упакованными продуктами и крышкой, потому что большинство фруктов расширяются во время замораживания. См. стр. 9 для информации о необходимом свободном пространстве над головой.
■ Размораживание фруктов
Дайте фруктам оттаять в невскрытой упаковке.Фрукты, упакованные в сухой сахар, оттаивают быстрее, чем в сиропе. Фрукты, упакованные без сахара, размораживаются дольше. Фрукты, которые будут подаваться в салаты, песочные пироги, фруктовые соусы и фруктовые чашки, должны быть только частично разморожены. Разморозьте фрукты для пирогов, пока они не отделятся. Полностью размороженные плоды станут мягкими и могут потемнеть при хранении.
Фрукты, упакованные без сахара, размораживаются дольше. Фрукты, которые будут подаваться в салаты, песочные пироги, фруктовые соусы и фруктовые чашки, должны быть только частично разморожены. Разморозьте фрукты для пирогов, пока они не отделятся. Полностью размороженные плоды станут мягкими и могут потемнеть при хранении.
■ Подготовка фруктов к заморозке
Яблоки
Ломтики яблок – Выберите твердые, хрустящие яблоки с насыщенным вкусом. Промойте, очистите и удалите сердцевину.Нарежьте средние яблоки на двенадцатые части, крупные — на шестнадцатые. Упакуйте одним из следующих способов.
Упаковка сиропа – Используйте 40-процентный сироп. Для лучшего качества замороженного продукта добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа.
Нарежьте яблоки прямо в холодный сироп в контейнерах, начиная с ½ стакана сиропа и заканчивая контейнером в пинту. Вдавите фрукты в контейнеры и добавьте достаточное количество сиропа, чтобы покрыть их.
Оставить свободное пространство. Запечатать и заморозить.
Пакет с сахаром – Чтобы яблоки не потемнели во время приготовления, нарежьте их ломтиками в растворе из 2 столовых ложек соли на галлон воды.Подержите в этом растворе не более 15-20 минут. Осушать.
Чтобы предотвратить потемнение, положите ломтики в один слой в пароварку; готовьте на пару от 1,5 до 2 минут, в зависимости от толщины ломтика. Охладить в холодной воде и процедить.
На каждую кварту (1¼ фунта) ломтиков яблок равномерно посыпать ½ стакана сахара и перемешать.
Упакуйте яблоки в контейнеры и придавите их. Оставьте место в голове. Запечатать и заморозить.
Неподслащенная упаковка – Следуйте инструкциям для упаковки сахара, исключая сахар.
Для пирогов – Следуйте указаниям по упаковке сахара, исключая сахар. Выложите приготовленные на пару ломтики в форму для пирога, как для пирога. Положите заполненную тарелку в полиэтиленовый пакет и заморозьте. Удалите твердый кусок ломтиков с тарелки, как только они замерзнут. Плотно заверните и верните в морозилку. Во время приготовления пирога положите кусочки пирога в тесто. Посыпать сахаром и приправами, сверху накрыть корочкой и запечь.
Удалите твердый кусок ломтиков с тарелки, как только они замерзнут. Плотно заверните и верните в морозилку. Во время приготовления пирога положите кусочки пирога в тесто. Посыпать сахаром и приправами, сверху накрыть корочкой и запечь.
Яблочное пюре – Выбирайте яблоки с насыщенным вкусом.Яблоки помойте, при желании очистите от сердцевины и нарежьте. На каждый литр ломтиков яблока добавьте стакан воды и варите до мягкости. Пюрируйте и добавьте ¼ стакана сахара, если хотите, на каждый литр горячего пюре, помешивая, пока он не растворится. Остудить и упаковать, оставив свободное пространство). Запечатать и заморозить.
Яблочный сок – Поместите свежеприготовленный сок в жесткую тару. Оставьте место в голове. Запечатать и заморозить.
Абрикосы
Разрезанные пополам – Выберите твердые, спелые, равномерно желтые абрикосы. Сортировать, мыть, половинки и косточки.Очистить и нарезать по желанию. Неочищенные абрикосы годятся для пирогов.
Если абрикосы не очищены от кожуры, нагрейте их в кипящей воде ½ минуты, чтобы кожица не стала жесткой во время замораживания. Затем охладить в холодной воде и процедить.
Упакуйте в контейнеры одним из следующих способов.
Упаковка сиропа – Используйте 40-процентный сироп. Для лучшего качества замороженного продукта добавьте ¾ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа.
Упаковывайте абрикосы прямо в контейнеры.Залить сиропом. Оставьте место в голове. Запечатать и заморозить.
Сахарная упаковка – Перед смешиванием абрикосов с сахаром обработайте фрукты следующим образом, чтобы они не потемнели:
Растворите ¼ чайной ложки кристаллической аскорбиновой кислоты в ¼ стакана воды и посыпьте 1 литр (7/8 фунта) фруктов.
Смешайте ½ стакана сахара с каждым литром фруктов. Перемешивайте, пока сахар не растворится. Упакуйте абрикосы в контейнеры и придавите, пока фрукты не будут покрыты соком, оставляя свободное пространство. Запечатать и заморозить.
Запечатать и заморозить.
Измельченный или пюре – Выбирайте полностью созревшие фрукты. Измельченные абрикосы опустить в кипящую воду на ½ минуты и остудить в холодной воде. Очистить абрикосы. Очистите их и крупно раздавите.
Для пюре, косточки и четвертинки абрикосов. Протереть через сито; или нагрейте до точки кипения в достаточном количестве воды, чтобы предотвратить пригорание, а затем протрите через сито.
Каждую кварту (2 фунта) подготовленных абрикосов смешайте с 1 стаканом сахара. Для лучшего результата добавьте к фруктам ¼ чайной ложки кристаллической аскорбиновой кислоты, растворенной в ¼ стакана воды, непосредственно перед добавлением сахара.
Упаковать в контейнеры, оставив свободное пространство. Запечатать и заморозить.
Авокадо
Выбирайте авокадо, поддающиеся легкому давлению, с кожурой без темных пятен. Очистите фрукты, разрежьте пополам и удалите косточку.
Пюре – Пюре. Добавьте ¼ чайной ложки кристаллической аскорбиновой кислоты на каждый литр пюре или добавьте 1 столовую ложку лимонного сока на каждые два авокадо. Используйте аскорбиновую кислоту, если она предназначена для сладкого блюда. Используйте лимонный сок для гуакамоле. Упакуйте в контейнеры, оставив свободное пространство (стр. 9).Запечатать и заморозить.
Добавьте ¼ чайной ложки кристаллической аскорбиновой кислоты на каждый литр пюре или добавьте 1 столовую ложку лимонного сока на каждые два авокадо. Используйте аскорбиновую кислоту, если она предназначена для сладкого блюда. Используйте лимонный сок для гуакамоле. Упакуйте в контейнеры, оставив свободное пространство (стр. 9).Запечатать и заморозить.
Бананы
Выбирайте твердые спелые бананы. Чистить. Тщательно разомните, добавив 1 чайную ложку лимонного сока на чашку бананового пюре. Упакуйте, оставив место над головой (стр. 9). Запечатать и заморозить.
Ягоды самые твердые
(черника, бузина, черника)
Целые – Выбирайте спелые ягоды с насыщенным вкусом примерно одинакового размера, предпочтительно с нежной кожицей. Сортировать, мыть и сушить.
При желании пропарьте в течение 1 минуты и сразу охладите.Предварительный нагрев на пару смягчает кожу и делает продукт более ароматным.
Используйте один из следующих пакетов.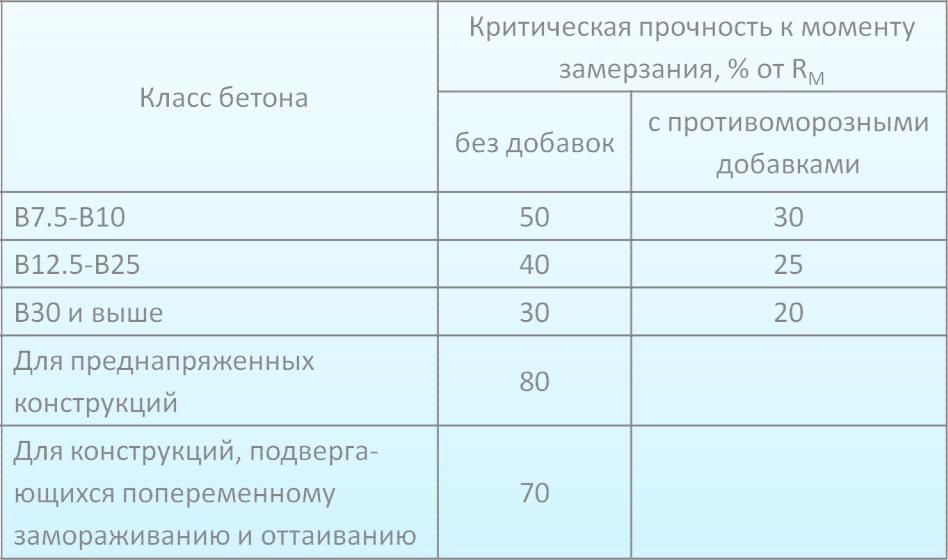
Упаковка для сиропа – Упакуйте ягоды в контейнеры и залейте холодным 40-процентным сиропом. Оставьте место в голове. Запечатать и заморозить.
Неподслащенная упаковка – Упаковка ягод на лотках или упаковка ягод в контейнеры, оставляя свободное место. Запечатать и заморозить.
Дробленые или пюре – Выбирайте полностью созревшие ягоды. Сортировать, мыть и сушить. Измельчите или протрите ягоды через мелкое сито, чтобы получилось пюре.
На 1 литр (2 фунта) измельченных ягод или пюре добавьте от 1 до 1c стакана сахара, в зависимости от терпкости фруктов. Перемешивайте, пока сахар не растворится. Упакуйте в контейнеры, оставив место над головой. Запечатать и заморозить.
Ягоды самые мягкие
(ежевика, бойзеновая ягода, ежевика, логановая ягода, молодые ягоды)
Выберите твердые, пухлые, полностью созревшие ягоды с блестящей кожицей. Зеленые ягоды могут вызвать неприятный запах.
Сортируйте и удаляйте все листья и стебли. Промыть и слить.
Используйте один из следующих пакетов.
Упаковка сиропа – Упакуйте ягоды в контейнеры и залейте холодным 40- или 50-процентным сиропом, в зависимости от сладости фруктов. Оставьте место в голове. Запечатать и заморозить.
Сахарная упаковка – К 1 литру (1 1/3 фунта) ягод добавьте ¾ стакана сахара. Переворачивайте ягоды снова и снова, пока большая часть сахара не растворится. Заполните контейнеры, оставив свободное пространство. Запечатать и заморозить.
Неподслащенная упаковка – Упакуйте ягоды в контейнеры, оставив свободное место.Запечатать и заморозить.
Дробленые или пюре – Подготавливают к упаковке так же, как и целые ягоды. Затем растолочь или протереть через сито или сделать пюре.
На каждую кварту (2 фунта) измельченных ягод или пюре добавьте 1 стакан сахара. Перемешивайте, пока сахар не растворится. Упакуйте в контейнеры, оставив место над головой. Запечатать и заморозить.
Упакуйте в контейнеры, оставив место над головой. Запечатать и заморозить.
Вишня, кислая
Выберите ярко-красные созревшие вишни. Очистите, переберите и тщательно промойте. Слив и яма.
Используйте один из следующих пакетов:
Упаковка для сиропа – Упакуйте вишню в контейнеры и залейте холодным 60- или 65-процентным сиропом (стр. 13), в зависимости от терпкости вишни.Оставьте место в голове. Запечатать и заморозить.
Сахарная упаковка – К 1 литру (1 фунту) вишни добавьте ¾ стакана сахара. Перемешивайте, пока сахар не растворится. Упакуйте в контейнеры, оставив место над головой. Запечатать и заморозить.
Вишня сладкая
Выбирайте хорошо окрашенные, созревшие на деревьях плоды со сладким вкусом. Сортировать, высушивать, мыть и сушить. При желании удалите косточки — они придают фруктам миндальный привкус.
Упакуйте вишню в контейнеры. Залить холодным 40-процентным сиропом, в который добавлено ½ чайной ложки кристаллической аскорбиновой кислоты на литр. Оставьте место в голове. Запечатать и заморозить.
Оставьте место в голове. Запечатать и заморозить.
С вишней используйте половину черешни и половину вишни. Упакуйте, как указано выше, используя 50-процентный сироп. Можно добавить аскорбиновую кислоту, но это не так важно, как для черешни.
Клюква
Целые – Выбирайте твердые темно-красные ягоды с блестящей кожицей. Стебель и сортировка. Промыть и слить.
Неподслащенная упаковка – Упаковка на лотках или упаковка в контейнеры без сахара. Оставьте место в голове. Запечатать и заморозить.
Пакет с сиропом – Упаковать в контейнеры. Залейте холодным 50-процентным сиропом. Оставьте место в голове. Запечатать и заморозить.
Пюре – Приготовьте клюкву, как для замораживания целиком. Добавьте 2 стакана воды на каждую кварту (1 фунт) ягод. Готовьте, пока кожица не лопнет. Отжать через сито.
Добавьте сахар по вкусу, примерно 2 стакана на каждую кварту (2 фунта) пюре. Упакуйте в контейнеры, оставив свободное пространство (стр. 9). Запечатать и заморозить.
Упакуйте в контейнеры, оставив свободное пространство (стр. 9). Запечатать и заморозить.
Крыжовник
Если замораживаете для пирога, выбирайте полностью спелые ягоды, для желе ягоды немного недозрелые.Отсортируйте, удалите стебли и кончики цветков и промойте.
Неподслащенная упаковка – Упаковка на лотках или упаковка в контейнеры без сахара. Оставьте место в голове. Запечатать и заморозить.
Пакет с сиропом – Упаковать в контейнеры. Залейте 50-процентным сиропом. Оставьте свободное пространство: запечатайте и заморозьте.
Грейпфруты, апельсины
Срезы или ломтики – Выбирайте твердые, созревшие на деревьях плоды, тяжелые для своего размера и без мягких пятен. Вымойте и очистите. Разделите фрукты на части, удалив все оболочки и семена.По желанию нарежьте апельсины. Для грейпфрута с большим количеством семян разрежьте фрукт пополам, удалите семена и вырежьте или выскоблите части.
Упакуйте фрукты в контейнеры. Залейте холодным 40-процентным сиропом, приготовленным из лишнего фруктового сока и воды, если требуется больше жидкости. Для лучшего качества добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа. Оставьте место в голове. Запечатать и заморозить.
Залейте холодным 40-процентным сиропом, приготовленным из лишнего фруктового сока и воды, если требуется больше жидкости. Для лучшего качества добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа. Оставьте место в голове. Запечатать и заморозить.
Сок – Выберите фрукты, как указано для разделов. Выжмите сок из фруктов, используя соковыжималку, которая не выдавливает масло из кожуры.
При желании подсластите 2 столовыми ложками сахара на литр сока или упакуйте без сахара. Для лучшего качества добавляйте ¾ чайной ложки кристаллической аскорбиновой кислоты на каждый галлон сока. Сразу же разливайте сок по емкостям. Во избежание появления посторонних привкусов сок разливают в стеклянные банки. Оставьте место в голове. Запечатать и заморозить.
Молотая вишня
Шелуха. Обварить 2 минуты. Упаковать в 40-процентный сироп. Оставьте место в голове. Запечатать и заморозить.
Дыни (мускусная дыня, креншоу, медовая роса, персидская, арбузная)
Пакет с сиропом – Выберите спелые хорошо окрашенные дыни с плотной мякотью. Разрежьте пополам, удалите семена и кожуру. Нарежьте дыню ломтиками, кубиками или шариками. Расфасовать по контейнерам и залить холодным 30-процентным сиропом. Оставьте место в голове. Запечатать и заморозить.
Разрежьте пополам, удалите семена и кожуру. Нарежьте дыню ломтиками, кубиками или шариками. Расфасовать по контейнерам и залить холодным 30-процентным сиропом. Оставьте место в голове. Запечатать и заморозить.
Неподслащенная упаковка – Выберите и приготовьте как для упаковки сиропа. Поместите в пакет для заморозки. Запечатать и заморозить. Подавать до полного оттаивания.
Нектарины
Половинки, четвертинки или ломтики – Выбирайте полностью спелые, хорошо окрашенные, твердые нектарины. Перезревшие плоды могут приобрести неприятный вкус при хранении в замороженном виде.
Сортировать, мыть и удалять косточки из фруктов. Очистите, если хотите. Разрезать на половинки, четвертинки или ломтики.
Нарежьте фрукты прямо в холодный 40-процентный сироп, начиная с ½ стакана на каждую пинту. Для лучшего результата добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа. Придавите фрукты и залейте сиропом, чтобы он покрыл их, оставляя свободное пространство. Запечатать и заморозить.
Запечатать и заморозить.
Пюре – Приготовьте так же, как персиковое пюре, описанное ниже.
Персики
Половинки и дольки – Персики, разделенные половинками и дольками, имеют лучшее качество, если они упакованы в сироп или с сахаром, но если подслащивание нежелательно, можно использовать пакет с водой.
Выберите твердые, спелые персики без зеленого цвета кожицы.
Сортировка, мойка, удаление косточек и кожура. Для более качественного продукта очищайте персики, не опуская их в кипяток. Нарезать по желанию.
Упаковка сиропа – Используйте 40-процентный сироп. Для лучшего качества продукта добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на каждый литр сиропа.
Поместите персики прямо в холодный сироп в контейнере, начиная с ½ стакана сиропа и заканчивая контейнером в пинту. Придавите фрукты и залейте сиропом, чтобы он покрыл их, оставляя свободное пространство.Запечатать и заморозить.
Сахарная упаковка – К каждой кварте (1 1/3 фунта) подготовленных фруктов добавьте b стакана сахара и хорошо перемешайте. Чтобы предотвратить потемнение, посыпьте персики растворенной в воде аскорбиновой кислотой перед добавлением сахара. Используйте ¼ чайной ложки кристаллической аскорбиновой кислоты в ¼ стакана холодной воды на каждый литр фруктов.
Упаковать в контейнеры, оставив свободное пространство. Запечатать и заморозить.
Пакет для воды – Упакуйте персики в контейнеры и залейте холодной водой, содержащей 1 чайную ложку кристаллической аскорбиновой кислоты на литр воды.Оставьте место в голове. Запечатать и заморозить.
Пюре – Чтобы снять кожицу, опустите персики в кипящую воду на ½–1 минуту. Чем спелее плод, тем меньше требуется ошпаривания. Остудить в холодной воде, снять кожицу и косточку.
Чтобы сделать пюре, протрите через сито или прогрейте персики без косточек в течение 4 минут в достаточном количестве воды, чтобы они не пригорели, и протрите через сито.
С каждой четвертью (2 фунта) протертых персиков смешайте 1 стакан сахара. Для лучшего качества добавьте 1 чайную ложку кристаллической аскорбиновой кислоты на каждый литр фруктов.
Упаковать в контейнеры, оставив свободное пространство. Запечатать и заморозить.
Груши
Половинки или четвертинки – Выбирайте хорошо созревшие и твердые, но не твердые груши. Вымойте фрукты в холодной воде. Очистите, разрежьте пополам или на четвертинки и удалите сердцевины.
Нагрейте груши в кипящем 40-процентном сиропе в течение 1-2 минут, в зависимости от размера кусочков. Слить и охладить.
Упакуйте груши в контейнеры и залейте холодным сиропом. Для лучшего результата добавьте ¾ чайной ложки кристаллической аскорбиновой кислоты в литр холодного сиропа.Оставьте место в голове. Запечатать и заморозить.
Ананас
Отборные крепкие спелые ананасы с полным вкусом и ароматом. Разделите и удалите сердцевину и глазки. Нарежьте ломтиками, кубиками, раздавите или нарежьте ананас дольками или брусочками.
Неподслащенная упаковка – Плотно упакуйте фрукты в контейнеры без сахара. Оставьте место в голове. Запечатать и заморозить.
Упаковка для сиропа – Плотно упакуйте фрукты в контейнеры. Залейте 30-процентным сиропом, приготовленным из ананасового сока, если он есть, или водой.Оставьте место в голове. Запечатать и заморозить.
Сливы и чернослив
Целиком, половинками или четвертинками – Выбирайте твердые, созревшие на дереве плоды насыщенного цвета. Сортировать и мыть. Оставьте целыми или разрежьте пополам или на четвертинки. Упакуйте одним из следующих способов.
Неподслащенная упаковка – Упаковывайте целые фрукты в контейнеры, оставляя свободное пространство. Запечатать и заморозить.
Чтобы подавать в сыром виде, опустите замороженные фрукты в холодную воду на 5–10 секунд, снимите кожицу и залейте 40-процентным сиропом для оттаивания.
Пакет для сиропа – Упакуйте нарезанные фрукты в контейнеры. Залейте фрукты холодным 40- или 50-процентным сиропом, в зависимости от терпкости фруктов. Для улучшения качества добавьте ½ чайной ложки кристаллической аскорбиновой кислоты на литр сиропа. Оставьте место в голове. Запечатать и заморозить.
Малина
Целые – Выбирайте полностью спелые, сочные ягоды. Переберите, тщательно промойте в холодной воде и тщательно обсушите.
Сахарная упаковка – К 1 литру (1 1/3 фунта) ягод добавьте ¾ стакана сахара и тщательно перемешайте, чтобы не раздавить.Разложите по контейнерам, оставив свободное пространство. Запечатать и заморозить.
Пакет с сиропом – Поместите ягоды в контейнеры и залейте холодным 40-процентным сиропом, оставив свободное пространство. Запечатать и заморозить.
Неподслащенная упаковка – Уложите ягоды в контейнеры, оставив свободное пространство. Запечатать и заморозить.
Измельченный или пюре – Приготовьте как целую малину, затем раздавите или протрите через сито для получения пюре.
На 1 литр (2 фунта) измельченных ягод или пюре добавьте от ¾ до 1 стакана сахара, в зависимости от сладости фруктов.Перемешивайте, пока сахар не растворится. Разложите по контейнерам, оставив свободное пространство. Запечатать и заморозить.
Ревень
Стебли или кусочки – Выбирайте твердые, нежные, хорошо окрашенные стебли с хорошим вкусом и небольшим количеством волокон. Вымойте, обрежьте и нарежьте на кусочки размером 1 или 2 дюйма или на куски, соответствующие размеру упаковки. Нагревание ревеня в кипящей воде в течение 1 минуты и быстрое охлаждение в холодной воде помогает сохранить цвет и вкус.
Неподслащенная упаковка – Упаковка на лотках или плотно упакованный сырой или подогретый ревень в контейнеры без сахара.Оставьте место в голове. Запечатать и заморозить.
Упаковка для пирогов – Используйте инструкции для яблок.
Упаковка сиропа – Сырой или подогретый и охлажденный ревень плотно упаковать в контейнеры, залить холодным 40-процентным сиропом. Оставьте место в голове. Запечатать и заморозить.
Сахарная упаковка – Смешайте сырой или подогретый и охлажденный ревень с ½ стакана сахара на литр приготовленных фруктов. Упаковать, оставив место над головой. Запечатать и заморозить.
Клубника
Целые – Выбирайте твердые, спелые, красные ягоды, желательно с легкой терпкостью.Крупные ягоды лучше нарезать или раздавить. Ягоды переберите, промойте в холодной воде, хорошо обсушите и удалите шелуху.
Сироп в упаковке – Ягоды уложить в контейнеры и залить холодным 50-процентным сиропом, оставив свободное пространство. Запечатать и заморозить.
Сахар в упаковке – Добавьте ¾ стакана сахара в 1 кварту (1 1/3 фунта) клубники и тщательно перемешайте. Разложите по контейнерам, оставив свободное пространство. Запечатать и заморозить.
Неподслащенная упаковка – Упаковка на лотках или упаковка в контейнеры, оставляя свободное пространство.Для лучшего цвета залить водой, содержащей 1 чайную ложку кристаллической аскорбиновой кислоты на литр воды. Запечатать и заморозить.
Нарезанные или измельченные – Подготовить к упаковке, как целую клубнику, затем нарезать или раздавить частично или полностью.
На 1 литр (1½ фунта) ягод добавьте ¾ стакана сахара; тщательно перемешать. Упакуйте в контейнеры, оставив место над головой. Запечатать и заморозить.
Пюре – Подготовьте клубнику, как для замораживания целиком. Затем протереть ягоды через сито.В 1 литр (2 фунта) пюре добавьте b стакана сахара и хорошо перемешайте. Разложите по контейнерам, оставив свободное пространство. Запечатать и заморозить.
■ Замораживание полуфабрикатов
Для успеха используйте только высококачественные продукты и ингредиенты, которые хорошо замораживаются. Упакуйте надлежащим образом, храните при температуре 0°F или ниже и используйте в течение рекомендованного срока хранения. Если вы не уверены в том, как замерзает приготовленная пища, попробуйте заморозить небольшую порцию, чтобы убедиться, что качество приемлемое.
Причины замораживания полуфабрикатов
- Можно избежать отходов, заморозив остатки.
- Время можно сэкономить, удвоив или утроив количество рецептов и заморозив лишнее.
- Еду можно приготовить, когда есть время.
- Еда может быть приготовлена в сезон или по особым случаям.
- Если вы готовите на одного или двоих, отдельные порции можно заморозить для последующего использования.
На заметку
- Ожидайте некоторых изменений в уровне приправ замороженных блюд. Приправьте умеренно и приправьте по вкусу при повторном нагревании.
- Добавляйте крошку или сырную начинку непосредственно перед повторным разогревом.Они имеют тенденцию становиться сырыми или сухими при замораживании.
- Обычно рекомендуется слегка недоваривать продукты, чтобы их можно было дополнительно приготовить при повторном разогреве. Некоторые эксперименты могут быть необходимы.
- Быстро охладите продукты, предназначенные для замораживания, поместив контейнер с горячими продуктами в кастрюлю или раковину с ледяной водой.
- Упакуйте продукты в количестве, соответствующем размеру порции, в соответствующий материал для заморозки (см. стр. 21-22).
- Формы для выпечки можно застелить фольгой или полиэтиленовой пленкой, продукты в них замораживаются, а затем вынимаются и должным образом заворачиваются для хранения в морозильной камере (см. стр. 22, обертка для запеканки).
■ Замораживание продуктов животного происхождения
Мясо, птица и рыба
Замораживание — лучший способ сохранить хороший вкус и текстуру мяса, птицы и рыбы.
ПЛАНЫ ДЛЯ ЗАМОРАЖИВАНИЯ
- Изучите потребности и использование домашнего хозяйства. Чтобы мясо было высшего качества, его следует использовать в течение рекомендуемого времени хранения.
- Подумайте, сколько места в холодильнике вы хотите выделить для этих продуктов. Кубический фут морозильной камеры вмещает от 30 до 35 фунтов мяса.
- Покупайте специальные предложения и пользуйтесь сезонными пиками продаж.
- Обработанное вяленое мясо, такое как ветчина и бекон, следует замораживать только на 1–3 месяца, поскольку высокое содержание соли и жира ускоряет прогоркание.
ОБЩИЕ СОВЕТЫ ДЛЯ УСПЕШНОЙ ЗАМОРАЖИВАНИЯ
- Заморозьте мясо как можно скорее после убоя и как можно скорее после покупки, чтобы гарантировать свежесть и высокое качество.
- Обрежьте лишний жир и удалите кости, если это возможно, или накройте острые выступающие кости сложенной бумагой для замораживания или фольгой, чтобы они не проткнули внешнюю обертку.
- Замораживание мяса в кусках и упаковках размером с еду. Поместите двойной слой морозильной пленки между отдельными кусочками.
- Не приправляйте мясо перед заморозкой, чтобы продлить срок его хранения в морозильной камере.
- Фрикадельки, кубики говядины, отбивные или мясные котлеты можно заморозить на лотках (см. стр. 14), а затем упаковать в пакеты для заморозки.
- Материалы, используемые для упаковки мяса, рыбы и птицы, должны иметь те же характеристики, что и материалы, используемые для замораживания других пищевых продуктов (см. стр. 3).
- Упаковки должны быть герметичными для сохранения качества.
- Магазинная упаковка мяса с прилавков самообслуживания не предназначена для хранения в морозильной камере более двух недель. Переверните или заверните для более длительного хранения.
- Обертка, используемая мясниками, может быть как с покрытием, так и без покрытия. Покрытая пригодна для использования в морозильной камере, а непокрытая неудовлетворительна.
- Мясо в вакуумной упаковке можно заморозить в неповрежденной упаковке на срок от одного до трех месяцев.
УПАКОВКА
Красное мясо
Пакеты или контейнеры для замораживания можно использовать для замораживания мясного фарша, тушеного мяса или другого мяса, замороженного небольшими порциями.
Мясо можно обернуть в аптечную или мясную пленку (см. стр. 23-24). Аптечная пленка предпочтительнее, за исключением неравномерной мясной нарезки. Мясная пленка больше подходит для них.
Лард
Замораживание помогает предотвратить прогорклость. Используйте стеклянные банки или пластиковые контейнеры. Сделайте герметичное уплотнение.
Для дополнительной защиты от прогорклости приобретите коммерческий антиоксидант в шкафчике или в аптеке. Используйте его в соответствии с инструкциями производителя или добавляйте свежий гидрогенизированный растительный жир в топленое сало, используя следующую пропорцию: 2-3 фунта растительного жира на 50 фунтов сала.Тщательно перемешайте, пока еще горячий. Разлить по небольшим емкостям, наполняя доверху.
■ МЕТОДЫ УПАКОВКИ
Аптечная упаковка
Отрежьте достаточно упаковочного материала, чтобы обернуть продукт примерно 1,5 раза или достаточно, чтобы при упаковке получилось три сгиба по 1 дюйму.
- Поместите мясо в центр упаковки.
- Соедините два противоположных края упаковки вместе по центру над продуктом.
- Сложите края вниз серией складок глубиной от ½ до 1 дюйма, пока складка не будет прилегать к пище.
- Прижмите складку к продукту, выдавливая воздух.
- Переверните пакет. Сожмите концы, чтобы удалить воздух.
- Сгиб заканчивается двойным сгибом.
- Соберите концы и надежно закрепите шнуром или липкой лентой. Этикетка.
Мясная упаковка
Лучше всего подходит для объемных продуктов неправильной формы. Отрежьте достаточное количество пленки, чтобы дважды обойти еду.
- Поместите продукты в один угол упаковки.
- Сложите продукты и заверните два раза в направлении противоположного угла.
- Сложите концы вверх, выталкивая воздух при складывании.
- Подвернув концы, продолжайте складывать продукты и заворачивать.
- Плотно затяните конец и закрепите шнуром или липкой лентой. Этикетка.
Обертка для запеканки
Позволяет повторно использовать форму для выпечки после замораживания продуктов.
- Форму для запекания застелите плотной фольгой*, оставив бортик из фольги шириной 1,5 дюйма по краям.
- Поместите продукты в блюдо, застеленное фольгой. Накрыть листом фольги по размеру формы и бортиком из фольги.Выдавите воздух из центра; сложите края вместе, запечатывая плотно.
- Промаркируйте и заморозьте. Когда продукты замерзнут, снимите их с посуды и верните в морозильную камеру.
*Вы можете использовать полиэтиленовую пленку для замораживания, которую можно использовать для застилания форм для выпечки. Обертка должна быть достаточно большой, чтобы ее можно было завернуть сверху для герметизации.
Пакетная упаковка
Подходит для нестандартных форм и полувлажных продуктов. В этой пленке можно запекать или жарить продукты.
- Разместите продукты по центру на квадрате из плотной фольги, достаточно большом для удобной упаковки.
- Соедините четыре угла фольги в форме пирамиды.
- Сложите открытые края закрытыми складками, выдавливая воздух, пока фольга не будет плотно прилегать к пище. Этикетка.
■ ПТИЦА
Охладите домашнюю птицу в холодильнике при температуре ниже 40 F, 6 часов для бройлеров и 24 часа для более взрослых птиц. Если места в холодильнике нет, его можно охладить в течение двух-трех часов в большой ванне с ледяной водой.
Упаковка
Потроха завернуть отдельно от птицы.Уложите птицу так, чтобы получилась компактная плоская упаковка. Птицы, замороженные целиком, привяжите крылья и ноги тесно к телу.
Птица может быть завернута в упаковку для замораживания или помещена в пакеты для замораживания. Удалите как можно больше воздуха. Пластиковые пакеты для заморозки соответствуют форме птицы неправильной формы. Хороший способ удалить воздух — поместить птицу в пакет, а затем опустить пакет в кастрюлю с холодной водой. Это нагнетает
воздуха наверх. Быстро скрутите верхушку в гусиную шейку и закрепите. Тщательно высушите мешок.
Предупреждение: Не фаршируйте птиц до замораживания. Время, необходимое фаршу для охлаждения в тушке перед замораживанием, а также для оттаивания и повторного нагревания, может быть достаточно длительным, чтобы обеспечить рост бактерий, вызывающих порчу пищевых продуктов и пищевое отравление.
Розовое мясо — темные кости
Иногда мясо вокруг костей молодых цыплят-бройлеров выглядит розовым или сырым, даже если оно тщательно приготовлено. Считается, что этот цвет исходит от гемоглобина в костях молодых птиц. Обычно это больше проявляется при длительном, медленном приготовлении или в замороженной курице.Мясо безопасно есть.
Кости в приготовленной курице иногда приобретают темно-бордовый цвет. Этот цвет обычно больше проявляется у замороженной курицы и связан с гемоглобином. На сохранность курицы это не влияет.
■ РЫБА
Неправильно замороженная рыба приобретает неприятный вкус, становится сухой и жесткой. Существует ряд альтернативных методов правильной заморозки рыбы.
Держите свежую рыбу как можно более холодной. Очистите их немедленно и заморозьте сразу.
Чистая рыба как для немедленного употребления.Тщательно промойте. Если есть проблема со слизью, промойте рыбу раствором одной чайной ложки уксуса на три литра холодной воды.
Оставьте рыбу целиком или крупными кусками, если она будет храниться более трех месяцев.
Предварительная обработка
Рыба бывает жирной и нежирной. К жирной рыбе относятся кефаль, скумбрия, форель, тунец, лосось и сиг. К постной рыбе относятся камбала, треска, путассу, окунь и большинство пресноводных рыб.
Предварительная обработка перед замораживанием улучшает качество рыбы, хранящейся более четырех-шести месяцев.
Поместите жирную рыбу в раствор с аскорбиновой кислотой на 20 секунд (2 столовые ложки аскорбиновой кислоты на 1 литр холодной воды), чтобы уменьшить прогорклость и изменение вкуса. Заверните и сразу же заморозьте.
Погрузите нежирную рыбу в охлажденный солевой рассол из ¼ стакана соли на 1 литр воды на 20 минут. Эта обработка укрепляет рыбу и уменьшает потерю жидкости при размораживании.
Упаковка
Один из лучших способов — обернуть рыбу пищевой пленкой, а затем обернуть пленкой для замораживания.Выдавите как можно больше воздуха.
Рыба может быть помещена в пакеты для замораживания. Погрузите пакет в кастрюлю с холодной водой, чтобы выпустить воздух. Не допускайте попадания воды в мешок. Запечатайте пакет, скрутив его и сделав гусиную шею.
■ АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ЗАМОРАЖИВАНИЯ
Глазури
Лед — заморозить неупакованную рыбу. Затем окуните замороженную рыбу в почти ледяную воду и верните в морозильную камеру. Повторяйте эту последовательность, пока глазурь не станет толщиной от ¼ дюйма. Будьте осторожны, чтобы не повредить глазурь при обращении с рыбой.Заверните глазированную рыбу для хранения.
Желатин
Для приготовления глазури:
- Отмерьте ¼ чашки лимонного сока в литровую банку. Заполните остальную часть контейнера водой.
- Растворите один пакет неприправленного желатина в ½ стакана смеси лимонного сока и воды.
- Нагрейте оставшуюся жидкость до кипения.
- Вмешайте растворенный желатин в кипящую жидкость.
- Охладите смесь до комнатной температуры.
Окуните рыбу в глазурь и слейте воду на несколько секунд.Глазури хватит примерно на десяток филе среднего размера. Заверните глазированную рыбу и заморозьте.
Вода
Поместите рыбу в контейнер и залейте водой. Слишком много воды и большие контейнеры будут вытягивать питательные вещества, заставлять рыбу медленно замерзать и придавать ей мягкую текстуру из-за давления льда.
Вы должны сначала заморозить рыбу, а затем добавить холодную воду и снова заморозить. Это ускоряет замерзание и уменьшает давление на мясо рыбы.
Копченую рыбу можно хранить в холодильнике в течение двух-трех недель.Не храните копченую рыбу в герметичных контейнерах в холодильнике. Для более длительного хранения рыбу можно заморозить сразу после копчения. Использовать в течение трех месяцев. Использовать в течение нескольких дней после оттаивания.
Креветки могут быть замороженными, вареными или сырыми, в панцире или без панциря. Для максимального срока хранения и качества заморозьте сырые креветки с удаленной головой и темной жилкой, но с оболочкой. Креветки можно положить в неглубокую кастрюлю, залить водой, заморозить и завернуть.
Обязательно промойте и высушите креветки, если они заморожены в сыром виде.Быстро охладите приготовленные креветки.
Устрицы должны быть свежими и живыми. Очистите устриц и промойте мясо в свежей подсоленной воде (½ стакана соли на 1 галлон холодной воды). Слить, упаковать и заморозить.
■ РАЗМОРАЖИВАНИЕ И ПОДГОТОВКА МЯСА, РЫБЫ И ПТИЦЫ
Замороженное мясо, птицу и рыбу лучше всего размораживать в холодильнике в оригинальной упаковке на самой нижней полке контейнера. Для более быстрого оттаивания поместите мясо или рыбу в непромокаемую пленку в холодную воду. Меняйте воду по мере необходимости, чтобы она оставалась холодной.Вы можете разморозить эти продукты в микроволновой печи. Для лучшего качества готовьте размороженное мясо и рыбу сразу.
Мясо, птицу и рыбу можно готовить из замороженного состояния, но необходимо предусмотреть дополнительное время для приготовления. Количество дополнительного времени зависит от размера и формы изделия. Большое замороженное жаркое может занять в полтора раза больше времени. Для приготовления небольших кусочков замороженной рыбы может потребоваться в два раза больше времени, чем для приготовления свежей или размороженной.
Если вы планируете панировать и жарить замороженное мясо, птицу или рыбу, их следует сначала хотя бы частично разморозить, чтобы с ними было легче обращаться.Всю фаршированную птицу следует полностью разморозить в целях безопасности.
■ МОЛОЧНЫЕ ПРОДУКТЫ
Сливочное масло — Замораживайте только высококачественное сливочное масло, изготовленное из пастеризованных сливок. Оберните магазинную упаковку морозильной оберткой. Несолёное масло теряет вкус, поэтому срок его хранения сокращается. Ароматизированное масло хорошо замораживается.
Сыр — Твердые или полутвердые сыры могут быть заморожены. Замороженный сыр будет рассыпчатым и немного сухим и не будет так хорошо резаться, но вкус будет таким же хорошим, как у свежего сыра.Заморозьте сыр небольшими кусочками — не более ½ фунта на кусок. Запечатайте его в фольгу, морозильную пленку, полиэтиленовую пленку или пакет.
Творог — Сливочный и сухой творог и сыр рикотта можно заморозить на месяц. Сливочный стиль может отделиться при оттаивании.
Сливочный сыр — можно заморозить для последующего использования в кулинарии, соусах или в качестве глазури.
Сырные пищевые продукты , такие как соусы, соусы, плавленый сыр — ароматизированный или простой — обычно хорошо замораживаются.Если вы действительно сомневаетесь, заморозьте небольшое количество и проверьте через 24 часа, разморозив его. Если вы довольны результатом, заморозьте остальные. В противном случае не замерзнуть.
Сливки — Замораживание только густых сливок, содержащих 40 или более процентов жира масла. Более легкие сливки и пополам плохо замораживаются. Сливки, которые были заморожены, не взбиваются до обычного объема. Взбитые сливки можно подсластить по вкусу и заморозить отдельными порциями. Лоток-заморозка в курганах.
Мороженое — Пластиковая пленка, плотно уложенная на поверхность частично использованных контейнеров с мороженым, помогает предотвратить изменение поверхности.Домашнее мороженое трудно хранить в течение длительного времени, потому что оно становится зернистым. Чтобы предотвратить это, в коммерческие продукты добавляют сухое молоко и желатин.
Молоко — Молоко гомогенизированное пастеризованное может быть заморожено, в том числе с низким содержанием жира и обезжиренное. Некоторое изменение качества может быть отмечено при оттаивании. Перемешивание или встряхивание может помочь восстановить гладкость.
Сметана, йогурт и пахта — Все кисломолочные кисломолочные продукты при замораживании теряют свою гладкую консистенцию.Они становятся зернистыми и иногда выделяют воду. Их еще можно использовать для приготовления пищи. Ароматизированные йогурты могут быть более устойчивыми из-за фруктов и сахара. При размораживании вкус может быть более кислым.
■ ЯЙЦА
Яйца можно хранить не менее одного месяца в закрытом виде в холодильнике. Замораживание часто не требуется.
Цельные яйца — Тщательно перемешайте желтки и белки. Не взбивайте в воздухе. Чтобы предотвратить зернистость, добавьте 1 столовую ложку сахара или ½ чайной ложки соли на чашку целых яиц, в зависимости от предполагаемого использования.Процедить через сито или дуршлаг для улучшения однородности. Пакет, обеспечивающий свободное пространство ½ дюйма. Запечатать и заморозить.
Другой метод заморозки цельнояичной смеси заключается в использовании лотков для льда. Отмерьте по 3 столовые ложки яичной смеси в каждое отделение формочки для льда. Заморозьте до твердого состояния. Достаньте замороженные кубики и упакуйте во влаго- и паронепроницаемые контейнеры. Запечатать и заморозить. Три столовые ложки яичной смеси равны одному целому яйцу.
Яичные желтки — Отдельные яйца. Аккуратно перемешайте.Чтобы предотвратить зернистость, добавьте 2 столовые ложки сахара или 1 чайную ложку соли на чашку яичных желтков, в зависимости от предполагаемого использования. Процедить через сито. Пакет, обеспечивающий свободное пространство ½ дюйма. Запечатать и заморозить. Одна столовая ложка желтковой смеси равна одному яичному желтку.
Яичные белки — Аккуратно смешайте белки. Процедить через сито. Упакуйте, оставив свободное пространство ½ дюйма. Запечатать и заморозить. Две столовые ложки смеси яичных белков равны одному яичному белку.
■ Размораживание молочных продуктов и яиц
Масло, яйца, молоко, сливки и сыр — Поместите замороженный продукт в холодильник для оттаивания.После оттаивания использовать как свежий. Используйте вскоре после оттаивания. Не замораживайте повторно.
Возможно, вам придется немного смешать сливки и молоко.
■ ДОПОЛНИТЕЛЬНЫЕ СОВЕТЫ И ДОПОЛНИТЕЛЬНАЯ ПРОДУКЦИЯ
Детское питание (домашнее приготовление) — Замораживание порциями размером с еду в формочках для кубиков льда или формах для кексов. Поместите в пакеты для заморозки после того, как они заморозятся. Разморозить в холодильнике.
Панировочные сухари и гренки в пакетах для заморозки остаются свежими в морозильной камере.
Коричневый сахар можно завернуть и заморозить.При оттаивании он будет мягким.
Кофе (молотый или в зернах) — оставайтесь свежим в морозильной камере.
Крекеры и чипсы остаются хрустящими, если они плотно упакованы и заморожены.
Сухофрукты остаются свежими и влажными в замороженном виде, и их легче измельчить в замороженном виде.
Травы (свежие) — Промыть, слить воду и обсушить бумажными полотенцами. Заверните несколько веточек или листьев в морозильную пленку и поместите в контейнер для морозильной камеры. Запечатать и заморозить.Их можно использовать в приготовленных блюдах, но обычно они не подходят для гарниров, потому что при оттаивании становятся мягкими.
Джемы и желе — Джемы и желе обычной варки хорошо замораживаются. Те, что сделаны с желатином, могут сломаться во время заморозки.
Маргарин См. масло.
Взбитое масло и маргарин — Не следует хорошо замораживать, так как эмульсия может разрушиться, и продукт может расслоиться.
легко режется в замороженном виде и не прилипает к ножу.
Орехи — Орехи в скорлупе, сохраняющие ядра как можно более целыми. Нанесите тонким слоем на 24 часа. Упаковать в герметичные пакеты для заморозки. Орехи хорошо хранятся в замороженном виде до 6 месяцев. Соленые или приправленные орехи хранятся вдвое меньше.
Масла — Замораживание предотвращает прогорклость. Вы можете процедить и заморозить масло, которое использовалось для жарки во фритюре, для повторного использования. Масло мутнеет при замерзании, но становится прозрачным при оттаивании.
Квашеная капуста — Замораживание останавливает брожение.Замороженная квашеная капуста может храниться до 12 месяцев.
Проростки — Различные проростки семян, такие как люцерна, маш, нут, соевые бобы и т. д., могут быть заморожены. Сначала промойте носики и удалите семенные оболочки. Нагревайте один слой за раз на пару в течение 3 минут. Быстро охладить в холодной воде и слить. Упаковать, промаркировать и заморозить.
11.4 Коллигативные свойства – Химия
Цели обучения
К концу этого раздела вы сможете:
- Выразите концентрацию компонентов раствора, используя молярную долю и моляльность
- Описать влияние концентрации растворенного вещества на различные свойства раствора (давление пара, температуру кипения, точку замерзания и осмотическое давление)
- Выполнение расчетов с использованием математических уравнений, описывающих эти различные коллигативные эффекты
- Описать процесс дистилляции и его практическое применение
- Объясните процесс осмоса и опишите, как он применяется в промышленности и в природе
Свойства раствора отличаются от свойств чистого растворенного вещества или растворителя.Многие свойства растворов зависят от химической идентичности растворенного вещества. По сравнению с чистой водой раствор хлористого водорода более кислый, раствор аммиака более щелочной, раствор хлорида натрия более плотный, а раствор сахарозы более вязкий. Однако есть несколько свойств растворов, которые зависят только от общей концентрации растворенных веществ, независимо от их идентичности. Эти коллигативные свойства включают снижение давления паров, повышение точки кипения, понижение точки замерзания и осмотическое давление.Этот небольшой набор свойств имеет центральное значение для многих природных явлений и технологических приложений, которые будут описаны в этом модуле.
Несколько единиц, обычно используемых для выражения концентраций компонентов раствора, были введены в предыдущей главе этого текста, каждая из которых обеспечивает определенные преимущества для использования в различных приложениях. Например, молярность ( M ) является удобной единицей для использования в стехиометрических расчетах, поскольку она определяется молярными количествами растворенных веществ:
[латекс] М = \ гидроразрыва {\ текст {моль \; раствор}} {\ текст {L \; раствор}} [/ латекс]
Поскольку объемы растворов меняются в зависимости от температуры, молярные концентрации также будут меняться.При выражении в молярности концентрация раствора с одинаковым количеством растворенных веществ и растворителей будет разной при разных температурах из-за сжатия/расширения раствора. Более подходящими для расчетов, включающих многие коллигативные свойства, являются единицы концентрации на основе молей, значения которых не зависят от температуры. Двумя такими единицами являются молярная доля (введенная в предыдущей главе о газах) и моляльность .
Молярная доля, X , компонента представляет собой отношение его молярного количества к общему количеству молей всех компонентов раствора:
[латекс] X _ {\ text {A}} = \ frac {\ text {моль \; A}} {\ text {всего \; моль \; всех \; компонентов}} [/latex]
Моляльность – единица концентрации, определяемая как отношение числа молей растворенного вещества к массе растворителя в килограммах:
[латекс] м = \frac{\text{моль\;раствор}}{\text{кг\;растворитель}}[/латекс]
Поскольку эти единицы вычисляются с использованием только масс и молярных количеств, они не меняются в зависимости от температуры и, таким образом, лучше подходят для приложений, требующих температурно-независимых концентраций, включая несколько коллигативных свойств, как будет описано в модуле этой главы.
Пример 1
Расчет молярной доли и молярности
Антифриз в большинстве автомобильных радиаторов представляет собой смесь равных объемов этиленгликоля и воды с небольшим количеством других добавок, предотвращающих коррозию. Каковы (a) молярная доля и (b) молярность этиленгликоля C 2 H 4 (OH) 2 в растворе, приготовленном из 2,22 × 10 3 г этилена? гликоля и 2,00 × 10 3 г воды (приблизительно 2 л гликоля и 2 л воды)?
Раствор
(a) Молярную долю этиленгликоля можно рассчитать, сначала вычислив молярные количества обоих компонентов раствора, а затем подставив эти количества в определение единицы измерения.
[латекс]\текст{моль\;С}_2\текст{Н}_4(\текст{ОН})_2 = 2220\;\текст{г}\;\раз\;\фракция{1\;\текст {моль\;С}_2\текст{Н}_4(\текст{ОН})_2}{62,07\;\текст{г\;С}_2\текст{Н}_4(\текст{ОН})_2} = 35,8\;\text{моль\;C}_2\text{H}_4(\text{OH})_2[/latex]
[латекс]\text{mol\;H}_2\text{O} = 2000\;\text{g}\;\times\;\frac{1\;\text{mol\;H}_2\text{O}}{18.02\;\text{g\;H}_2\text {O}} = 11,1\;\text{моль\;H}_2\text{O}[/латекс]
[латекс]X_{\text{этилен\;гликоль}} = \frac{35,8\;\text {моль\;С}_2\текст{Н}_4(\текст{ОН})_2}{(35.8\;+\;11.1)\;\text{моль\;всего}} = 0,763[/латекс]
Обратите внимание, что молярная доля — это безразмерное свойство, представляющее собой отношение свойств с одинаковыми единицами измерения (молями).
(б) Чтобы найти моляльность, нам нужно знать количество молей растворенного вещества и массу растворителя (в кг).
Сначала используйте заданную массу этиленгликоля и его молярную массу, чтобы найти количество молей растворенного вещества:
[латекс] 2220\;\text{g\;C}_2\text{H}_4(\text{OH})_2\;(\frac{\text{mol\;C}_2\text{H} _2(\text{ОН})_2}{62.07\;\text{g}}) = 35,8\;\text{моль\;C}_2\text{H}_4(\text{OH})_2[/latex]
Затем переведите массу воды из граммов в килограммы:
[латекс]2000\;\text{g\;H}_2\text{O}\;(\frac{1\;\text{kg}}{1000\;\text{g}}) = 2\ ;\text{кг\;H}_2\text{O}[/латекс]
Наконец, рассчитайте молярность по его определению:
[латекс]\begin{array}{r @{{}={}} l} \text{моляльность} & \frac{\text{моль\;раствор}}{\text{кг\;растворитель}} \ \[1em] \text{моляльность} & \frac{35,8\;\text{моль\;C}_2\text{H}_4(\text{OH})_2}{2\;\text{кг\; H}_2\text{O}} \\[1em] \text{моляльность} & 17.9\;м \конец{массив}[/латекс]
Проверьте свои знания
Каковы молярная доля и молярность раствора, содержащего 0,850 г аммиака NH 3 , растворенного в 125 г воды?
Ответ:
7,14 × 10 −3 ; 0,399 м
Пример 2
Преобразование мольных долей и молярных концентраций
Рассчитайте мольные доли растворенного вещества и растворителя в 3,0 м растворе хлорида натрия.
Решение
Преобразование одной единицы концентрации в другую осуществляется путем сравнения двух определений единиц измерения. В этом случае обе единицы имеют одинаковый числитель (моли растворенного вещества), но разные знаменатели. Предоставленная молярная концентрация может быть записана как:
[латекс]\frac{3.0\;\text{моль\;NaCl}}{1.0\;\text{кг\;H}_2\text{O}}[/latex]
Таким образом, числитель мольной доли этого раствора равен 3,0 моль NaCl. Знаменатель можно вычислить, вычислив молярное количество воды, соответствующее 1.0 кг
[латекс]1.0\;\text{кг\;H}_2\text{O}\;(\frac{1000\;\text{g}}{1\;\text{kg}})(\frac {\ text {моль \; H} _2 \ text {O}} {18,02 \; \ text {g}}) = 55 \; \ text {mol \; H} _2 \ text {O} [/latex]
, а затем подставив эти молярные количества в определение мольной доли.
[латекс] \ begin {array} {r @ {{} = {}} l} X _ {\ text {H} _2 \ text {O}} & \ frac {\ text {mol \; H} _2 \ text {O}}{\text{моль\;NaCl}\;+\;\text{моль\;H}_2\text{O}} \\[0.75em] X_{\text{H}_2\text{ O}} & \frac{55\;\text{mol\;H}_2\text{O}}{3.0\;\text{моль\;NaCl}\;+\;55\;\text{моль\;H}_2\text{O}} \\[0.75em] X_{\text{H}_2\text {O}} & 0,95 \\[0,75em] X_{\text{NaCl}} & \frac{\text{моль\;NaCl}}{\text{моль\;NaCl}\;+\;\text{ моль\;H}_2\text{O}} \\[0,75 см] X_{\text{NaCl}} & \frac{3,0\;\text{моль\;NaCl}}{3,0\;\text{моль \;NaCl}\;+\;55\;\text{моль\;H}_2\text{O}} \\[0,75em] X_{\text{NaCl}} & 0,052 \end{массив}[/ латекс]
Проверьте свои знания
Молярная доля йода, I 2 , растворенного в дихлорметане, CH 2 Cl 2 , равна 0.115. Какова молярная концентрация м йода в этом растворе?
Как описано в главе о жидкостях и твердых телах, равновесное давление паров жидкости — это давление, оказываемое ее газообразной фазой, когда испарение и конденсация происходят с равными скоростями:
[латекс]\текст{жидкость}\;{\leftrightharpoons}\;\текст{газ}[/латекс]
Растворение нелетучего вещества в летучей жидкости приводит к снижению давления паров жидкости.Это явление можно объяснить, если рассмотреть влияние добавленных молекул растворенного вещества на процессы испарения и конденсации жидкости. Для испарения молекулы растворителя должны находиться на поверхности раствора. Присутствие растворенного вещества уменьшает площадь поверхности, доступную для молекул растворителя, и тем самым снижает скорость испарения растворителя. Поскольку на скорость конденсации не влияет присутствие растворенного вещества, конечным результатом является то, что равновесие испарения-конденсации достигается с меньшим количеством молекул растворителя в паровой фазе (т.е., при более низком давлении пара) (рис. 1). Хотя эта кинетическая интерпретация полезна, она не учитывает несколько важных аспектов коллигативной природы снижения давления пара. Более строгое объяснение включает в себя свойство энтропии , предмет обсуждения в более поздней текстовой главе по термодинамике. В целях понимания снижения давления паров жидкости достаточно отметить, что большая энтропия раствора по сравнению с его отдельными растворителем и растворенным веществом служит для эффективной стабилизации молекул растворителя и предотвращения их испарения.В результате получается более низкое давление паров и, соответственно, более высокая температура кипения, как описано в следующем разделе этого модуля.
Рисунок 1. Присутствие нелетучих растворенных веществ снижает давление паров раствора, препятствуя испарению молекул растворителя.Связь между давлением пара компонентов раствора и концентрацией этих компонентов описывается законом Рауля : Парциальное давление любого компонента идеального раствора равно давлению пара чистого компонента, умноженному на его моль дробь в растворе. {\ circ} [/ латекс]
Сначала рассчитайте молярные количества каждого компонента раствора, используя предоставленные данные о массе.
[латекс]92.1\; \rule[0.5ex]{5.5em}{0.1ex}\hspace{-5.5em}\text{g\;C}_3\text{H}_5(\text{OH})_3\;\times\; \frac{1\;\text{mol\;C}_3\text{H}_5(\text{OH})_3}{92,094\; \rule[0.25ex]{4.25em}{0.1ex}\hspace{-4.25em}\text{g\;C}_3\text{H}_5(\text{OH})_3} = 1.00\;\ текст{моль\;С}_3\текст{Н}_5(\текст{ОН})_3[/латекс]
[латекс]184,4\; \rule[0.5ex]{5em}{0.1ex}\hspace{-5em}\text{g\;C}_2\text{H}_5\text{OH}\;\times\;\frac{1\ ;\text{моль\;C}_2\text{H}_5\text{OH}}{46,069\; \rule[0.25ex]{3.75em}{0.1ex}\hspace{-3.{\circ} = 0,800\;\times\;0,178\;\text{атм} = 0,142\;\текст{атм}[/латекс]
Check Your Learning
Раствор содержит 5,00 г мочевины, CO(NH 2 ) 2 (нелетучее растворенное вещество) и 0,100 кг воды. Если давление паров чистой воды при 25°С равно 23,7 торр, каково давление пара над раствором?
Как описано в главе, посвященной жидкостям и твердым веществам, точка кипения жидкости — это температура, при которой давление ее паров равно атмосферному давлению окружающей среды.Поскольку давление паров раствора снижается из-за присутствия нелетучих растворенных веществ, само собой разумеется, что температура кипения раствора впоследствии будет повышаться. Следовательно, по сравнению с чистым растворителем раствору потребуется более высокая температура для достижения любого заданного давления пара, в том числе эквивалентного давлению окружающей атмосферы. Повышение температуры кипения, наблюдаемое при растворении нелетучего растворенного вещества в растворителе, Δ T b , называется повышением температуры кипения и прямо пропорционально молярной концентрации растворенных веществ:
[латекс] {\ Delta} T _ {\ text {b}} = K _ {\ text {b}} м [/ латекс]
, где K b — константа повышения точки кипения или эбуллиоскопическая постоянная , а m — моляльная концентрация (моляльность) всех растворенных веществ.
Константы повышения температуры кипения являются характерными свойствами, которые зависят от типа растворителя. Значения K b для нескольких растворителей приведены в таблице 2.
| Растворитель | Температура кипения (°C при 1 атм) | К б (С м −1 ) | Температура замерзания (°C при 1 атм.) | К f (С м −1 ) |
|---|---|---|---|---|
| вода | 100.0 | 0,512 | 0,0 | 1,86 |
| гидроацетат | 118,1 | 3,07 | 16,6 | 3,9 |
| бензол | 80,1 | 2,53 | 5,5 | 5.12 |
| хлороформ | 61,26 | 3,63 | −63,5 | 4,68 |
| нитробензол | 210,9 | 5,24 | 5.67 | 8.1 |
| Таблица 2. Константы повышения температуры кипения и понижения температуры замерзания для нескольких растворителей | ||||
Степень снижения давления паров растворителя и повышения температуры кипения зависит от общего количества частиц растворенного вещества, присутствующих в данном количестве растворителя, а не от массы, размера или химической идентичности частиц . 1 м водного раствора сахарозы (342 г/моль) и 1 м водного раствора этиленгликоля (62 г/моль) будут иметь одинаковую точку кипения, поскольку каждый раствор содержит один моль растворенных частиц (молекул). на килограмм растворителя.{\ circ} \ text {C} [/латекс]
Проверьте свои знания
Какова температура кипения антифриза, описанного в примере 1?
Пример 5
Температура кипения раствора йода
Найти температуру кипения раствора 92,1 г йода I 2 в 800,0 г хлороформа CHCl 3 , считая, что йод нелетуч и раствор идеально.
Решение
Мы можем решить эту задачу, выполнив четыре шага.
- Преобразуйте граммы в моли I 2 , используя молярную массу I 2 в коэффициенте перевода единиц.
Результат: 0,363 моль - Определите моляльность раствора, исходя из числа молей растворенного вещества и массы растворителя в килограммах.
Результат: 0,454 м - Используйте прямую зависимость между изменением точки кипения и молярной концентрацией, чтобы определить, насколько изменится точка кипения.
Результат: 1,65 °C - Определить новую точку кипения по температуре кипения чистого растворителя и изменению.
Результат: 62,91 °C
Проверяйте каждый результат как самооценку.
Check Your Learning
Какова температура кипения раствора 1,0 г глицерина C 3 H 5 (OH) 3 в 47,8 г воды? Предположим идеальное решение.
Дистилляция — это метод разделения компонентов смесей, который широко применяется как в лабораторных, так и в промышленных условиях.Он используется для очистки нефти, выделения продуктов брожения и очистки воды. Этот метод разделения включает в себя контролируемый нагрев смеси образцов для селективного испарения, конденсации и сбора одного или нескольких представляющих интерес компонентов. Типичный аппарат для перегонки в лабораторных условиях показан на рис. 2.
Рисунок 2. Типичная лабораторная дистилляционная установка показана на (а) фотографии и (б) схематическом изображении компонентов. (кредит a: модификация работы «Rifleman82»/Wikimedia commons; кредит b: модификация работы «Slashme»/Wikimedia Commons)Нефтеперерабатывающие заводы используют крупномасштабную фракционную перегонку для разделения компонентов сырой нефти.Неочищенная нефть нагревается до высоких температур в основании высокой ректификационной колонны , испаряя многие из компонентов, которые поднимаются внутри колонны. По мере того, как испаряющиеся компоненты достигают достаточно прохладных зон во время своего подъема, они конденсируются и собираются. Собранные жидкости представляют собой более простые смеси углеводородов и других нефтяных соединений, состав которых подходит для различных применений (например, дизельное топливо, керосин, бензин), как показано на рисунке 3.
Рис. 3. Сырая нефть представляет собой сложную смесь, которая разделяется путем крупномасштабной фракционной перегонки для выделения различных более простых смесей.Растворы замерзают при более низких температурах, чем чистые жидкости. Это явление используется в схемах «противообледенения», в которых для растапливания льда на дорогах и тротуарах используется соль (рис. 4), хлорид кальция или мочевина, а также при использовании этиленгликоля в качестве «антифриза» в автомобильных радиаторах. Морская вода замерзает при более низкой температуре, чем пресная, поэтому Северный Ледовитый и Антарктический океаны остаются незамерзающими даже при температуре ниже 0 °С (как и биологические жидкости рыб и других хладнокровных морских животных, обитающих в этих океанах).
Рисунок 4. Каменная соль (NaCl), хлорид кальция (CaCl 2 ) или их смесь используются для растапливания льда. (кредит: модификация работы Эдди Уэлкера)Снижение температуры замерзания разбавленного раствора по сравнению с чистым растворителем, Δ T f , называется понижением точки замерзания и прямо пропорционально молярная концентрация растворенного вещества
[латекс] {\ Delta} T _ {\ text {f}} = K _ {\ text {f}} м [/ латекс]
, где m — это молярная концентрация растворенного вещества в растворителе, а K f называется постоянной депрессии точки замерзания (или криоскопической постоянной ).Так же, как и константы повышения точки кипения, это характерные свойства, значения которых зависят от химической идентичности растворителя. Значения K f для нескольких растворителей приведены в таблице 2.
Пример 6
Расчет температуры замерзания раствора
Какова температура замерзания 0,33· м раствора нелетучего неэлектролитного растворенного вещества в бензоле, описанного в примере 2?
Решение
Используйте уравнение, связывающее понижение температуры замерзания с моляльностью растворенного вещества, чтобы решить эту задачу в два этапа.{\ circ} \ text {C} [/латекс]
Проверьте свои знания
Какова температура замерзания 1,85 м раствора нелетучего неэлектролитного растворенного вещества в нитробензоле?
Коллигативные свойства и защита от обледенения
Хлорид натрия и его аналоги хлорида кальция и магния группы 2 часто используются для удаления льда с дорог и тротуаров из-за того, что раствор любой из этих солей будет иметь температуру замерзания ниже 0 ° C, точка замерзания чистой воды.Соли металлов группы 2 часто смешивают с более дешевым и более доступным хлоридом натрия («каменной солью») для использования на дорогах, поскольку они имеют тенденцию быть несколько менее коррозионными, чем NaCl, и они обеспечивают большее понижение точки замерзания. , поскольку они диссоциируют с образованием трех частиц на формульную единицу, а не двух частиц, как хлорид натрия.
Поскольку эти ионные соединения имеют тенденцию ускорять коррозию металла, их не следует использовать в качестве антифриза для радиатора вашего автомобиля или для удаления льда с самолета перед взлетом.Для этих применений часто используются ковалентные соединения, такие как этилен или пропиленгликоль. Гликоли, используемые в радиаторной жидкости, не только снижают температуру замерзания жидкости, но и повышают ее температуру кипения, что делает жидкость полезной как зимой, так и летом. Нагретые гликоли часто распыляют на поверхность самолетов перед взлетом в ненастную погоду зимой, чтобы удалить уже образовавшийся лед и предотвратить образование большего количества льда, который был бы особенно опасен, если бы образовался на рулевых поверхностях самолета (рис. 5).
Рисунок 5. Понижение точки замерзания используется для удаления льда с (а) проезжей части и (б) рулевых поверхностей самолетов.Эффекты коллигативного воздействия на давление паров, температуру кипения и температуру замерзания, описанные в предыдущем разделе, удобно резюмировать путем сравнения фазовых диаграмм чистой жидкости и раствора, полученного из этой жидкости. Фазовые диаграммы для воды и водного раствора показаны на рисунке 6.
Рис. 6. На этих фазовых диаграммах показаны вода (сплошные кривые) и водный раствор неэлектролита (штриховые кривые).Кривая жидкость-пар для раствора расположена под соответствующей кривой для растворителя, изображая снижение давления пара , Δ P , что является результатом растворения нелетучего растворенного вещества. Следовательно, при любом заданном давлении температура кипения раствора наблюдается при более высокой температуре, чем у чистого растворителя, что отражает повышение температуры кипения Δ T b , связанное с присутствием нелетучего растворенного вещества.Кривая твердой и жидкой фаз для раствора смещена влево от кривой для чистого растворителя, представляя понижение температуры замерзания, Δ T b , которое сопровождает образование раствора. Наконец, обратите внимание, что кривые твердое тело-газ для растворителя и его раствора идентичны. Это касается многих растворов, содержащих жидкие растворители и нелетучие растворенные вещества. Так же, как и при испарении, когда раствор такого типа замораживается, на самом деле только молекул растворителя претерпевают переход из жидкости в твердое, образуя чистый твердый растворитель, исключающий растворенные вещества.Таким образом, твердая и газообразная фазы состоят только из растворителя, и поэтому переходы между этими фазами не подвержены коллигативным эффектам.
Ряд природных и синтетических материалов обладают избирательной проницаемостью , что означает, что только молекулы или ионы определенного размера, формы, полярности, заряда и т. д. способны проходить через материал (проникать в него). Биологические клеточные мембраны представляют собой элегантные примеры селективного проникновения в природе, в то время как диализные трубки, используемые для удаления метаболических отходов из крови, представляют собой более упрощенный технологический пример.Независимо от того, как они могут быть изготовлены, эти материалы обычно называют полупроницаемыми мембранами .
Рассмотрим аппарат, показанный на рис. 7, в котором образцы чистого растворителя и раствора разделены мембраной, через которую могут проникать только молекулы растворителя. Молекулы растворителя будут диффундировать через мембрану в обоих направлениях. Поскольку концентрация растворителя больше в чистом растворителе, чем в растворе, эти молекулы будут диффундировать со стороны растворителя мембраны в сторону раствора с большей скоростью, чем в обратном направлении.Результатом является чистый перенос молекул растворителя из чистого растворителя в раствор. Диффузионный перенос молекул растворителя через полупроницаемую мембрану представляет собой процесс, известный как осмос .
Рисунок 7. Осмос приводит к переносу молекул растворителя из образца с низкой (или нулевой) концентрацией растворенного вещества в образец с более высокой концентрацией растворенного вещества.Когда осмос проводится в аппарате, подобном показанному на рис. 7, объем раствора увеличивается по мере его разбавления за счет накопления растворителя.Это вызывает повышение уровня раствора, увеличивая его гидростатическое давление (из-за веса столба раствора в трубке) и приводя к более быстрому переносу молекул растворителя обратно на сторону чистого растворителя. Когда давление достигает значения, при котором скорость обратного переноса растворителя равна скорости осмоса, объемный перенос растворителя прекращается. Это давление называется осмотическим давлением ( П ) раствора. Осмотическое давление разбавленного раствора связано с молярностью его растворенного вещества, M , и абсолютной температурой, T , согласно уравнению
[латекс]\it{{\Pi}} = MRT[/латекс]
, где R — универсальная газовая постоянная.
Пример 7
Расчет осмотического давления
Каково осмотическое давление (атм) 0,30 М раствора глюкозы в воде, используемого для внутривенного вливания при температуре тела 37 °С?
Раствор
Осмотическое давление Π можно найти по формуле Π = MRT , где T находится по шкале Кельвина (310 K), а значение
7 R 9 выражено в соответствующие единицы (0.08206 л атм/моль К).
[латекс]\begin{array}{r @{{}={}} l} \it{{\Pi}} & MRT \\[0,5em] & 0,03\;\text{моль/л}\; \times\;0,08206\;\text{L\;атм/моль\;K}\;\times\;310\;\text{K} \\[0,5em] & 7,6\;\text{атм} \ конец{массив}[/латекс]
Проверьте свои знания
Каково осмотическое давление (атм) раствора объемом 0,750 л, содержащего 5,0 г метанола, CH 3 OH, в воде при 37 °C?
Если раствор помещается в аппарат, подобный показанному на рис. 8, приложение давления, превышающего осмотическое давление раствора, меняет осмос и выталкивает молекулы растворителя из раствора в чистый растворитель.Этот метод обратного осмоса используется для крупномасштабного опреснения морской воды и в меньших масштабах для производства водопроводной воды высокой чистоты для питья.
Рисунок 8. Применение давления, превышающего осмотическое давление раствора, приведет к обратному осмосу. Молекулы растворителя из раствора выталкиваются в чистый растворитель.Обратный осмос для очистки воды
В процессе осмоса диффузия служит для перемещения воды через полупроницаемую мембрану из менее концентрированного раствора в более концентрированный.Осмотическое давление — это величина давления, которое необходимо приложить к более концентрированному раствору, чтобы остановить осмос. Если приложить большее давление, вода перейдет из более концентрированного раствора в менее концентрированный (более чистый). Это называется обратным осмосом. Обратный осмос (RO) используется для очистки воды во многих областях: от опреснительных установок в прибрежных городах до водоочистных установок в продуктовых магазинах (рис. 9) и небольших бытовых установок обратного осмоса.С ручным насосом небольшие установки обратного осмоса можно использовать в странах третьего мира, в зонах стихийных бедствий и в спасательных шлюпках. У наших вооруженных сил есть множество генераторных установок обратного осмоса, которые можно транспортировать на транспортных средствах в отдаленные места.
Рисунок 9. Системы обратного осмоса для очистки питьевой воды показаны здесь в малом (а) и крупном (б) масштабах. (кредит а: модификация работы Джерри Киркхарта; кредит б: модификация работы Уилларда Дж. Латропа)Примеры осмоса очевидны во многих биологических системах, поскольку клетки окружены полупроницаемыми мембранами.Морковь и сельдерей, которые стали мягкими из-за потери воды, можно снова сделать хрустящими, поместив их в воду. Вода попадает в клетки моркови или сельдерея за счет осмоса. Огурец, помещенный в концентрированный раствор соли, теряет воду в результате осмоса и поглощает некоторое количество соли, превращаясь в рассол. Осмос также может влиять на клетки животных. Концентрации растворенных веществ особенно важны при введении растворов в организм. Растворенные вещества в клеточных жидкостях организма и сыворотке крови придают этим растворам осмотическое давление приблизительно 7.7 атм. Вводимые в организм растворы должны иметь то же осмотическое давление, что и сыворотка крови; то есть они должны быть изотоническими с сывороткой крови. Если менее концентрированный раствор, гипотонический раствор , вводят в количестве, достаточном для разбавления сыворотки крови, вода из разведенной сыворотки переходит в клетки крови путем осмоса, вызывая их расширение и разрыв. Этот процесс называется гемолизом . Когда вводится более концентрированный раствор, гипертонический раствор , клетки теряют воду в более концентрированный раствор, сморщиваются и, возможно, умирают в процессе, называемом crenation .Эти эффекты показаны на рисунке 10.
Рисунок 10. Мембраны эритроцитов проницаемы для воды и (а) набухают и, возможно, разрываются в гипотоническом растворе; б) сохранять нормальный объем и форму в изотоническом растворе; и (c) сморщиваются и, возможно, умирают в гипертоническом растворе. (кредит a/b/c: модификации работы «LadyofHats»/Wikimedia commons)Осмотическое давление и изменения температуры замерзания, кипения и давления пара прямо пропорциональны концентрации присутствующего растворенного вещества.Следовательно, мы можем использовать измерение одного из этих свойств для определения молярной массы растворенного вещества на основе измерений.
Пример 8
Определение молярной массы по понижению точки замерзания
Установлено, что раствор 4,00 г неэлектролита, растворенный в 55,0 г бензола, замерзает при 2,32 °C. Какова молярная масса этого соединения?
Решение
Мы можем решить эту проблему, выполнив следующие шаги.
- Определите изменение температуры замерзания по наблюдаемой температуре замерзания и температуре замерзания чистого бензола (таблица 2).{-1}} = 0,63 м[/латекс]
- Определите число молей соединения в растворе по молярной концентрации и массе растворителя, использованного для приготовления раствора.
[латекс]\text{Моли\;растворенного вещества} = \frac{0,62\;\text{моль\;растворенного вещества}}{1,00\; \rule[0.25ex]{3.5em}{0.1ex}\hspace{-3.5em}\text{kg\;растворитель}}\;\times\;0.0550\; \rule[0.5ex]{4.4em}{0.1ex}\hspace{-4.4em}\text{кг\;растворитель} = 0,035\;\text{моль}[/latex]
- Определите молярную массу по массе растворенного вещества и количеству молей в этой массе.2\;\text{г/моль}[/латекс]
Проверьте свои знания
Раствор 35,7 г неэлектролита в 220,0 г хлороформа имеет температуру кипения 64,5 °C. Какова молярная масса этого соединения?
Пример 9
Определение молярной массы по осмотическому давлению
Образец водного раствора объемом 0,500 л, содержащий 10,0 г гемоглобина, имеет осмотическое давление 5,9 торр при 22 °C. Какова молярная масса гемоглобина?
Решение
Вот один набор шагов, которые можно использовать для решения проблемы:
- Преобразуйте осмотическое давление в атмосферы, затем определите молярную концентрацию по осмотическому давлению.4\;\text{г/моль}[/латекс]
Проверьте свои знания
Какова молярная масса белка, если раствор 0,02 г белка в 25,0 мл раствора имеет осмотическое давление 0,56 торр при 25 °C?
Как отмечалось ранее в этом модуле, коллигативные свойства раствора зависят только от количества, а не от вида растворенных веществ. Например, 1 моль любого неэлектролита, растворенный в 1 кг растворителя, вызывает такое же понижение температуры замерзания, как и 1 моль любого другого неэлектролита.Однако 1 моль хлорида натрия (электролит) при растворении в растворе образует 2 молей ионов. Каждый отдельный ион оказывает такое же влияние на температуру замерзания, как и отдельная молекула.
Пример 10
Температура замерзания раствора электролита
Концентрация ионов в морской воде примерно такая же, как и в растворе, содержащем 4,2 г NaCl, растворенного в 125 г воды. Примите, что каждый из ионов в растворе NaCl оказывает такое же влияние на температуру замерзания воды, как и молекула неэлектролита, и определите температуру замерзания раствора (которая примерно равна температуре замерзания морской воды).
Решение
Мы можем решить эту проблему, выполнив следующие действия.
- Преобразуйте граммы в моли NaCl, используя молярную массу NaCl в качестве коэффициента преобразования единиц.
Результат: 0,072 моль NaCl - Определите количество молей ионов, присутствующих в растворе, используя количество молей ионов в 1 моль NaCl в качестве коэффициента пересчета (2 моль ионов/1 моль NaCl).
Результат: 0,14 моль ионов - Определите моляльность ионов в растворе, исходя из числа молей ионов и массы растворителя в килограммах.
Результат: 1,1 м - Используйте прямую зависимость между изменением точки замерзания и молярной концентрацией, чтобы определить, насколько изменится точка замерзания.
Результат: 2,0 °C - Определить новую точку замерзания по температуре замерзания чистого растворителя и изменению.
Результат: −2,0 °C
Проверяйте каждый результат как самооценку.
Проверьте свои знания
Предположим, что каждый из ионов хлорида кальция CaCl 2 оказывает такое же влияние на точку замерзания воды, как и молекула неэлектролита.{\ circ} \ text {C} [/ латекс].
Однако при фактическом приготовлении этого раствора и измерении понижения его точки замерзания получается значение 3,4 °C. Подобные расхождения наблюдаются и для других ионных соединений, и различия между измеренными и ожидаемыми значениями коллигативных свойств обычно становятся более значительными по мере увеличения концентрации растворенного вещества. Эти наблюдения свидетельствуют о том, что ионы хлорида натрия (и других сильных электролитов) диссоциируют в растворе не полностью.
Чтобы учесть это и избежать ошибок, сопровождающих предположение о полной диссоциации, используется экспериментально измеренный параметр, названный в честь лауреата Нобелевской премии немецкого химика Якобуса Хенрикуса ван’т Гоффа. Коэффициент Вант-Гоффа ( i ) определяется как отношение частиц растворенного вещества в растворе к числу растворенных формульных единиц:
[латекс] я = \frac{\text{моли\;\;частиц\;в\;растворе}}{\text{моли\;формулы\;единиц\;растворено}}[/латекс]
Значения измеренных факторов Вант-Гоффа для нескольких растворенных веществ вместе с прогнозируемыми значениями, предполагающими полную диссоциацию, показаны в таблице 3.
| Электролит | Частицы в растворе | и (прогноз) | i (измеренный) |
|---|---|---|---|
| HCl | Н + , Кл — | 2 | 1,9 |
| NaCl | Na + , Cl — | 2 | 1,9 |
| MgSO 4 | Мг 2+ , SO 4 2- | 2 | 1.3 |
| MgCl 2 | Mg 2+ , 2Cl − | 3 | 2,7 |
| FeCl 3 | Fe 3+ , 3Cl − | 4 | 3,4 |
| глюкоза | С 12 Н 22 О 11 | 1 | 1,0 |
| Таблица 3. Ожидаемые и наблюдаемые факторы Вант-Гоффа для нескольких 0.050 m Водные растворы электролитов | |||
В 1923 году химики Питер Дебай и Эрих Хюккель предложили теорию, объясняющую очевидную неполную ионизацию сильных электролитов. Они предположили, что хотя межионное притяжение в водном растворе очень сильно снижается за счет сольватации ионов и изолирующего действия полярного растворителя, оно не полностью сводится на нет. Остаточное притяжение не позволяет ионам вести себя как полностью независимые частицы (рис. 11).В некоторых случаях положительный и отрицательный ион могут соприкасаться, образуя сольватированную единицу, называемую ионной парой. Таким образом, активность или эффективная концентрация любого конкретного вида иона меньше, чем указанная фактической концентрацией. Чем больше разбавляется раствор, тем больше и больше разделяются ионы, а остаточное межионное притяжение становится все меньше и меньше. Таким образом, в чрезвычайно разбавленных растворах эффективные концентрации ионов (их активности) практически равны реальным концентрациям.Обратите внимание, что коэффициенты Вант-Гоффа для электролитов в таблице 3 даны для 0,05· м растворов, при которых значение i для NaCl составляет 1,9, в отличие от идеального значения 2,
. Рис. 11. Чем больше разбавлен раствор, тем шире и шире разделяются ионы, а остаточное межионное притяжение становится меньше.Свойства раствора, зависящие только от концентрации растворенных частиц, называются коллигативными свойствами. К ним относятся изменения давления паров, температуры кипения и температуры замерзания растворителя в растворе.Величины этих свойств зависят только от общей концентрации частиц растворенного вещества в растворе, а не от типа частиц. Суммарная концентрация частиц растворенного вещества в растворе также определяет его осмотическое давление. Это давление, которое необходимо приложить к раствору, чтобы предотвратить диффузию молекул чистого растворителя через полупроницаемую мембрану в раствор. Ионные соединения могут не полностью диссоциировать в растворе из-за эффектов активности, и в этом случае наблюдаемые коллигативные эффекты могут быть меньше, чем предполагалось.{\ circ} [/латекс]
Химия Упражнения в конце главы
- Которые являются частью макроскопической области растворов и которые являются частью микроскопической области: повышение температуры кипения, закон Генри, водородная связь, ион-дипольное притяжение, молярность, неэлектролит, нестехиометрическое соединение, осмос, сольватированный ион ?
- Каково микроскопическое объяснение макроскопического поведения, показанного на рисунке 7 в главе 11.3 Растворимость?
- Нарисуйте качественный график зависимости давления водяного пара от времени над образцом чистой воды и раствора сахара, когда жидкости испаряются до половины своего первоначального объема.
- Раствор нитрата калия, электролит и раствор глицерина (C 3 H 5 (OH) 3 ), неэлектролит, оба кипят при 100,3 °C. Какие другие физические свойства двух растворов идентичны?
- Каковы молярные доли H 3 PO 4 и воды в растворе 14.5 г H 3 PO 4 в 125 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Каковы молярные доли HNO 3 и воды в концентрированном растворе азотной кислоты (68,0% HNO 3 по массе)?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассчитайте мольную долю каждого растворенного вещества и растворителя:
(a) 583 г H 2 SO 4 в 1.50 кг воды — раствор кислоты, используемый в автомобильном аккумуляторе
(б) 0,86 г NaCl в 1,00 × 10 2 г воды — раствор натрия хлорида для внутривенных инъекций
(c) 46,85 г кодеина, C 18 H 21 NO 3 , в 125,5 г этанола, C 2 H 5 OH
(d) 25 г I 2 в 125 г этанола, C 2 H 5 OH
- Рассчитайте мольную долю каждого растворенного вещества и растворителя:
(а) 0.710 кг карбоната натрия (стиральная сода), Na 2 CO 3 в 10,0 кг воды — насыщенный раствор при 0 °C
(b) 125 г NH 4 NO 3 в 275 г воды — смесь, используемая для приготовления мгновенного льда
(c) 25 г Cl 2 в 125 г дихлорметана, CH 2 Cl 2
(d) 0,372 г гистамина, C 5 H 9 N, в 125 г хлороформа, CHCl 3
- Рассчитать мольные доли метанола, CH 3 OH; этанол, С 2 Н 5 ОН; и вода в растворе, состоящем из 40% метанола, 40% этанола и 20% воды по массе.(Предположим, что данные соответствуют двум значащим цифрам.)
- В чем разница между раствором 1 M и раствором 1 m ?
- Какова моляльность фосфорной кислоты H 3 PO 4 в растворе 14,5 г H 3 PO 4 в 125 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Какова моляльность азотной кислоты в концентрированном растворе азотной кислоты (68.0% HNO 3 по массе)?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Рассчитайте моляльность каждого из следующих растворов:
(a) 583 г H 2 SO 4 в 1,50 кг воды — раствор кислоты, используемый в автомобильном аккумуляторе
(б) 0,86 г NaCl в 1,00 × 10 2 г воды — раствор натрия хлорида для внутривенных инъекций
(c) 46,85 г кодеина, C 18 H 21 NO 3 , в 125.5 г этанола, C 2 H 5 OH
(d) 25 г I 2 в 125 г этанола, C 2 H 5 OH
- Рассчитайте моляльность каждого из следующих растворов:
(a) 0,710 кг карбоната натрия (стиральная сода), Na 2 CO 3 в 10,0 кг воды — насыщенный раствор при 0°C
(b) 125 г NH 4 NO 3 в 275 г воды — смесь, используемая для приготовления мгновенного льда
(c) 25 г Cl 2 в 125 г дихлорметана, CH 2 Cl 2
(г) 0.372 г гистамина, C 5 H 9 N, в 125 г хлороформа, CHCl 3
- Концентрация глюкозы, C 6 H 12 O 6 , в нормальной спинномозговой жидкости составляет [латекс]\frac{75\;\text{мг}}{100\;\text{г}}[ /латекс]. Какова моляльность раствора?
- 13,0% раствор K 2 CO 3 по массе имеет плотность 1,09 г/см 3 . Вычислите моляльность раствора.
- Почему 1 моль хлорида натрия понижает температуру замерзания 1 кг воды почти в два раза больше, чем 1 моль глицерина?
- Какова температура кипения раствора 115.0 г сахарозы, C 12 H 22 O 11 , в 350,0 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос
(б) Ответьте на вопрос
- Какова температура кипения раствора 9,04 г I 2 в 75,5 г бензола, если предположить, что I 2 нелетуч?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Какова температура замерзания раствора 115.0 г сахарозы, C 12 H 22 O 11 , в 350,0 г воды, которая замерзает при 0,0 °C в чистом виде?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Какова температура замерзания раствора 9,04 г I 2 в 75,5 г бензола?
(a) Опишите шаги, необходимые для ответа на следующий вопрос.
(б) Ответьте на вопрос.
- Чему равно осмотическое давление водного раствора 1.64 г Ca(NO 3 ) 2 в воде при 25 °C? Объем раствора 275 мл.
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Чему равно осмотическое давление раствора бычьего инсулина (молярная масса 5700 г·моль −1 ) при 18 °С, если 100,0 мл раствора содержит 0,103 г инсулина?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Ответьте на вопрос.
- Какова молярная масса раствора 5.00 г соединения в 25,00 г четыреххлористого углерода (т. кип. 76,8 °С; К b = 5,02 °С/ m ), кипящего при 81,5 °С при 1 атм?
(a) Опишите шаги, необходимые для ответа на вопрос.
(б) Решите задачу.
- Образец органического соединения (неэлектролита) массой 1,35 г понизил температуру замерзания 10,0 г бензола на 3,66 °С. Рассчитайте молярную массу соединения.
- 1,0 м раствор HCl в бензоле имеет точку замерзания 0.4°С. Является ли HCl электролитом в бензоле? Объяснять.
- Раствор содержит 5,00 г мочевины, CO(NH 2 ) 2 , нелетучего соединения, растворенного в 0,100 кг воды. Если давление паров чистой воды при 25°С равно 23,7 торр, каково давление пара над раствором?
- Образец неэлектролита массой 12,0 г растворяют в 80,0 г воды. Раствор замерзает при -1,94 °C. Рассчитайте молярную массу вещества.
- Расположите следующие растворы в порядке убывания их температуры замерзания: 0.1 M NA 3 PO 4 , 0,1 M C 2 H 5 OH 5 OH 0,01 M CO 2 , 0.15 M NaCl и 0,2 м CaCl 2 .
- Рассчитайте повышение температуры кипения 0,100 кг воды, содержащей 0,010 моль NaCl, 0,020 моль Na 2 SO 4 и 0,030 моль MgCl 2 , при условии полной диссоциации этих электролитов.
- Как ты мог приготовить 3.08 m водный раствор глицерина, C 3 H 8 O 3 ? Какова температура замерзания этого раствора?
- Образец серы массой 0,210 г растворили в 17,8 г сероуглерода, CS 2 ( K b = 2,43 °C/ m ). Какова формула молекулы серы в сероуглероде, если температура кипения повысилась на 0,107 °С?
- В важном эксперименте, проведенном много лет назад, 5,6977 г иодида кадмия в 44.69 г воды повысили температуру кипения на 0,181 °С. Что это говорит о природе раствора CdI 2 ?
- Лизоцим — фермент, расщепляющий клеточные стенки. Образец раствора лизоцима объемом 0,100 л, содержащий 0,0750 г фермента, имеет осмотическое давление 1,32·10 -3 атм при 25 °С. Какова молярная масса лизоцима?
- Осмотическое давление раствора, содержащего 7,0 г инсулина на литр, составляет 23 Торр при 25 °C. Какова молярная масса инсулина?
- Осмотическое давление крови человека равно 7.6 атм при 37°С. Какая масса глюкозы C 6 H 12 O 6 требуется для приготовления 1,00 л водного раствора для внутривенного введения, если осмотическое давление раствора должно быть таким же, как у крови при температуре тела 37 °C?
- Какова температура замерзания раствора дибромбензола C 6 H 4 Br 2 в 0,250 кг бензола, если раствор кипит при 83,5 °С?
- Какова температура кипения раствора NaCl в воде, если раствор замерзает при -0.93°С?
- Сахарная фруктоза содержит 40,0% С, 6,7% Н и 53,3% О по массе. Раствор 11,7 г фруктозы в 325 г этанола имеет температуру кипения 78,59 °С. Температура кипения этанола составляет 78,35 °С, а К b для этанола составляет 1,20 °С/ м . Какова молекулярная формула фруктозы?
- Давление паров метанола, CH 3 OH, составляет 94 торр при 20 °C. Давление паров этанола C 2 H 5 OH составляет 44 торр при той же температуре.
(a) Рассчитайте мольные доли метанола и этанола в растворе 50,0 г метанола и 50,0 г этанола.
(b) Этанол и метанол образуют раствор, который ведет себя как идеальный раствор. Рассчитайте давление паров метанола и этанола над раствором при 20 °С.
(c) Рассчитайте мольные доли метанола и этанола в парах над раствором.
- Тройная точка воды без воздуха определяется как 273,15 К. Почему важно, чтобы вода не содержала воздуха?
- Мясо может быть классифицировано как свежее (не замороженное), даже если оно хранится при температуре -1 °C.Почему мясо не замерзнет при такой температуре?
- Органическое соединение имеет состав 93,46% С и 6,54% Н по массе. Раствор 0,090 г этого соединения в 1,10 г камфоры плавится при 158,4 °С. Температура плавления чистой камфоры 178,4 °С. K f для камфоры 37,7 °C/ m . Какова молекулярная формула растворенного вещества? Покажите свои расчеты.
- Образец HgCl 2 массой 9,41 г растворяют в 32,75 г этанола, C 2 H 5 OH ( K b = 1.20 °C/ м ). Повышение температуры кипения раствора составляет 1,27 °С. Является ли HgCl 2 электролитом в этаноле? Покажите свои расчеты.
- Известно, что соль представляет собой фторид щелочного металла. Быстрое приблизительное определение точки замерзания показывает, что 4 г соли, растворенные в 100 г воды, образуют раствор, который замерзает примерно при -1,4 °C. Какова формула соли? Покажите свои расчеты.
Глоссарий
- повышение температуры кипения
- повышение температуры кипения жидкости при добавлении растворенного вещества
- константа повышения температуры кипения
- константа пропорциональности в уравнении, связывающем повышение точки кипения с моляльностью растворенного вещества; также известная как эбуллиоскопическая постоянная
- совместное имущество
- свойство раствора, которое зависит только от концентрации растворенного вещества
- создание
- процесс, при котором биологические клетки сморщиваются из-за потери воды в результате осмоса
- понижение точки замерзания
- понижение точки замерзания жидкости путем добавления растворенного вещества
- константа понижения температуры замерзания
- (также криоскопическая постоянная) константа пропорциональности в уравнении, связывающем понижение температуры замерзания с моляльностью растворенного вещества
- гемолиз
- разрыв эритроцитов из-за скопления избыточной воды путем осмоса
- гипертонический
- повышенного осмотического давления
- гипотонический
- меньшего осмотического давления
- ионная пара
- сольватированная пара анион/катион, удерживаемая вместе за счет умеренного электростатического притяжения
- изотонический
- равного осмотического давления
- моляльность ( m )
- единица концентрации, определяемая как отношение числа молей растворенного вещества к массе растворителя в килограммах
- осмос
- диффузия молекул растворителя через полупроницаемую мембрану
- осмотическое давление ( Π )
- противодействующее давление, необходимое для предотвращения массового переноса молекул растворителя через полупроницаемую мембрану
- Закон Рауля
- парциальное давление, оказываемое компонентом раствора, равно произведению мольной доли компонента в растворе на его равновесное давление паров в чистом состоянии
- полупроницаемая мембрана
- мембрана, избирательно пропускающая определенные ионы или молекулы
- Коэффициент Вант-Гоффа ( i )
- отношение количества молей частиц в растворе к количеству молей формульных единиц, растворенных в растворе
Решения
Ответы на упражнения по химии в конце главы
2.Прочность связей между подобными молекулами сильнее, чем между разнородными молекулами. Следовательно, будут существовать некоторые области, в которых молекулы воды будут исключать молекулы масла, и будут существовать другие области, в которых молекулы масла будут исключать молекулы воды, образуя неоднородную область.
4. Оба образуют гомогенные растворы; их повышение температуры кипения такое же, как и их понижение давления паров. Осмотическое давление и понижение температуры замерзания также одинаковы для обоих растворов.
6. а) Найдите количество молей HNO 3 и H 2 O в 100 г раствора. Найдите молярные доли компонентов.
(b) Молярная доля HNO 3 равна 0,378. Мольная доля H 2 O составляет 0,622.
8. (а) [латекс]X_{\text{Na}_2\text{CO}_3} = 0,0119[/латекс]; [латекс] X _ {\ текст {H} _2 \ текст {O}} = 0,988 [/латекс]; (b) [латекс]X_{\text{NH}_4\text{NO}_3} = 0,9927[/латекс]; [латекс] X _ {\ текст {H} _2 \ текст {O}} = 0,907 [/латекс]; (c) [латекс]X_{\text{Cl}_2} = 0.192[/латекс]; [латекс] X _ {\ текст {CH} _2 \ текст {Cl} _2} = 0,808 [/латекс]; (г) [латекс] X _ {\ текст {C} _5 \ текст {H} _9 \ текст {N}} = 0,00426 [/латекс]; [латекс] X _ {\ текст {CHCl} _3} = 0,997 [/ латекс]
10. В растворе 1 M моль содержится ровно в 1 л раствора. В растворе 1 м моль содержится ровно в 1 кг растворителя.
12. (а) Определите молярную массу HNO 3 . Определить количество молей кислоты в растворе. По количеству молей и массе растворителя определите моляльность.(б) 33,7 м
14. (а) 6.70 × 10 −1 м ; (б) 5,67 м ; в) 2,8 м ; (г) 0,0358 м
16. 1.08 м
18. а) Определите молярную массу сахарозы; определить количество молей сахарозы в растворе; перевести массу растворителя в единицы килограммы; по количеству молей и массе растворителя определяют моляльность; определить разницу между температурой кипения воды и температурой кипения раствора; определяют новую точку кипения.(б) 100,5°С
20. а) Определите молярную массу сахарозы; определить количество молей сахарозы в растворе; перевести массу растворителя в единицы килограммы; по количеству молей и массе растворителя определяют моляльность; определить разницу между температурой замерзания воды и температурой замерзания раствора; определить новую температуру замерзания. (б) –1,8 °С
22. а) Определите молярную массу Ca(NO 3 ) 2 ; определить количество молей Ca(NO 3 ) 2 в растворе; определить количество молей ионов в растворе; определяют молярность ионов, затем осмотическое давление.(б) 2,67 атм
24. (a) Определите молярную концентрацию по изменению температуры кипения и K b ; определить количество молей растворенного вещества в растворе по моляльной концентрации и массе растворителя; определите молярную массу по количеству молей и массе растворенного вещества. (б) 2.1 × 10 2 г моль −1
26. Нет. Чистый бензол замерзает при 5,5 °C, поэтому наблюдаемая точка замерзания этого раствора понижается на Δ T f = 5.5 — 0,4 = 5,1 °С. Вычисленное значение при отсутствии ионизации HCl составляет Δ T f = (1,0 м) (5,14 °C/ м ) = 5,1 °C. Совпадение этих значений подтверждает предположение, что HCl не ионизируется.
28. 144 г моль −1
30. 0,870 °С
32. С 8
34. 1,39 × 10 4 г моль −1
36. 54 г
38. 100,26 °С
40. (а) [латекс]X_{\text{CH}_3\text{OH}} = 0.{\ circ} \ text {C} [/латекс]
Наблюдаемое изменение равно теоретическому изменению; поэтому никакой диссоциации не происходит.
АНТИФРИЗНЫЕ РАСТВОРЫ И СОЕДИНЕНИЯ
Эффективность, преимущества и недостатки различных веществ и соединения, которые используются или предлагаются на рынке для использования в радиаторах обсуждаются автомобильные транспортные средства в качестве незамерзающих материалов. К ним относятся спирты, глицерин, соли, масла, сахара и гликоли.
Свойства, влияющие на пригодность материала или соединения или растворов их водой для защиты от замерзания при атмосферных температуры, с которыми, вероятно, придется столкнуться, являются их теплоемкостью, температура замерзания, температура кипения, удельный вес, вязкость, летучесть, растворимость, склонность к разложению при температуре кипения, воспламеняемость, коррозионное действие на металлы, склонность к агрессивному воздействию на резину, общедоступность, и цена.
Температуры замерзания растворов различных материалов сильно различаются при одном и том же концентрации или пропорции к воде, а также с изменением их концентрация. Определения температуры замерзания, сделанные в Бюро Стандарты приведены в таблицах. Точки замерзания также варьируются в зависимости от конкретных силы тяжести, и даны определения этих точек. Существуют большие различия по начальной вязкости воды, масел и водных растворов глицерина, гликоля и меда, а также в скорости увеличения вязкости при снижении температура.Кривые, основанные на определении вязкости таких жидкостей в течение показан широкий диапазон температур.
Растворы солей натрия, кальция и магния имеют значительно более низкую температуры замерзания, чем растворы сахара, и при гораздо более низких концентрациях и обеспечивают защиту при значительно более низких минимальных температурах. Глицерин и этиленгликоль обеспечивает защиту почти при такой же низкой минимальной температуре, как кальций хлорид, который является наиболее эффективным из солей, но только примерно в два раза больше, чем концентрация.На втором месте по эффективности стоят древесный спирт и денатурат. концентрациях 50 и 70 процентов по объему и устойчивы к замораживанию при температура -40 град. фар.
Спирт обладает несколькими достоинствами как антифриз, но кипит при 172,4 град. fahr., что приводит к его быстрой потере при испарении и ограничивает использование устройства для поддержания высокой температуры двигателя. Керосин, наоборот, высокая температура кипения, что может привести к серьезному перегреву двигателя в мягкая погода.Другими возражениями против его использования являются его запах и воспламеняемость. его действие на резину. Смазочные масла и растворы сахара обладают высокой вязкость при низких температурах, что вызывает медленную циркуляцию охлаждающей средой, если проходы в системе охлаждения не достаточны.
Товарный дистиллированный глицерин, не содержащий электролитов и практически нейтральный не оказывает коррозионного действия на металлы и не повреждает резину; это испарение незначительно и может быть восстановлено в конце холодного сезона и снова использовали.Если спирт, который теряется при испарении, необходимо заменить четыре или пять раз за сезон, глицерин в четыре раза дешевле даже на один сезон. Растворы глицерина с более высоким удельным весом, чем 1,144, являются не рекомендуется использовать в автомобилях с термосифонной циркуляцией из-за их высокая вязкость при низких температурах.
Этиленгликоль получают косвенным путем из нефти или этилового спирта и продают в зимой 1925 и 1926 годов примерно по той же цене, что и глицерин.Это дает больше защита от замерзания по сравнению с растворами глицерина или денатурата того же объемного процента, практически нелетучий, не более коррозионный чем вода, и лишь немного более вязкая при низких температурах, чем денатурированные спиртовые растворы равных концентраций.
При испытании растворов для определения их температуры замерзания необходимо соблюдать осторожность. предпринимается во избежание явления переохлаждения, то есть склонности сопротивляться замерзание в некоторых условиях при температурах значительно ниже максимальной температура, при которой могут начать образовываться кристаллы.Аппарат, используемый в бюро Стандарты для проведения таких определений проиллюстрированы и описаны. То настоящей процедуре и предложенному новому методу проверки коррозионного действия также описаны незамерзающие жидкости.
.
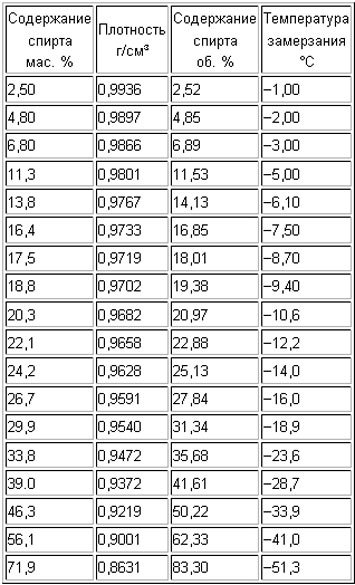 Время объяснить. Представьте себе лед, плавающий в чистой воде при температуре 0°С. Если мы добавим немного тепла, часть льда растает. Уберите немного тепла, и часть воды замерзнет. Мы называем это равновесной температурой замерзания: 0°С для воды. Однако, когда кто-то охлаждает достаточно чистую воду, она обычно охлаждается на несколько градусов ниже 0°С, мы говорим, что она переохлаждается на несколько градусов, прежде чем появится первый кристалл льда. Этот ледяной кристалл затем быстро расширяется, выделяя скрытое тепло, которое снова нагревает близлежащую воду примерно до 0°C. Подробнее о переохлаждении и перегреве ниже.
Время объяснить. Представьте себе лед, плавающий в чистой воде при температуре 0°С. Если мы добавим немного тепла, часть льда растает. Уберите немного тепла, и часть воды замерзнет. Мы называем это равновесной температурой замерзания: 0°С для воды. Однако, когда кто-то охлаждает достаточно чистую воду, она обычно охлаждается на несколько градусов ниже 0°С, мы говорим, что она переохлаждается на несколько градусов, прежде чем появится первый кристалл льда. Этот ледяной кристалл затем быстро расширяется, выделяя скрытое тепло, которое снова нагревает близлежащую воду примерно до 0°C. Подробнее о переохлаждении и перегреве ниже. См. криобиологию.
См. криобиологию. Тем не мение,
ведь объем, занимаемый килограммом жидкости, мало чем отличается
от того, что занимает килограмм твердого вещества, этот эффект очень мал
если давление не очень большое.Для большинства веществ замораживание
точка поднимается, хотя и очень незначительно, при увеличении давления.
Тем не мение,
ведь объем, занимаемый килограммом жидкости, мало чем отличается
от того, что занимает килограмм твердого вещества, этот эффект очень мал
если давление не очень большое.Для большинства веществ замораживание
точка поднимается, хотя и очень незначительно, при увеличении давления.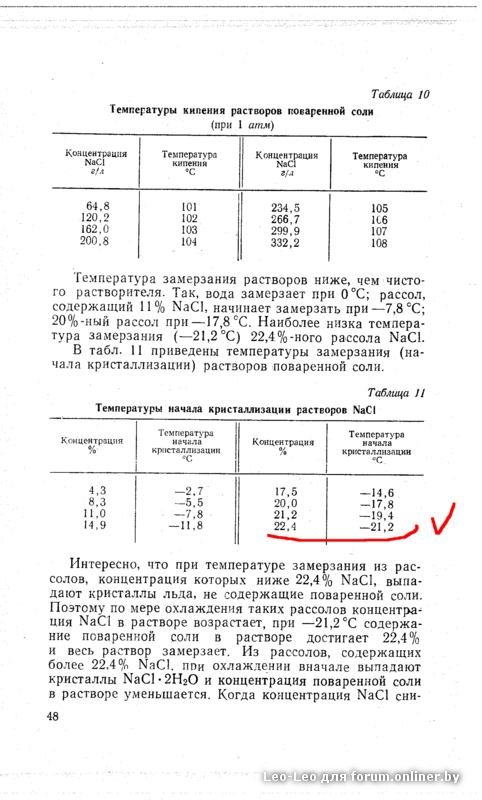 кг -1 ),
что составляет 0,3%. Умножьте это на температуру таяния льда (273 К).
и для этой области мы получаем оценку изменения температуры около 1 K = 1 °C. Итак, с
этих значений расчет предполагает, что давление конька
понизит температуру таяния льда примерно на
1 °С.Итак, при такой оценке площади и если бы это было причиной скользкости, льда
катание на коньках было бы возможно только при температуре всего один или несколько градусов
ниже точки замерзания. Судя по наблюдению, можно кататься на коньках по льду на
гораздо более низкие температуры, чем это. Чтобы утверждать, что понижение точки замерзания работает при температуре, скажем, 10°C, нам понадобится площадь
контакта конька около 10 мм 2 или менее. Если бы только острые кромки соприкасались со льдом, это могло бы быть возможно, но мне кажется, что это очень мало, потому что давление на лед было бы 100 МПа или 1000 атмосфер, и при таком напряжении я бы ожидал, что кромки врезаться в лед и увеличивать площадь контакта.
кг -1 ),
что составляет 0,3%. Умножьте это на температуру таяния льда (273 К).
и для этой области мы получаем оценку изменения температуры около 1 K = 1 °C. Итак, с
этих значений расчет предполагает, что давление конька
понизит температуру таяния льда примерно на
1 °С.Итак, при такой оценке площади и если бы это было причиной скользкости, льда
катание на коньках было бы возможно только при температуре всего один или несколько градусов
ниже точки замерзания. Судя по наблюдению, можно кататься на коньках по льду на
гораздо более низкие температуры, чем это. Чтобы утверждать, что понижение точки замерзания работает при температуре, скажем, 10°C, нам понадобится площадь
контакта конька около 10 мм 2 или менее. Если бы только острые кромки соприкасались со льдом, это могло бы быть возможно, но мне кажется, что это очень мало, потому что давление на лед было бы 100 МПа или 1000 атмосфер, и при таком напряжении я бы ожидал, что кромки врезаться в лед и увеличивать площадь контакта. (Опять же прошу совета по этому поводу у скейтеров, а лучше у физиков, которые тоже скейтеры.)
(Опять же прошу совета по этому поводу у скейтеров, а лучше у физиков, которые тоже скейтеры.)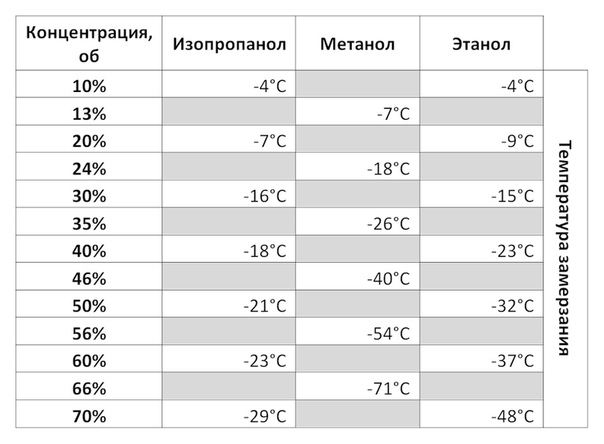 ]
] При низком давлении 611 Па (всего 0,006 раз
атмосферное давление), чистая вода кипит при 0,01 °C, а также
замерзает при 0,01 °C. Комбинация условий (P, T) =
(611 Па, 0,01 °C) называется тройной точкой 90 179
вода , потому что при этом давлении и температуре лед, жидкая вода и
пар может сосуществовать в равновесии.Эта точка используется для определения нашей шкалы
температуры: по определению, тройная точка воды находится при
273,16 К, где К – кельвин. 273,16 К = 0,01 °С
При низком давлении 611 Па (всего 0,006 раз
атмосферное давление), чистая вода кипит при 0,01 °C, а также
замерзает при 0,01 °C. Комбинация условий (P, T) =
(611 Па, 0,01 °C) называется тройной точкой 90 179
вода , потому что при этом давлении и температуре лед, жидкая вода и
пар может сосуществовать в равновесии.Эта точка используется для определения нашей шкалы
температуры: по определению, тройная точка воды находится при
273,16 К, где К – кельвин. 273,16 К = 0,01 °С )
) )
)

 Почему, однако, не стоит продолжать, если особый лед растаял?
Почему, однако, не стоит продолжать, если особый лед растаял?  Почему это так? Какой способ вкуснее?
Почему это так? Какой способ вкуснее? 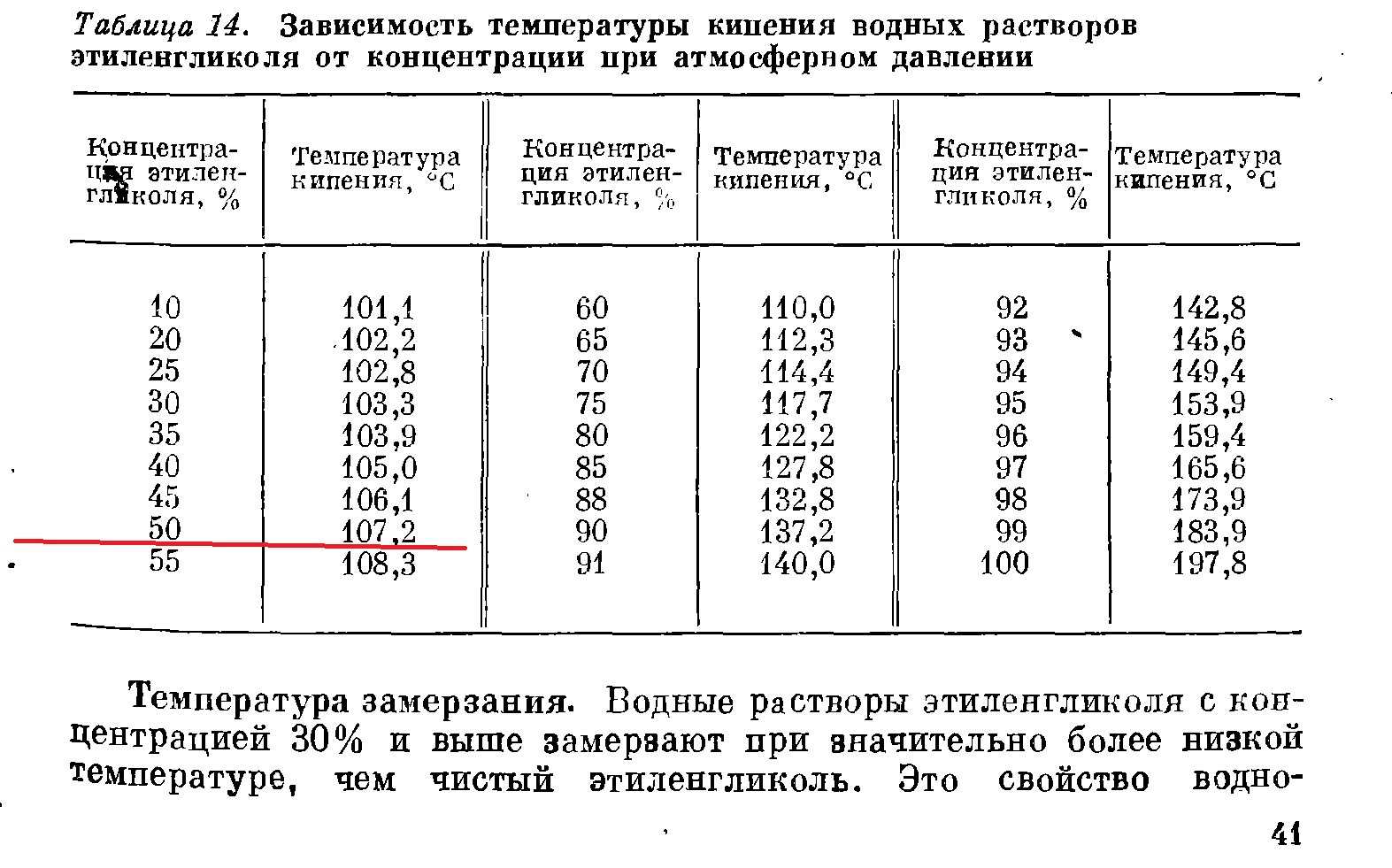
 Используйте ленту для замораживания, маркеры или мелки для маркировки замораживания или этикетки с клеевым покрытием, специально предназначенные для замораживания.
Используйте ленту для замораживания, маркеры или мелки для маркировки замораживания или этикетки с клеевым покрытием, специально предназначенные для замораживания.