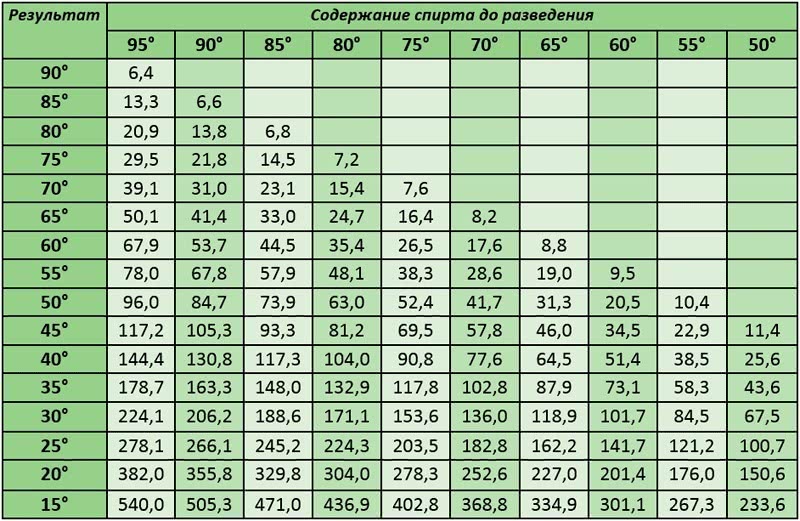
Чтобы раствор не замерзал: Что добавить в раствор чтобы не замерзал
Что добавить в бетон, чтобы он не замерз — Спецтехника
Редактор 3 августа, 2018 Строительство Комментарии к записи Что добавить в бетон, чтобы он не замерз отключены 0 Views
В бетонном строительстве зачастую очень важно сделать воду незамерзающей в минусовую температуру, чтобы успешно делать цементный раствор. Чтобы это стало возможным, талантливые инженеры придумали в свое время противоморозные добавки. Поговорим о них.
Чаще всего в наши дни приобретаются два вещества – формиат и нитрит натрия.
ФОРМИАТ НАТРИЯ
Формиат является кристаллическим порошком, имеющим определенный состав. Помимо 97,5 % самого вещества. Тут есть еще 0,3% воды и 2,5 % органических примесей. Добавив этот порошок в воду, вы снизите точку ее замерзания во время затворения цементного раствора и бетона.
Благодаря формиату натрия бетон довольно быстро приобретает прочность, а бетонная смесь будет иметь максимально продолжительный срок своей «жизнеспособности». Данная смесь может быть применена в мороз до -15 градусов при изготовлении бетонов и их укладке в таких работах, как возведение монолитных и сборных конструкций из бетона (железобетона).
Формиат натрия имеет немало преимуществ перед своими противоморозными аналогами. Прежде всего, этот порошок не может взорваться или загореться. При нахождении в водной или воздушной средах он не образует каких-то токсических соединений. Формиата натрия в бетонную смесь нужно вводить существенно меньше, чем других антиморозных добавок.
А сколько конкретно надо добавить этого вещества в бетон, чтобы результат соответствовал ожиданиям? Это напрямую зависит от температуры окружающего воздуха:
- -5С0 – потребуется 2% сухой смеси от общего веса цемента.
- -10С0 – 3%.
- -15С0 – 4%.
Невзирая на то, что формиат натрия в целом безопасен, работать с ним надо при четком соблюдении правил безопасности. Наденьте перчатки с маской и специальный строительный халат. Вещество не горит, но курить и разводить открытый огонь в местах его применения нельзя. Следует помнить, что формиат натрия не используется.
Если будущая бетонная или железобетонная конструкция рассчитана на эксплуатацию в водных или газовых средах, а также при влажности воздуха свыше 60%. Предприятия, потребляющие постоянный ток, а также электрифицированный транспорт – это тоже неподходящие сферы применения формиата натрия.
Предприятия, потребляющие постоянный ток, а также электрифицированный транспорт – это тоже неподходящие сферы применения формиата натрия.
НИТРИТ НАТРИЯ
Нитрит натрия – очень токсичный противоморозный компонент, который вдобавок ко всему способен и взрываться, и гореть. Вещество отнесено в третий класс опасности по данным параметрам. Готовить смесь можно лишь в особых помещениях, специально выделенных под эти цели. Нельзя делать смесь там, где впоследствии будут пребывать люди, а также предполагается нахождение источников воспламенения.
Порошок растворяется в закрытых установках с максимальной механизацией. Для таких мероприятий должно привлекаться минимальное число персонала.
Нитрит натрия чрезвычайно опасен, но все равно применяется в строительстве довольно широко. Причиной тому служат уникальные свойства:
- Первоначальная водонепроницаемость бетона, а также его прочность возрастают в разы.
- Предотвращается коррозия металла в ЖБИ, уменьшается существенно пылеобразование.

- Морозостойкость позволяет вести строительство даже при морозах под -20С.
Как видите, противоморозные добавки делают бетон пригодным к строительству даже зимой, а также улучшают его ключевые эксплуатационные характеристики.
About Редактор
Previous Какой клей подходит для плитки?
Next Способы обработки древесины
Check Also
На основании требований СНиП следует выбирать для возведения фундамента бетон не ниже марки М250, но …
Народные добавки, улучшающие качество бетона
Для улучшения свойств бетона можно использовать народные рецепты, которыми еще пользовались наши предки.
Базовая характеристика раствора, содержащего цемент, заключается в прочности на сжатие готовых изделий.
Схватывание и прочность залитого раствора зависит от его гидратации.
Минералы, которые входят в состав цемента, вступают в реакцию с водой и воздухом, что приводит к связыванию наполнителя в виде песка, гравия, шлака, керамзита и других.
Рассмотрим основные народные добавки в бетон, которые модифицируют его свойства и удобны тем, что их можно сделать самим в домашних условиях.
Изготовление пластификатора для бетона своими руками
Пластификатором называется вещество, повышающее показатели эластичности и пластичности бетона.
Он частично заменяет воду в составе раствора и препятствует процессу растрескивания смеси при высыхании.
Если бетон развести, но не использовать, то со временем он начинает расслаиваться. Пластификатор от этого уберегает и удлиняет жизнь раствора.
Он способствует:
- улучшению сцепки с поверхностью, на которую наносится раствор;
- дополнительной защите бетона от воды;
- более легкой укладки смеси.
В общем, свойства бетона улучшаются, и такой пластификатор можно сделать самим.
К народным способам улучшения качества бетона относятся:
Добавление куриных яиц и глины.
Уже доказано, что яйца имеют хорошие сцепляющие свойства, водонепроницаемость и способны уплотнить раствор.
Другим старинным материалом является глина, ее добавляли в сложный состав строительной смеси, когда еще не было бетона.
Готовили такую смесь долго, зато постройки стоят веками.
На сегодняшний день с помощью глины удешевляют бетон, заменяя ею часть цемента.
Такой бетон не подходит для фундаментов, так как возможны разрушения.
На большую прочность таких составов не стоит надеяться, но они могут применяться в небольшой дачной стройке.
Использование мыла.
И мыло, и цемент имеют щелочную среду, поэтому хорошо совместимы друг с другом. Когда оно попадает в строительную смесь, то происходит обволакивание каждой частички, уменьшая силу трения между ними и придавая пластичность раствору. Удобнее делать введение жидкого мыла или моющего средства не более 5% от общей массы раствора вместе с водой.
Как можно самим сделать противоморозные добавки для бетона
Если вам известно, что состав будет подвержен воздействию экстремально низких температур, то необходимо приготовить морозоустойчивый раствор.
Увеличить этот показатель помогает техническая соль, но ее нельзя добавлять более 2%. Если бетон будет взаимодействовать с арматурой, то возможна коррозия, тогда в раствор необходимо вводить ингибиторы коррозии.
Также при разведении бетона можно использовать меньше воды, но в разумных пределах, иначе произойдет нарушение других свойств бетона.
Выбрать готовые строительные смеси, имеющие гарантированные характеристики и предсказуемый результат, можно в компании РегионСтройБетон.
Мы занимаемся продажей качественного бетона разных марок и доставляем его на объект в строго оговоренные сроки.
Наша компания обладает собственным производством, поэтому цены на бетон выгодные и не включают дополнительных наценок посредников.
Для того, чтобы узнать все подробности и сделать заказ свяжитесь с нашими специалистами по указанным на сайте контактам.
Источник: regionstroibeton.ru
ChemTeam: Депрессия точки замерзания
ChemTeam: Депрессия точки замерзанияДепрессия точки замерзания
Проблемы 1-10
Пробы 11-25
Вернуться в меню решений
Учебное пособие по повышению температуры кипения
Раствор затвердевает (замерзает) при более низкой температуре, чем чистый растворитель.
Чем больше растворенного вещества растворено, тем сильнее эффект. Для этого поведения было разработано уравнение. Это:
Δt = i K f м
Δt — изменение температуры от точки замерзания чистого растворителя до точки замерзания раствора. Он равен двум константам, умноженным на моляльность раствора. Константа K f фактически получена из нескольких других констант, и ее вывод описан в учебниках по вводной термодинамике. Его техническое название — криоскопическая постоянная. Греческая приставка крио- означает «холодный» или «замораживающий». В более общем смысле это называется «моляльной константой понижения температуры замерзания».
Постоянная, называемая фактором Ван ‘т Хоффа, обозначается буквой ‘i’ и обсуждается ниже примеров задач.
Вот некоторые примеры криоскопических констант:
Вещество K f бензол 5. 12
камфора 40. четыреххлористый углерод 30. этиловый эфир 1,79 вода 1,86
Единицами константы являются градусы Цельсия на моляль (°C м¯ 1 ). Есть два варианта единиц измерения константы, которые вы также должны знать:
1) K m¯ 1 : используется кельвин, а не градус Цельсия. Однако «расстояние» между одним градусом Цельсия и кельвином одинаково, числовое значение не изменяется. Его редко можно увидеть, и я буду игнорировать его.2) °C кг моль¯ 1 : этот берет моляль (моль/кг) и подводит кг (который находится в знаменателе знаменателя) и подводит его к числителю.
Последнее очень полезно, потому что оно разделяет молярную единицу. Мы будем использовать приведенное выше уравнение для расчета молекулярной массы. Имейте в виду, что единицей молекулярной массы является грамм/моль.
Еще одно напоминание: моляль – это количество молей растворенного вещества на кг растворителя.
Перейдите к примерам задач, чтобы обсудить фактор Ван ‘т Хоффа.
Пример №1: Чистый бензол замерзает при 5,50 °C. Раствор, приготовленный путем растворения 0,450 г неизвестного вещества в 27,3 г бензола, замерзает при 4,18 °С. Определите молекулярную массу неизвестного вещества. Константа точки замерзания бензола составляет 5,12 °С/м.
Решение:
Δt = i К f м1,32 °C = (1) (5,12 °C кг моль¯ 1 ) (x / 0,0273 кг)
1,32 °С = (187,5458 °С моль¯ 1 ) (х)
х = 0,007038 моль
0,450 г / 0,007038 моль = 63,9 г/моль
Обратите внимание на предположение, что вещество не ионизируется. Это довольно безопасное предположение, когда растворителем является бензол. Также обратите внимание на предположение, что растворенное вещество нелетуче.
Пример #2: Сколько граммов этиленгликоля, C
Решение:
Δt = i К f м8,35 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 0,4000 кг)
8,35 °C = (4,65 °C моль¯ 1 ) (x)
х = 1,7957 моль
1,7957 моль умножить на 62,07 г/моль = 111 г (до трех знаков инжира)
Раствор замерзает при -1,37 °C.
Обратите внимание на коэффициент Ван-т-Гоффа, равный 1. Это значение используется для веществ, которые не ионизируются в растворе. Практически все, если не все, органические вещества в растворе не ионизируются. каждый из них имеет фактор Ван ‘т-Гоффа, равный 1, и они называются неэлектролитами.
Пример #3: 33,7 г образца неэлектролита растворяли в 750 г воды. Температура замерзания раствора составляла -2,86 °С. Какова молярная масса соединения? K f = 1,86 °С/м.
Решение:
Δt = i К f м2,86 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 0,750 кг)
2,86 °C = (2,48 °C моль¯ 1 ) (x)
х = 1,1532 моль
33,7 г / 1,1532 моль = 29.2 г/моль
Пример #4: Образец нафталина массой 1,60 г (неэлектролит с формулой C  Какова температура замерзания раствора?
Какова температура замерзания раствора?
Решение:
1) Определите моляльность нафталина:
(1,60 г / 128,1732 г/моль) / 0,0200 кг = 0,624155 м
2) Определите депрессию точки замерзания:
Δt = i K f мx = (1) (5,12 °C кг моль¯ 1 ) (0,624155 моль/кг)
х = 3,2 °С
3) Определить точку замерзания:
5,5 − 3,2 = 2,3 °С
Пример № 5: Камфора (C 6 H 16 O) плавится при 179,8 °C и имеет особенно большую константу понижения температуры замерзания, K f = 40,0 °C/м. При растворении 0,186 г органического вещества с неизвестной молярной массой в 22,01 г жидкой камфоры температура замерзания смеси оказывается равной 176,7 °С. Какова молярная масса растворенного вещества?
Решение:
179,8 — 176,7 = 3,1 °СΔt = i К f м
3,1 °C = (1) (40,0 °C кг моль¯ 1 ) (x / 0,02201 кг)
3,1 °C = (1) (1817,356 °C моль¯ 1 ) (x)
х = 0,001705775 моль
0,186 г / 0,001705775 моль = 109 г/моль
Пример №6: Температура замерзания раствора, приготовленного путем растворения 150,0 мг кофеина в 10,0 г камфоры, на 3,07 градуса Цельсия ниже, чем у чистой камфоры (К f = 40,0 °С/м). Какова молярная масса кофеина?
Какова молярная масса кофеина?
Решение:
1) Используйте изменение точки замерзания для расчета моляльности раствора:
Изменение FP = K f (м) 3,07 °C = (40,0 °C/м) (м)м = 0,07675 моляля
Помните: моляльность – количество молей растворенного вещества на килограмм растворителя
2) Переведите концентрацию раствора в граммы растворенного вещества на 1000 г растворителя:
150 мг 1 г 1000 г ––––––– х ––––––– х ––––––– = 15,0 г растворенного вещества / 1 кг растворителя 10,0 г 1000 мг 1 кг
3) Разделив эту концентрацию на моляльность раствора, вы получите молярную массу:
15,0 г/кг –––––––––––––– = 195 г/моль 0,07675 моль/кг
Пример №7: Какова температура замерзания водного раствора, полученного путем растворения 10,90 г MgCl 2 в 88,41 г H 2 O?
Решение:
10,90 г / 95,211 г/моль = 0,1144826 моль0,1144826 моль/0,08841 кг = 1,2949 м
Δt = i K f м
Δt = (3) (1,86 °C/м) (1,2949 м)
Δt = 7,226 °C (до 4 цифр)
Температура замерзания раствора –7,226 °С.
В действительности точка замерзания может быть ближе к −6,5 °C из-за ионного спаривания между Mg 2+ и ионами Cl¯. Коэффициент Ван-т-Гоффа ближе к 2,7 для концентрированного раствора MgCl 2 (у меня нет источника по этому вопросу, я просто видел упоминание об этом несколько раз за эти годы). Ионные пары на короткое время образуются, поскольку противоположно заряженные частицы притягиваются и уменьшают видимое количество частиц. Помните, коллигативные свойства зависят от общего количества частиц, уменьшите их, и вы уменьшите эффект.
Пример #8: При какой температуре замерзнет раствор фторида стронция с концентрацией 29,3% (по весу)?
Решение:
1) Нам нужна моляльность раствора SrF 2 . Для этого сначала предположим, что имеется 100 г раствора. Поэтому:
29,3%(вес/вес) означает 29,3 г SrF 2 в 100 г раствора, а также 70,7 г воды.
2) Поскольку моляльность включает моли растворенного вещества, мы вычисляем моли SrF 2 :
29,3 г / 125,62 г/моль = 0,233243 моль
3) Теперь моляльность:
0,233243 моль/0,0707 кг = 3,29905 м
4) Теперь мы готовы к расчету точки замерзания:
Δt = i К f мΔt = (3) (1,86) (3,29905) Δt = 18,4087 °С
Раствор замерзает при −18,4 °C
Фактор Ван-т-Гоффа
Фактор Ван ‘т Гоффа обозначается строчной буквой i. Это безразмерная константа, непосредственно связанная со степенью диссоциации растворенного вещества в растворителе.
Это безразмерная константа, непосредственно связанная со степенью диссоциации растворенного вещества в растворителе.
Вещества, которые не ионизируются в растворе, например сахар, имеют i = 1.
Вещества, которые ионизируются до двух ионов, например NaCl, имеют i = 2.
Вещества, которые ионизируются до трех ионов, например MgCl 2 , имеют i = 3.
И так далее. . . .
Это современное объяснение. В 1880-х годах, когда ван ‘т Хофф собирал и изучал данные о температурах кипения и замерзания, он не понял, что я имел в виду. Он использовал i только для того, чтобы попытаться совместить данные. Собственно, вот что у него было:
Возьмите 1,0 молярный раствор сахара и измерьте его повышение АД. Теперь исследуйте 1,0-молярный раствор NaCl. Его повышение б.п. в два раза превышает значение сахара. Когда он сделал MgCl 2 , он получил значение в три раза больше, чем у сахара.
Все его значения начинают группироваться вместе, одна группа с сахароподобными значениями, другая с NaCl-подобными значениями и третья с MgCl 2 -подобными значениями.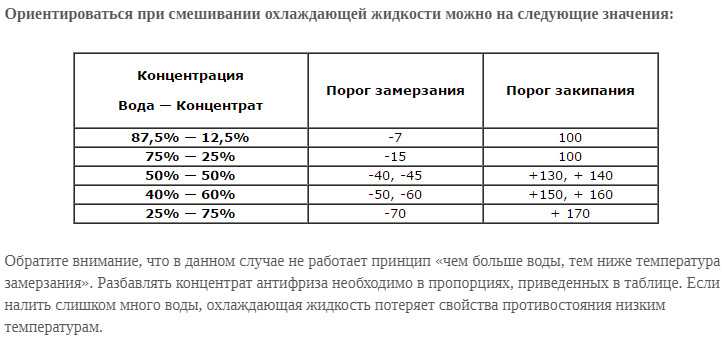
Вот как каждая группа получила свое значение i, и он понятия не имел, почему. То есть, пока он не узнал о теории электролитической диссоциации Сванте Аррениуса. Затем современное объяснение, приведенное выше, стало очень ясным.
Вещества, которые частично ионизируют раствор, обычно имеют значение i от 1 до 2. Я решу пример задачи по осмосу, где i = 1,17. Кроме того, значения i могут быть снижены с помощью концепции, называемой «спаривание ионов». Например, NaCl имеет фактическое i = 1,8 из-за спаривания ионов. Я оставлю это вам, чтобы узнать, что такое ионное спаривание.
Пример №9: Температура замерзания 0,0925 мл водного раствора хлорида аммония оказалась равной –0,325 °C. Каков фактический фактор Ван’т-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением, равным 2? К f = 1,86 °С/м
Решение:
Δt = i К f м0,325 °C = (x) (1,86 °C/м) (0,0925 м)
х = 1,89
Пример №10: Раствор 5,00 г хлорида натрия в 1,00 кг воды имеет температуру замерзания –0,299 °C. Каков фактический фактор Вант-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением 2? K f (вода) = 1,86 °C/м
Каков фактический фактор Вант-Гоффа для этой соли при данной концентрации по сравнению с идеальным значением 2? K f (вода) = 1,86 °C/м
Решение:
1) Определите моляльность раствора NaCl:
(5,00 г / 58,443 г/моль) / 1,00 кг = 0,085553 м
2) Определить фактор Вант-Гоффа:
Δt = i К f м0,299 °C = (x) (1,86 °C/м) (0,085553 м)
х = 1,89
Пример #11: Раствор готовят путем растворения 1,53 г ацетона (СН 3 СОСН 3 ) в 50,00 г воды. Его температура замерзания составляет -0,980 ° C. Диссоциирует ли ацетон в растворе?
Решение:
1) Определите количество молей ацетона:
1,53 г / 58,0794 г/моль = 0,02634325 моль
2) Путь решения №1: предположить отсутствие диссоциации и вычислить ожидаемую точку замерзания:
Δt = i К f мx = (1) (1,86 °C кг моль¯ 1 ) (0,02634325 моль / 0,0500 кг)
x = 0,9799689 °C = 0,980 °C (с точностью до трех цифр)
Ацетон не диссоциирует в растворе.
3) Путь решения №2: рассчитать значение фактора Ван ‘т Хоффа:
Δt = i K f м0,980 °C = (y) (1,86 °C кг моль¯ 1 ) (0,02634325 моль / 0,0500 кг)
г = 1,00
Ацетон не диссоциирует в растворе.
Пример #12: Водный раствор содержит 0,8402 моляль Na 2 SO 4 . Его температура замерзания составляет -4,218 °C. (a) Определите эффективное число частиц, возникающих из каждой формульной единицы Na 2 SO 4 в этом растворе. (b) Какое поведение сульфата натрия в растворе объясняет различие по сравнению с теоретическим фактором Ван ‘т Гоффа, равным 3?
Δt = i K f м4,218 = (х) (1,86) (0,8402)
х = 2,699 = 2,7
Na 2 SO 4 демонстрирует «спаривание ионов». В каждый данный момент в растворе находится не 100% ионов натрия, а сульфат-ионы. Некоторые NaSO 4 2 ¯ (и даже некоторые Na 2 SO 4 ) существуют, образуясь и распадаясь от мгновения к мгновению.
Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.
Пример №13: Температура замерзания 5,00% раствора CH 3 COOH(водн.) составляет -1,576 °C. (а) Определите экспериментальный фактор Вант-Гоффа для этого раствора. б) Основываясь на своем понимании межмолекулярных сил, объясните их значение.
Решение:
1) Предположим, что процентное соотношение равно массе (и что это водный раствор), и рассчитаем моляльность:
5,00% означает 5,00 г уксусной кислоты и 95,0 г воды.5,00 г / 60,054 г/моль = 0,0832584 моль
0,0832584 моль/0,0950 кг = 0,8764 м
2) Рассчитайте фактор Ван-т-Гоффа:
Δt = i К f м1,576 °C = (x) (1,86 °C кг моль -1 ) (0,8764 моль/кг)
х = 0,9668
Для (b) обратите внимание, что фактор Ван ‘т Гоффа на меньше , чем на единицу. Если бы растворенный CH 3 COOH ионизировался, то фактор Ван ‘т Гоффа был бы в больше , чем единица.
Объяснение состоит в том, что CH 3 COOH образует димеры (две молекулы CH 3 COOH объединяются в одну «молекулу»). Это уменьшает количество частиц в растворе, тем самым уменьшая фактор Ван-т-Гоффа.
Множество изображений димеров уксусной кислоты можно найти в Интернете. Вот некоторые.
Пример №14: Расположите следующие водные растворы в порядке убывания температуры замерзания:
0,10 м КНО 3
0,10 м BaCl 2
0,10 м C 2 H 4 (OH) 2
0,10 м Na 3 PO 0 2 9 4Решение:
1) Определить коэффициент Вант-Гоффа для каждого вещества:
0,10 м KNO 3 —> один ион K + и один нитрат-ион на формульную единицу, фактор Ван-Т-Гоффа = 20,10 м BaCl 2 —-> один ион Ba 2+ и два иона хлорида на формульную единицу, фактор Ван-т-Гоффа = 3
0,10 м C 2 H 4 (OH) 2 —> этиленгликоль не ионизируется в растворе, фактор Ван ‘т Хоффа = 1
0,10 м Na 3 PO 4 —> три иона Na + и один ион фосфата на формульную единицу, фактор Вант-Гоффа = 4
2) Определите эффективную моляльность каждого раствора:
KNO 3 —> 0,10 м x 2 = 0,20 мBaCl 2 —> 0,10 м x 3 = 0,30 м
C 2 H 4 (OH) 2 —> 0,10 м x 1 = 0,10 м
Na 3 Заказ на покупку 4 —> 0,10 м x 4 = 0,40 м
3) Я понял, что этот вопрос означает порядок, в котором первое вещество имеет точку замерзания, ближайшую к чистой воде, а последнее имеет самую низкую точку замерзания, значение которого наиболее далеко от 0 °C.
C 2 H 4 (OH) 2 KNO 3
BaCl 2
Na 3 PO 4Пример №15: Определенный растворитель имеет температуру замерзания −22,465 °C. В этом растворителе готовят разбавленные (0,050 мл) растворы четырех распространенных кислот и измеряют их точки замерзания, получая следующие результаты:
Acid: HCl H 2 SO 4 HClO 3 HNO 3 Freezing Point: −22.795 °C –22,788 °C –22,791 °C –22,796 °C (а) Определите K f для этого растворителя и (б) укажите причину, по которой одна из кислот так сильно отличается от других своей способностью понижать температуру замерзания.
Решение:
1) Определите K f для каждой кислоты, используя:
Δt = i K f м2) HCl (фон-т-Гофф = 2)
0,333 °С = (2) (К ф ) (0,050 м)K f = 3,3 (до двух знаков фиг)
3) H 2 SO 4 (фон-т-Гофф = 3) 0,323 °C = (3) (K f ) (0,050 м)
K f = 2,2 (до двух знаков фиг)
4) HClO 3 (фон-т-Гофф = 2)
0,326 °C = (2) (K f ) (0,050 м)K f = 3,3 (до двух знаков фиг)
5) HNO 3 (фон ‘т Гофф = 2)
0,331 °С = (2) (К ф ) (0,050 м)K f = 3,3 (до двух знаков фиг)
6) Ответ на (б) заключается в том, что H 2 SO 4 не ионизируется на 100% в обоих атомах водорода. Серная кислота сильна только своим первым водородом:
Ионизация второго водорода слабая, в результате чего серная кислота имеет коэффициент Ван ‘т-Гоффа чуть больше 2, а не 3, как на шаге №3, чуть выше.
Некоторые дополнительные комментарии о температуре кипения и замерзания раствора
Чистые вещества имеют истинные температуры кипения и замерзания, а растворы — нет. Например, чистая вода имеет температуру кипения 100°С и температуру замерзания 0°С. Например, при кипении, когда чистый водяной пар покидает жидкость, остается только чистая вода. С раствором не так.
При кипении раствора, если растворенное вещество нелетучее, то в паровую фазу переходит только чистый растворитель. Растворенное остается (в этом смысл нелетучести). Однако следствием этого является то, что раствор становится более концентрированным, следовательно, повышается его температура кипения. Если бы вы построили график изменения температуры кипения чистого вещества в зависимости от времени, линия осталась бы плоской. В случае с раствором линия будет стремиться вверх по мере того, как раствор становится более концентрированным.
Нелетучее растворенное вещество — это вещество, которое остается в растворе.
Испаряющийся пар является только чистым растворителем. С другой стороны, летучее растворенное вещество выкипает вместе с растворителем.
Соль в воде является примером нелетучего растворенного вещества. Выкипает только вода, а при высыхании остается белое твердое вещество (NaCl). Гексан, растворенный в пентане, является примером летучего растворенного вещества. Пар будет представлять собой смесь гексана и пентана. Однако здесь есть кое-что очень интересное. Процентное содержание гексана и пентана в парах будет РАЗЛИЧНЫМ, чем процентное содержание каждого из них в растворе. Мы рассмотрим это в другом уроке.
И последнее, что заслуживает небольшого упоминания, это концепция азеотропа. Это постоянно кипящая смесь. Это означает, что смесь паров, выходящих из кипящего раствора, такая же, как смесь раствора. О первом появлении сообщил Дальтон в 1802 году, но это слово не было придумано до 1911 года.
Одним из примеров бинарного азеотропа является 4% (по весу) воды и 96% этилового спирта.
Кстати, это означает, что вы не можете получить чистый 100% спирт (так называемый абсолютный спирт) путем кипячения. Вы должны использовать другие средства, чтобы получить последние 4%. Это также означает, что абсолютный спирт гигроскопичен, что он поглощает воду из атмосферы.
Справочник по химии и физике за 1992 г. перечисляет следующее:
Азеотроп Номер Двоичный 1743 Тернарный 177 Четвертичный 21 Квинарий 2 Вот состав одной пятерной системы. Он кипит при 76,5°С.
Вещество Проценты
по весуВода 9,45 Нитрометан 37,30 Тетрахлорэтилен 21. 15
н-пропиловый спирт 10,58 н-октан 21,52 Довольно интересно, а?
Кстати, такое же понижение точки замерзания (иногда называемое затвердеванием) происходит и с металлическими сплавами, такими как припои. Сплав на самом деле имеет температуру плавления ниже, чем у любого из его исходных металлов. Отношение с самой низкой точкой называется «эвтектическим» сплавом; 63 части олова на 37 частей свинцового электрического припоя — одна из таких эвтектических смесей.
Пробы 1-10
Пробы 11-25
Учебное пособие по повышению температуры кипения
Вернуться в меню решений
Депрессия точки замерзания — Концепция
Депрессия точки замерзания является коллигативным свойством растворов. Точки замерзания растворов ниже, чем у чистого растворителя или растворенного вещества, потому что замерзание или затвердевание создает порядок и снижает энтропию.
Растворы имеют высокую энтропию из-за смеси растворителя и растворенного вещества, поэтому требуется больше энергии, чтобы уменьшить их энтропию до той же точки.
точка замерзания депрессия возвышение давление пар
Хорошо, когда имеешь дело с растворами, ты столкнешься с коллигативными свойствами, и одно из коллигативных свойств, которое ты увидишь, — понижение точки замерзания, и это говорит о том, что в растворе частицы растворенного вещества мешают силам притяжения между частицы растворителя. И это предотвращает переход раствора в твердое состояние. Так что, по сути, они говорят, что жидкость содержит все эти дополнительные частицы, чтобы сделать раствор, и это не чистый растворитель, который мешает межмолекулярным силам, которые делают его твердым, твердым. Подобно водородной связи, диполь-дипольному взаимодействию и лондонским дисперсионным силам, те дополнительные частицы, которые присутствуют, как бы мешают и фактически помогают снизить температуру замерзания, чтобы вытолкнуть эти частицы, чтобы они чистый растворитель, когда он фактически заморожен.
Точка замерзания означает, что частицы больше не обладают достаточной кинетической энергией для преодоления сил межмолекулярного притяжения, поэтому, когда эти частицы существуют, эти силы притяжения не нужны. Таким образом, им придется просто вытолкнуть эти частицы, чтобы они действительно могли иметь внутренние силы притяжения частиц. Итак, давайте поговорим о различных веществах и их точках замерзания. Итак, мы говорим о воде, которая является универсальным растворителем, и мы знаем, что вода обычно замерзает при 0 градусов по Цельсию при нормальной температуре замерзания. Теперь на каждый моляль вещества, которое я собираюсь поместить в воду в чистом веществе, фактически понизится температура точки замерзания на 1,86 градуса Цельсия.
Бензол замерзает при температуре 5,5 градусов по Цельсию, намного выше, чем вода, и для каждого моля вещества, которое у вас есть на килограмм раствора, температура кипения упадет еще больше на 5,12 градусов по Цельсию и так далее и тому подобное.
Итак, если вы посмотрите на это, это очень похоже на повышение точки кипения, но эта формула набора точно такая же, но есть некоторые небольшие отличия. Таким образом, изменение температуры точки замерзания равно константе, которую мы обсуждали, временное подобие этого решения, с которым мы имеем дело, время — это фактор Бен-Хоффа, а фактор Бен-Хоффа — это то, насколько частица фактически разделяется за решение. Итак, мы говорим об ионных соединениях, они распадаются в раствор в зависимости от того, сколько в них частиц или сколько ионов в них содержится, а молекулярные соединения вообще не растворяются. Итак, давайте на самом деле поместим это в действие.
Итак, какова температура замерзания 0,029-моляльного водного раствора NaCl, чтобы мы знали, что это водный раствор, а водный раствор говорит нам, что наш растворитель — вода. Итак, мы собираемся сказать, что наша дельта Т при изменении температуры до точки замерзания будет равна константе воды, которая составляет 1,86 градуса Цельсия на каждый моляр.
И молярный раствор 0,029, и, поскольку это NaCl, я знаю, что он ионный, на каждый моляль он фактически разделится на 2 вещества: Na плюс и Cl минус. Таким образом, мы фактически умножаем это на 2, у нас есть вещества, когда они находятся в растворе. Итак, если вы умножите все это вместе, вы получите 0,11 градуса Цельсия, и мы собираемся сказать, что наша исходная точка замерзания равна 0, она снизится на 0,11, и поэтому наша новая точка замерзания будет отрицательной на 0,11 градуса Цельсия, потому что она упала так сильно. Так что мы можем на самом деле поговорить о том, когда вы думаете о том, когда на улице идет снег, и о причине, по которой вы посыпаете дороги солью, на дорогах нет даже соли, которая на самом деле снизит точку замерзания, поэтому не будет простыней. льда на подъездной дорожке, дорогах или тротуарах. Вот почему они используют соль, и они обычно используют хлорид кальция, который на самом деле лучше, чем хлорид натрия, потому что он фактически распадается на 3 частицы, поэтому он снизит точку замерзания в 3 раза больше, чем другое растворенное вещество.

 12
12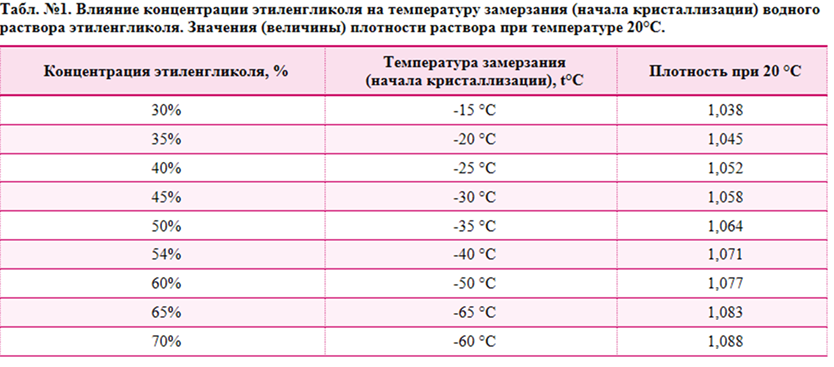


 Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.
Это ионное спаривание уменьшает количество частиц в растворе, тем самым снижая фактор Вант-Гоффа.



 Испаряющийся пар является только чистым растворителем. С другой стороны, летучее растворенное вещество выкипает вместе с растворителем.
Испаряющийся пар является только чистым растворителем. С другой стороны, летучее растворенное вещество выкипает вместе с растворителем.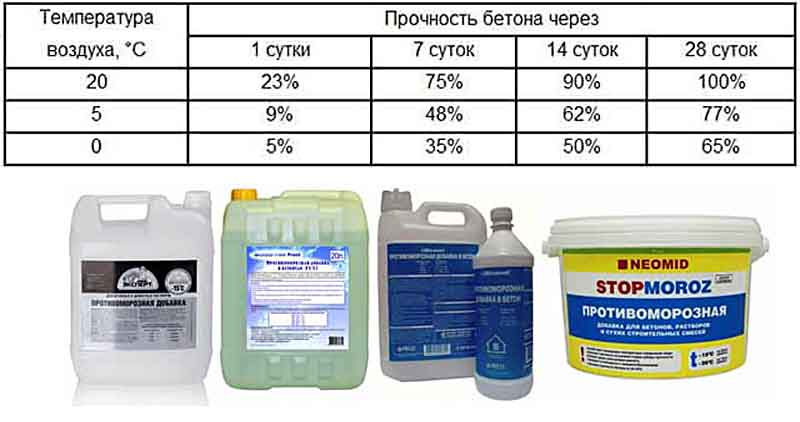 Кстати, это означает, что вы не можете получить чистый 100% спирт (так называемый абсолютный спирт) путем кипячения. Вы должны использовать другие средства, чтобы получить последние 4%. Это также означает, что абсолютный спирт гигроскопичен, что он поглощает воду из атмосферы.
Кстати, это означает, что вы не можете получить чистый 100% спирт (так называемый абсолютный спирт) путем кипячения. Вы должны использовать другие средства, чтобы получить последние 4%. Это также означает, что абсолютный спирт гигроскопичен, что он поглощает воду из атмосферы. 15
15 Растворы имеют высокую энтропию из-за смеси растворителя и растворенного вещества, поэтому требуется больше энергии, чтобы уменьшить их энтропию до той же точки.
Растворы имеют высокую энтропию из-за смеси растворителя и растворенного вещества, поэтому требуется больше энергии, чтобы уменьшить их энтропию до той же точки.
 Итак, если вы посмотрите на это, это очень похоже на повышение точки кипения, но эта формула набора точно такая же, но есть некоторые небольшие отличия. Таким образом, изменение температуры точки замерзания равно константе, которую мы обсуждали, временное подобие этого решения, с которым мы имеем дело, время — это фактор Бен-Хоффа, а фактор Бен-Хоффа — это то, насколько частица фактически разделяется за решение. Итак, мы говорим об ионных соединениях, они распадаются в раствор в зависимости от того, сколько в них частиц или сколько ионов в них содержится, а молекулярные соединения вообще не растворяются. Итак, давайте на самом деле поместим это в действие.
Итак, если вы посмотрите на это, это очень похоже на повышение точки кипения, но эта формула набора точно такая же, но есть некоторые небольшие отличия. Таким образом, изменение температуры точки замерзания равно константе, которую мы обсуждали, временное подобие этого решения, с которым мы имеем дело, время — это фактор Бен-Хоффа, а фактор Бен-Хоффа — это то, насколько частица фактически разделяется за решение. Итак, мы говорим об ионных соединениях, они распадаются в раствор в зависимости от того, сколько в них частиц или сколько ионов в них содержится, а молекулярные соединения вообще не растворяются. Итак, давайте на самом деле поместим это в действие. И молярный раствор 0,029, и, поскольку это NaCl, я знаю, что он ионный, на каждый моляль он фактически разделится на 2 вещества: Na плюс и Cl минус. Таким образом, мы фактически умножаем это на 2, у нас есть вещества, когда они находятся в растворе. Итак, если вы умножите все это вместе, вы получите 0,11 градуса Цельсия, и мы собираемся сказать, что наша исходная точка замерзания равна 0, она снизится на 0,11, и поэтому наша новая точка замерзания будет отрицательной на 0,11 градуса Цельсия, потому что она упала так сильно. Так что мы можем на самом деле поговорить о том, когда вы думаете о том, когда на улице идет снег, и о причине, по которой вы посыпаете дороги солью, на дорогах нет даже соли, которая на самом деле снизит точку замерзания, поэтому не будет простыней. льда на подъездной дорожке, дорогах или тротуарах. Вот почему они используют соль, и они обычно используют хлорид кальция, который на самом деле лучше, чем хлорид натрия, потому что он фактически распадается на 3 частицы, поэтому он снизит точку замерзания в 3 раза больше, чем другое растворенное вещество.
И молярный раствор 0,029, и, поскольку это NaCl, я знаю, что он ионный, на каждый моляль он фактически разделится на 2 вещества: Na плюс и Cl минус. Таким образом, мы фактически умножаем это на 2, у нас есть вещества, когда они находятся в растворе. Итак, если вы умножите все это вместе, вы получите 0,11 градуса Цельсия, и мы собираемся сказать, что наша исходная точка замерзания равна 0, она снизится на 0,11, и поэтому наша новая точка замерзания будет отрицательной на 0,11 градуса Цельсия, потому что она упала так сильно. Так что мы можем на самом деле поговорить о том, когда вы думаете о том, когда на улице идет снег, и о причине, по которой вы посыпаете дороги солью, на дорогах нет даже соли, которая на самом деле снизит точку замерзания, поэтому не будет простыней. льда на подъездной дорожке, дорогах или тротуарах. Вот почему они используют соль, и они обычно используют хлорид кальция, который на самом деле лучше, чем хлорид натрия, потому что он фактически распадается на 3 частицы, поэтому он снизит точку замерзания в 3 раза больше, чем другое растворенное вещество.