Чтобы не замерзал раствор: Незамерзайки в бетон сравнительные характеристики присадок — купить добавки в Москве
ПЛИТОНИТ АнтиМороз — противоморозная добавка для цементно-песчаных растворов
Клеи для плитки
PLITONIT PLITOFLEX 2500
PLITONIT В, усиленный армирующими волокнами
PLITONIT В+
PLITONIT С
PLITONIT Clinker Fix
PLITONIT В экспресс
PLITONIT С Мрамор
PLITONIT клей для керамогранита 600×600
PLITONIT СуперКамин ТермоКлей
PLITONIT Ускоренный
PLITONIT клей для керамогранита 450X450
PLITONIT СтройЭкспресс
PLITONIT А
PLITONIT В Profi
PLITONIT Mosaic White
PLITONIT В PRO
Затирки для швов
PLITONIT Colorit Easy Fill
PLITONIT СOLORIT PREMIUM
PLITONIT COLORIT
PLITONIT Colorit Fast Premium
PLITONIT З
PLITONIT COLORIT FAST CLINKER
Ровнители
PLITONIT Финиш
PLITONIT Р3
PLITONIT Р2
PLITONIT Universal
PLITONIT Р1 Pro
PLITONIT Р1 Easy
PLITONIT Easy Floor
PLITONIT Р200
PLITONIT Р300
PLITONIT Ламинат Пол
PLITONIT СуперФиниш
PLITONIT Р Экспресс
PLITONIT UNIVERSAL МН
Штукатурки
PLITONIT Т1+
PLITONIT РемСостав
PLITONIT S10
PLITONIT S11
Шпаклевки
PLITONIT Кп Pro
PLITONIT К
PLITONIT ФинишСлой
Грунтовки
PLITONIT Готовый Грунт
PLITONIT Грунт БетонКонтакт
PLITONIT Грунт 1
PLITONIT Грунт Упрочняющий
PLITONIT Грунт Базовый
PLITONIT Грунт СуперКонтакт
PLITONIT Грунт СуперПол
PLITONIT АкваГрунт
PLITONIT Грунт 2 Эластик
Гидроизоляция
PLITONIT WaterProof Standard
PLITONIT ГидроЭласт
PLITONIT ГидроЛента
PLITONIT WaterProof Premium
PLITONIT ГидроЛента угол внутренний 90°
PLITONIT ГидроЛента угол внешний 270°
PLITONIT Манжета гидроизоляционная напольная 425х425мм
PLITONIT Манжета гидроизоляционная настенная 120х120 мм
PLITONIT ГидроСлой
PLITONIT ГидроСлой Экспресс
PLITONIT ГидроСтоп
PLITONIT ГидроЭласт 2К
Кладочные смеси
PLITONIT А
PLITONIT Мастер Кладки
PLITONIT Мастер Кладки Зимний
Смеси для устройства печей и каминов «Суперкамин»
PLITONIT СуперКамин ТермоКлей
PLITONIT СуперКамин ОгнеУпор
PLITONIT СуперКамин ТермоКладка
PLITONIT СуперКамин ТермоРемонт
PLITONIT СуперКамин ТермоКладка Глиняная
PLITONIT СуперКамин ТермоШтукатурка
Добавки для растворов
PLITONIT Антифриз
PLITONIT АнтиМороз
PLITONIT Эстрих
PLITONIT СуперСтяжка
PLITONIT СуперСтена
PLITONIT ВодоПреграда
PLITONIT СуперБетон
Система выравнивания плитки (СВП)
Зажим PLITONIT PROFI
Клин PLITONIT PROFI
Щипцы регулируемые PLITONIT
Средства по уходу за плиткой
PLITONIT защитная пропитка для клинкера и натурального камня
PLITONIT средство для удаления цементного налета
PLITONIT очиститель эпоксидного налета
PLITONIT средство для очистки керамогранита и клинкера
PLITONIT защитная пропитка для керамогранита
PLITONIT средство для очистки межшовных затирок и натурального камня
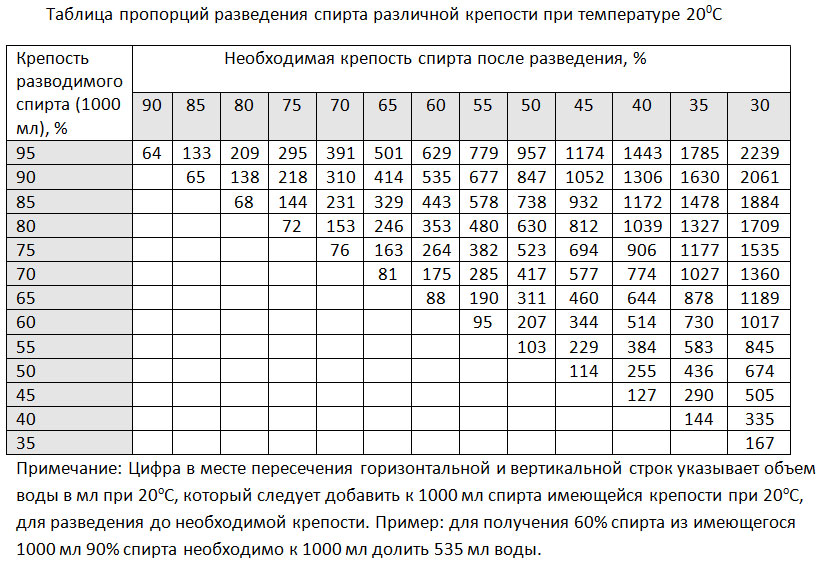
Как приготовить цементный раствор.
 Пропорции раствора
Пропорции раствораПропорции приготовления цементного раствора
Для того, чтобы определить марку цементного раствора необходимо марку цемента поделить на количество песка.
Как приготовить цементный раствор марки 100
Вариант 1:
1 (одно) ведро цемента марки 400 и 4 (четыре) ведра песка.
400 (марка цемента) / 4 ведра песка = 100 (марка готового цементного раствора).
Вариант 2:
1 (одно) ведро цемента марки 500 и 5 (пять) ведер песка.
500 (марка цемента) / 5 ведер песка = 100 (марка готового цементного раствора)
Как приготовить цементный раствор марки 200
1 ведро цемента марки 400 и 2 ведра песка.
400 (марка цемента) / 2 ведра песка = 200 (марка готового цементного раствора)
Для эластичности в полученные растворы можно добавить 50 – 100 гр моющего средства. Например, жидкого мыла.
Приготовление цементного раствора для кладки
Вода.
Для приготовления классического цементного раствора необходимо залить воды в мешалку. Нужно учесть, что при замесе песок должен быть сухой, иначе количество воды нужно будет заливать иное, для мокрого песка требуется меньшее количество воды. Если на 1 замес необходимо одно ведро цемента, то и воды тоже будет необходимо около одного ведра. Лучше залейте немного меньше нормы. Добавив в мешалку цемент и песок и видя конечную консистенцию, вы сами можете определить и добавить по необходимости остаточное количество воды.
Пластификаторы.
В цементный раствор после добавления воды добавляют пластификаторы (моющие средства, жидкое мыло) для повышения сцепления. (Полную статью о применении пластификаторов читайте в разделе Статьи).
Рекомендуется добавлять в мешалку приблизительно 50 – 100 гр моющего средства. Добавлять пластификаторы следуют после воды, чтобы оно успело хорошо раствориться. На это потребуется около 5 минут.
Добавлять пластификаторы следуют после воды, чтобы оно успело хорошо раствориться. На это потребуется около 5 минут.
Песок.
После растворения пластификатора в воде необходимо добавить песок. Первоначально добавляем половину необходимого конечного количества песка!
Цемент.
Добавляем цемент. Сразу все необходимое количество. Ждем около 3 минут, пока все компоненты смешаются.
Песок.
Добавляем остаточную часть песка. Ждем еще 5 минут для полного смешения компонентов. Если необходимо регулируем густоту раствора добавлением небольшого количества воды.
Применение и приготовление раствора при отрицательных температурах
Строительные работы по применению и использованию цементного раствора могут проводиться не только в летнее и теплое время года, но и при низких температурных условиях. Поэтому в данных условиях необходимо учитывать влияние мороза и холода на свойства раствора.
Основная проблема при приготовлении цементного раствора при низких температурных условиях — это замерзание песка. Поэтому нужно ответственно отнестись к хранению песка. Необходимо его предварительно занести в дом, здание, где есть крыша и отопление. Если такое невозможно (например, на больших стройках), то необходимо обеспечить нагревание песка.
Добавляя воду в раствор, необходимо предварительно ее нагреть, так лучше идет растворение моющего средства, в связи с чем улучшается эластичность раствора.
Для того, чтобы цементный раствор не замерзал на морозе, необходимо использовать незамерзающие добавки (незамерзайки). Наилучшим средством является поташ (углекислый калий). Он представляет собой соль калия и угольной кислоты. Второе его название — карбонат калия. Поташ известен давно, посколько смесь содержится в золе. В Древней Греции и Риме его выделяли из золы и использовали при стирке.
Компания ПРОДТОРГСЕРВИС предлагает ознакомиться с ценами на цементныные растворы в готовом виде в Чебоксарах.
неорганическая химия — Всегда ли замораживание раствора водой приводит к тому, что вода отделяется и образует ледяную решетку?
спросил
Изменено 7 месяцев назад
Просмотрено 5к раз
$\begingroup$
Мне любопытно, я пытался изучить эффект замораживания раствора с водой, даже если раствор полностью смешивается. Я наткнулся на что-то, в котором это подробно описывалось в отношении соленой воды, и в основном говорилось, что когда она становится достаточно низкой, чтобы замерзнуть, вода образует контрольную решетку, в основном выталкивая соли, поэтому сам лед представляет собой чистую воду и менее плотный (значительно менее плотный, потому что раствор соли позволял увеличивать плотность вплоть до пониженной температуры замерзания).
Мне любопытно, является ли это общим фактом поведения любого раствора с водой независимо от смешиваемости? Существуют ли водные растворы, которые разрушают решетку, но при этом допускают замерзание, или блокирование образования этой решетки полностью блокирует замерзание раствора, несмотря ни на что? Существуют ли водные растворы, которые замерзают даже с решеткой, не отделяя неводные соединения?
Примечание: я понимаю, что аморфный лед можно создать с помощью волшебства, но мой вопрос больше касается типичного поведения на Земле.
- неорганическая химия
- вода
- растворы
$\endgroup$
4
$\begingroup$
Очистка, происходящая при замораживании водного раствора, называется фракционной заморозкой и основана на идее, что примеси растворителя (а это может быть любой растворитель, а не только вода) имеют значительно меньшую растворимость в твердой фазе растворителя относительно жидкой фазы.

, которая показывает точку замерзания смесей вода/этанол в зависимости от содержания этанола. . В точке около 95% наблюдается значительное падение температуры замерзания. В этот момент, называемый точкой эвтектики, раствор ведет себя так, как будто он представляет собой один компонент (во многом как азеотроп), и вряд ли его можно будет разделить с помощью «простых» средств фракционного замораживания. Примечание. Я использую термин «простой», потому что азеотропы можно разделить с помощью специальных методов дистилляции.
Итак, в заключение: фракционное замораживание будет работать с любым водным раствором, независимо от смешиваемости компонентов, если соотношение компонентов не близко к эвтектической точке. Нам не нужно ограничиваться водными растворами, так как многие виды могут быть очищены таким образом. Механизм очистки зависит не столько от кристаллической решетки, сколько от относительной растворимости растворенного вещества в твердой и жидкой фазах растворителя. Наконец, многие водные растворы замерзают даже с примесями. Этот и другие типы разделения работают на равновесных процессах, и для «полного» удаления примесей необходимо несколько итераций. (или, правильнее, удалить примеси до уровня, приемлемого для вашего применения.)
Механизм очистки зависит не столько от кристаллической решетки, сколько от относительной растворимости растворенного вещества в твердой и жидкой фазах растворителя. Наконец, многие водные растворы замерзают даже с примесями. Этот и другие типы разделения работают на равновесных процессах, и для «полного» удаления примесей необходимо несколько итераций. (или, правильнее, удалить примеси до уровня, приемлемого для вашего применения.)
$\endgroup$
4
$\begingroup$
Ситуация, которую вы описываете, известна как эвтектическая система. Находится ли система в точке эвтектики, зависит как от материалов, составляющих раствор, так и от относительных количеств каждого из них. Растворы $\bf{A}$ и $\bf{B}$, не имеющие эвтектического состава, будут вымораживать один компонент до тех пор, пока не будет достигнут эвтектический состав. В то время как эвтектическая система затвердевает одновременно с обоими компонентами, многие системы замерзают в твердом состоянии $\bf{A}$ и в твердом состоянии $\bf{B}$ (оба перераспределены), а не в твердом состоянии $\bf{AB}$, хотя некоторые системы затвердевают как смешанные (металлические сплавы, например).
В то время как эвтектическая система затвердевает одновременно с обоими компонентами, многие системы замерзают в твердом состоянии $\bf{A}$ и в твердом состоянии $\bf{B}$ (оба перераспределены), а не в твердом состоянии $\bf{AB}$, хотя некоторые системы затвердевают как смешанные (металлические сплавы, например).
Вода и хлорид натрия образуют эвтектику при содержании около 23% $\ce{NaCl}$ по весу. Вы можете увидеть фазовую диаграмму для воды и $\ce{NaCl}$ на этой странице Университета Калгари. Обратите внимание, что эвтектика может состоять более чем из двух компонентов, как указано на странице Университета Калгари. Типичная фазовая диаграмма раствора $\ce{NaCl/h3O}$ показана ниже:
Примечание: Эвтектический состав составляет около 27% $\ce{NaCl}$ (по $w/v$) растворяется в воде (имейте в виду, что насыщенный раствор $\ce{NaCl}$ составляет около 30% при комнатной температуре).
$\endgroup$
5
$\begingroup$
Некоторые растворенные вещества, особенно под давлением, фактически включаются в структуру водяного льда с образованием клатратных гидратов . Из них наиболее известен гидрат метана, встречающийся в природе в океанах, где организмы вырабатывают метан под достаточным давлением для создания клатратной фазы. Эти иллюстрации из источника, указанного выше, показывают условия глубины и температуры океана, при которых образуются гидраты клатрата метана, и получающуюся в результате клатратную структуру.
Из них наиболее известен гидрат метана, встречающийся в природе в океанах, где организмы вырабатывают метан под достаточным давлением для создания клатратной фазы. Эти иллюстрации из источника, указанного выше, показывают условия глубины и температуры океана, при которых образуются гидраты клатрата метана, и получающуюся в результате клатратную структуру.
В клатратной фазе молекулы воды упакованы иначе, чем чистый водяной лед. В то время как структура обычного льда имеет много открытого пространства, требуется еще больше места для включения метана или других небольших молекул газа, и поэтому молекулы воды упакованы менее плотно, чтобы оставить отверстия для инородного материала.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
физическая химия — Можно ли использовать любое растворенное вещество для снижения точки замерзания воды?
спросил
Изменено 6 лет, 1 месяц назад
Просмотрено 3к раз
$\begingroup$
Допустим, я хочу понизить температуру замерзания воды на 5 градусов Цельсия. Я знаю, что для фиксированного объема воды мне потребуется $x$ молей растворенного вещества.
Поскольку понижение точки замерзания является коллигативным свойством, означает ли это, что я могу использовать любого растворенного вещества для снижения точки замерзания воды при условии сохранения моляльности раствора, или необходимо учитывать другие свойства растворенного вещества?
- физико-химия
- водный раствор
$\endgroup$
4
$\begingroup$
Суть в терминологии — подавитель точки замерзания должен быть растворенным веществом. Масло не подавит точку замерзания воды, потому что оно не растворяется. Небольшое количество хлорида натрия или этанола снижает температуру замерзания воды до -5°C.
Масло не подавит точку замерзания воды, потому что оно не растворяется. Небольшое количество хлорида натрия или этанола снижает температуру замерзания воды до -5°C.
Первое исключение — когда растворенное вещество перестает растворяться. Это называется эвтектической точкой. Например, в воде можно растворить только 23,3% NaCl (по массе). Эта смесь замерзнет при -21,1°C. После этого добавление большего количества соли не приведет к дальнейшему снижению точки замерзания.
Второе исключение касается крупных сумм. Если смешать воду и этанол в молярном соотношении 50/50, что будет больше растворителем, а что растворенным веществом? Вы можете рассчитать подавление точки замерзания каждого по отношению к другому, и они не будут совпадать. Смеси жидкость / жидкость также имеют эвтектические точки при минимальной температуре замерзания, которая ниже точки замерзания любого компонента.
Чтобы получить фактическую точку замерзания для неразбавленных систем, попробуйте выполнить поиск по запросам «твердое жидкое равновесие», «эвтектическая точка» или «бинарная фазовая диаграмма».