Блок силикатный размеры: Размеры газосиликатных блоков (таблица)
Блок газо-силикатный 25х10х60см | Анкор
- Описание
Описание
1,488 просмотров всего, 1 просмотров сегодня
Вы затеяли стройку или реконструкцию уже имеющегося жилья и задумались, о подходящем материале. Газосиликатные блоки, отзывы о которых, подтверждают их высокие технические характеристики, способны ускорить темпы строительства, обеспечить качественную, надежную кладку и сэкономить финансы. Стоит присмотреться к ним, внимательнее.
Современный, высокотехнологичный материал.
Газосиликатные блоки, изготавливаются из песка (кварцевого), извести, цемента, алюминиевой пудры. Перемешанные компоненты затворяются водой. В процессе химической реакции, образуется большое количество воздушных ячеек. Затвердевание материала происходит в специальной печи, под действием высоких температур (195°С) и давления (10 – 12 бар.). Техническое определение – ячеистый бетон, автоклавного твердения. Выпускается несколько разновидностей блоков, отличающихся размерами, характеристиками и назначением.
Выпускается несколько разновидностей блоков, отличающихся размерами, характеристиками и назначением.
Достоинства газосиликатных блоков.
Эта разновидность кладочного строительного материала, обладает достаточно высокими, качественными показателями, что позволяет газосиликатным блокам, набирать все большую популярность.
- Высокая теплоизоляция: водородистые пузырьки, полученные в полости блока, в результате химического процесса, имеют меньшую степень теплопроводности. Выделение тепла наружу, снижено. Минимальный размер швов, повышает показатели сохранности тепла.
- Уменьшение сроков строительства. Размеры и достаточно небольшой вес, многократно ускоряют стройку.
- Удобство применения. Блоки не доставляют трудностей в работе: легко режутся, распиливаются, сверлятся, монтируются.
- Улучшенные геометрические показатели. Размер и формация материала, предполагает получение гладкой, ровной поверхности, при минимуме усилий по подгонке.
- Огнеупорность.
 Запас прочности при пожаре – около 4 часов.
Запас прочности при пожаре – около 4 часов. - Экологическая безопасность. Полностью натуральные компоненты блоков, не содержат вредных веществ, способных принести вред здоровью. Даже горение, не сопровождается выделением едких соединений.
Недостатки
Чтобы получить полностью объективную картину, необходимо разобраться и с отрицательными качествами газосиликатных блоков.
- Необходимость заливки монолитного, ленточного фундамента, даже для среднего, одноэтажного дома. У газосиликатных блоков слабый запас гибкости, при неустойчивом, подверженном усадке основании, весь объект «пойдет трещинами».
- Для крепления, требуются специальные, ощутимой стоимости, приспособления, увеличивающие финансовые затраты.
- Большая, влагопоглощающая способность. Не рекомендуется возведение построек, без дополнительной защиты. Поверхность можно периодически пропитывать влагостойкими растворами, или провести фасадную отделку. Хотя производителем заявлено отсутствие, необходимости дополнительной, финишной отделки, все эксплуатационные характеристики и декоративные показатели, станут высокими, именно, после проведения таких работ.

Клей для кладки газосиликатных блоков.
Для кладочных работ с газосиликатными блоками, не применяется обычный, цементный раствор. Используется клей, представляющий собой готовую, сухую смесь, состоящую из цемента, песка и различных, полимерных добавок. Добавки обеспечивают пластичность клеевого раствора, его технические характеристики. Он морозостоек, влагостоек, обладает высокой адгезией к поверхности.
Силикаты-Типы-Классификация-Примеры-Структура-Формула-Орто-Пиро-Циклическая-Цепь-текто
Силикаты — это минералы, содержащие кремний и кислород в тетраэдрических единицах SiO 4 4- , которые связаны друг с другом в нескольких узорах. В зависимости от способа соединения тетраэдрических блоков силикаты подразделяются на следующие типы.
Ортосиликаты (или силикаты Neso или Island) — простейшие силикаты, содержащие дискретный SiO 4 4- тетраэдрические единицы.
основной структурный
единица ортосиликатной единицы показана ниже.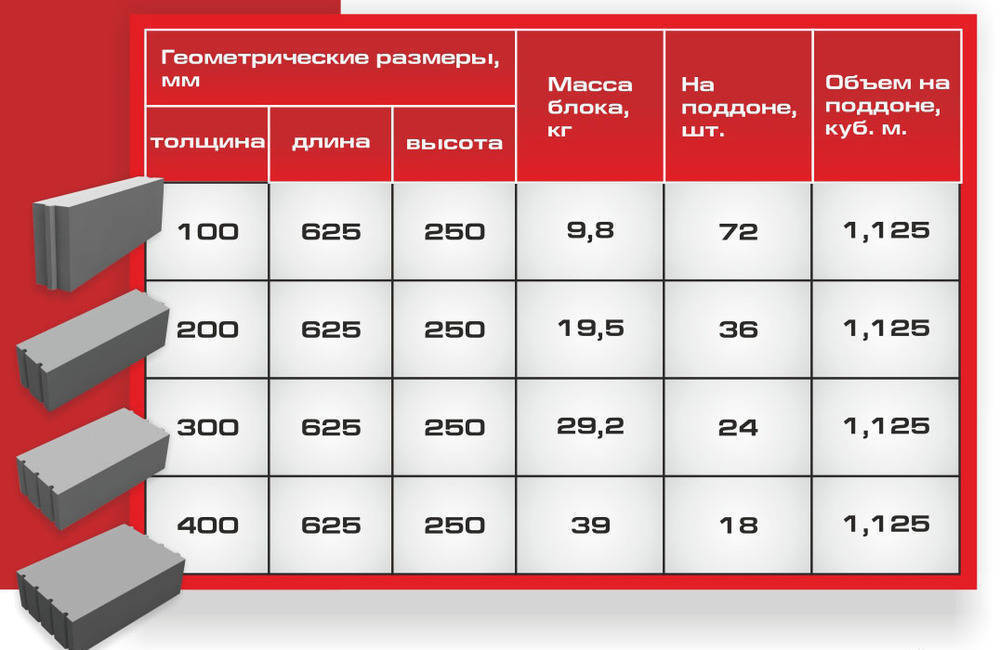
Ион ортосиликата представляет собой сильное сопряженное основание слабой ортокремниевой кислоты. а также он не будет сохраняться в водных растворах. Следовательно, в природе орто силикатные минералы встречаются редко и встречаются только с катионами, образующими сильно нерастворимые соли.
1) Фенакит (также известный как фенакит) — Be 2 SiO 4
2) Виллемит — Zn 2 SiO 4 — Мелкая силикатная руда цинка. Сильно флуоресцентный (зеленый) в коротковолновом УФ.
Примечание: Ионы Be 2+ и Zn 2+ тетраэдрически окружены атомами кислорода силиката.
3) Оливин — (Fe/Mg) 2 SiO 4 : Обычно зеленого цвета. Катионы октаэдрически координированы с атомами кислорода силиката.
4) Циркон — ZrSiO 4 : Древнейший минерал на Земле. Координационное число Zr 4+ равно 8.
Пиросиликат (или силикат Соросиликата, или дисиликат) содержат Si  Структура пиросиликата показана ниже.
Структура пиросиликата показана ниже.
Ион пиросиликата является менее основным, чем ион ортосиликата. Там только один Минерал в природе, содержащий пиросиликат-ион.
Напр. 1) ThortveItite — SC 2 SI 2 O 7
Циклические силикаты содержат (SIO
1) Бенитоит — BaTi(SiO 3 ) 3 : содержит три тетраэдра, расположенных циклически [Си 3 О 9 ) 6-].
2) Берилл — Be 3 Al 2 (SiO 3 ) 6 : содержащие шесть силикатных колец
[Si 6 O 18 ) 12-]. Это алюмосиликат. Каждый алюминий окружен 6 атомами кислорода
восьмигранный. Хорошо известные разновидности берилла включают изумруд и
Аквамарин.
Цепные силикаты или пироксены содержат (SiO 3 ) n 2n- ионов, которые образуются путем линейного соединения «n» тетраэдрических единиц SiO 4 4- единиц. Каждая единица разделяет два атома кислорода с другими единицами.
Примеры цепочечных силикатов:
1) Сподумен — LiAl(SiO 3 ) 2 — пироксеновый минерал, состоящий из иносиликата лития-алюминия
2) Диопсит — CaMg(SiO 3 ) 2
3) Волластонит — Ca
Примечание. Формула циклических силикатов, а также цепочечных силикатов: (SiO 3 ) n 2n-. Следовательно, они рассматриваются как олигомеры неизвестного SiO 3 2- ион.
youtube.com/embed/0qbqLjIeNB0″ frameborder=»0″ allow=»autoplay; encrypted-media» allowfullscreen=»»/> Общая формула силикатов с двойной цепью (или амфиболов) : (Si
1) Асбест — это негорючие волокнистые силикаты. Они использовались в качестве теплоизоляционного материала, тормозных накладок, строительных материалов и фильтров. Это канцерогенные амфиболы, поражающие легкие. Следовательно, их применение в настоящее время ограничено.
2) Тремолит — Ca 2 Mg 5 (Si 4 O 11 ) 2 (OH) 2
900: иносиликаты.
Общая формула Sheet или Phyllo или двумерные (2-D) силикаты is (Si 2
 Эти силикаты легко расщепляются, как и графит.
слои удерживаются вместе слабыми силами Ван-дер-Ваальса.
Эти силикаты легко расщепляются, как и графит.
слои удерживаются вместе слабыми силами Ван-дер-Ваальса.1) Тальк — Mg 3 Si 4 O 10 (OH) 2 : Это основной ингредиент мыльного камня. Это самый мягкий материал с гладким и жирным прикосновением.
2) MicaS: Общая формула — x 2 y 4–6 z 8 O 20
Где x = k, Na или CA
y = Al, Mg или Fe
Z = Si или Al
Напр. Мусковитовая слюда — KAl 2 (AlSi 3 O 10 )(F,OH) 2 — очень легко расщепляется на тонкие слои
и лепидолит — KLi 2 Al(Al,Si) 3 O 10 (F,OH) 2
3) Глина: это алюмосиликат с листовой структурой.
4) Каолинит — AlSiO 5 (OH) 5
Общая формула трехмерных (3-D) или текто или каркасных силикатов : (SiO 90 0 9 0 9 0 0 0 0 6 9 0 0 0 6 Все атомы кислорода SiO 4 являются общими с другими тетраэдрами и, таким образом, образуют трехмерную сеть.
SiO 2 — Кварц, тридимит и кристобалит — это кристаллические формы кремнезема.
При замене звеньев SiO 4 4- на звенья AlO 4 5- образуются трехмерные алюмосиликаты .
Полевой шпат, цеолиты, ульта и т. д.,
НЕСКОЛЬКО ВАЖНЫХ ЗАМЕЧАНИЙ О СИЛИКАТАХ
* Силикатные минералы очень распространены в земной коре, так как кислород и Кремний является наиболее распространенным элементом.
* Степень полимеризации обозначается преобразованием кислорода в кремний. отношение (O/Si). Чем выше степень полимеризации, тем ниже будет отношение O/Si соотношение. Значения O/Si для ортосиликатов (неполимеризованных) = 4:1 в то время как для тектосиликатов (наиболее полимеризованный силикат) = 2:1.
* С увеличением степени полимеризации снижается
заряд на атом кремния, а также основность силикатного минерала. Действительно,
диоксид кремния (SiO 2 )
является кислотным оксидом.
* Основные силикатные минералы легко реагируют со слабыми кислотами и выветривание.
НАЖМИТЕ ЗДЕСЬ, ЧТОБЫ ПОЛУЧИТЬ КЛЮЧИ ДЛЯ СЛЕДУЮЩИХ ВОПРОСЫ
Вопрос-1) Какое утверждение о силикатах НЕ верно?
а) Основной единицей силикатов является SiO 4 4- . При этом кремний 4-координирован с атомами кислорода тетраэдрически.
б) Асбест является амфиболом силикат.
c) Тальк и слюда являются примерами силикатов с цепочечной структурой.
г) Цеолиты представляют собой алюмосиликаты.
e) Некоторые силикаты содержат дискретные молекулярные ионы.
Указание: Тальк и слюда представляют собой листовые или филлосиликаты.
Вопрос-2) (SiO 3 ) n 2n- может быть эмпирической формулой:0009
г) оба a & c
Вопрос-3) Общая формула силикат-иона представляет циклические силикаты IS:
A) SIO 4 4-
B) SI 2 O 5 2-
C) SI 2 O 7 6-
D) (SiO 3 ) n 2n-
Вопрос-4) Какое из следующих утверждений НЕ верно?
а) Глина представляет собой алюмосиликат листовой структуры.
б) Через три размерные алюмосиликаты, SiO 4 4- заменяется на AlO 4 5- шт.
в) В тектосиликаты, все атомы кислорода в тетраэдрах SiO 4 являются общими.
г) Кварц представляет собой филлосиликат.
Вопрос-5) Слоистые силикатные структуры в глинах состоят из следующих группа.
а) SiO 4 4-
B) SI 2 O 5 2-
C) SI 2 O 7 6-
D)
Вопрос-6) Амфиболовые силикатные минералы состоят из
а) одиночных тетраэдров кремния
б) цепочек тетраэдров кремнезема
в) двойные цепи тетраэдров кремнезема
г) листы тетраэдров кремнезема
Вопрос-7) Что из следующего верно относительно ионного обмена на алюмосиликаты?
а) Na + сорбируется сильнее, чем К +
б) Са 2+ сорбируется слабее сильно, чем Na +
в) NO 3 — сорбируется сильнее, чем Na +
г) сорбируется Al 3+ сильнее, чем Mg 2+
Объяснение: Чем больше плотность заряда, тем больше сорбция. А вы знаете, что плотность заряда обратно пропорциональна радиусу. Больше
заряд и чем меньше радиус, тем выше плотность заряда.
А вы знаете, что плотность заряда обратно пропорциональна радиусу. Больше
заряд и чем меньше радиус, тем выше плотность заряда.
Вопрос-8) Beryl, BE 3 AL 2 SI 6 O 18 IS:
A) Ортосиликатный
B) Pyrosilicate
C) Цикликат
D) A) A Pyrosilicate
C) a-цикликат
D) A) a Pyrosilicate
C) a-цикликат
D). Нет
Не подсказка!: Изумруд и аквамарин – это драгоценные формы берилла.
Вопрос-9) Какое из следующих утверждений верно для амфибола? силикаты?
а) Эмпирическая формула [(SiO 3 ) 2- ] n
b) Существует два типа тетраэдры: те, что имеют 3 вершины, и те, что имеют 2 вершины.
c) Есть только один тип тетраэдров.
D) Эмпирическая формула составляет [((SI 4 O 11 ) 6-] N
Вопрос-10) Формула пирозиликатного иона:
A) SIO 4 4-
б) Si 3 O 9 2-
C) SI 2 O 7 6-
D) SI 6 O 18 12-
Вопрос-11) В нормальных силикатах, каждый атом силикона окружен
В Нормальных силикатах. Каждый атом силикона окружен
Каждый атом силикона окружен
В нормальных силикатах. В нормальных силикатах. Каждый силикон окружен
. В нормальных силикатах. В нормальных силикатах. В нормальных силикатах. В нормальных силикатах. В нормальных силикатах. В нормальных силиковых
а) пять атомов кислорода в тригонально-бипирамидальной геометрии
б) четыре атома кислорода в плоской квадратной геометрии
c) четыре атома кислорода в тетраэдрическая геометрия
г) шесть атомов кислорода в октаэдрической геометрии
Вопрос-12) Что из следующего является примером циклического силикат?
A) Spodumene
B) Olivine
C) Beryl
D) Асбест
Вопрос-13) Эмпирическая формула с двойной цепью силикатов:
A) SIO 4 4-
B). ) SI 3 O 9 2-
C) SI 2 O 7 6-
D) (SI 4 O 11 ) n 6n-
Вопрос-14) Силикаты, в которых три атома кислорода вершинами тетраэдров являются:
а) амфиболы
б) пироксены
в) филлосиликаты
г) пиросиликаты
а) 2 : 4
б) 1 : 4
в) 2 : 5
г) 1 : 5
16) Какой из перечисленных минералов лития относится к пироксеновому типу силикатный состав?
a) Лепидолит
b) Сподумен
c) Петалит
d) Нет
17) Формула циклического силиката, в которой 6 тетраэдров Устроено циклически:
A) Si 6 O 18 12-
B) SI 6 O 18 6-
C) SI 6 O 6
C) SI 6 6000 6. 0007 2-
0007 2-
d) Si 6 O 18 6-
18) В каких из перечисленных силикатов имеется два типа SiO 4 тетраэдры: те, что имеют 3 общие вершины, и те, что имеют 2 общие вершины.
а) Пироксены
б) Филлосиликаты
в) Амфиболы
г) Текто силикаты
19) Число атомов кислорода, участвующих в делении [Si 3 O 9 ] 6-
а) 2
б) 3
в) 6
г) 4
20) Среди полевого шпата, мусковитовой слюды и цеолита,
2 а) силикатов трехмерных цеолит трехмерный, а мусковит слюда слоистая
в) полевой шпат трехмерный, а цеолит и мусковит слюда слоистая
d) все слоистые силикаты
21) Общий заряд циклического силикатного аниона [Si 6 О 18 ] n- is:
а) 24
б) 12
в) 18
г) 6
22) Силикатный минерал с более низкой степенью полимеризации Среди следующего:
1) Грунерит — FE 7 SI 8 O 22 (OH) 2
2) Pyrophyllite, Al 2 SI 4 O 10 (OH) 2
3) Тальк-Mg 3 Si 4 O 10 (OH) 2
4) Тремолит — CA 2 мг 5 (SI 4 O 11 ) 2 (OH) 2
Hint: Большое /Si отношение ниже степени
полимеризации.
23) Что из перечисленного не является ортосиликатом?
a) фенакит
b) оливин
c) оливин
d) берилл
24) BaTi[Si 3 O 9 : 9 класс]0009
а) ортосиликат
б) циклический силикат
в) цепочечный силикат
г) листовой силикат
25) Какие из перечисленных силикатов имеют трехмерную структуру?
1) NESO
2) Phyllo
3) SORO
4) Tecto
26) Значение N в молекулярной формуле составляет N AL 2 SI 6 . это:
а) 3
б) 4
в) 6
г) 8
27) Основная структурная единица полевошпатовой цеолитовой слюды и Асбест:
A) SIO 4 4-
B) SIO 2
C) (R 2 SIO) N
D) (SIO 3 ) N
D) (SIO 3 ) N
D) (SIO 3 ) N
D) (SIO 3 ) N
D) (SIO 3 ) 2n-
28) Thortvetite, SC 2 SI 2 O 7 IS:
A) Pyrosilicate
B) Ортосиликатный
C) Силикат листа
B) Ортосиликат
C) лист
. 0009
0009г) ан амфибол
29) Что из следующего неверно относительно анионной единицы пиросиликат?
а) Он имеет один кислород, разделенный между двумя SiO 4 тетраэдры.
б) Имеет три тетраэдра SiO 4 , соединенных циклически.
в) Он имеет основную природу и поэтому легко реагирует со слабыми кислотами.
d) Отношение O/Si составляет 3,5:1.
30) Силикат, содержащий по одному одновалентному угловому атому кислорода в каждом единица тетраэдра:
а) Циклический силикат.
б) Филлосиликат.
в) Амфиболы.
г) ортосиликаты.
31) Какой тип силикатных минералов показан на этой схеме силикатных тетраэдров?
а) Ортосиликаты.
b) Циклический силикат.
c) Каркасный силикат.
г) Филлосиликат.
32) Какие из следующих силикатов относятся к пироксенам?
а) Силикаты с одной цепью.
б) Филлосиликат.
в) Тектосиликаты.
d) Силикаты с двойной цепью.
33) Минералы слюды, такие как мусковит, флогопит и биотит, некоторые камни сверкают, так как они очень легко разбиваются на тонкие параллельные пластины плоские поверхности, которые отражают свет. Причина:
1) Это ортосиликаты, содержащие дискретные единицы SiO 4 2- тетраэдры.
2) Каркасные силикаты.
3) Это филлосиликаты со слоями, удерживаемыми вместе сильными силами Ван дер Ваала.
4) Это филлосиликаты со слоями, удерживаемыми вместе слабыми силами Ван-дер-Вааля.
34) Единицы Si 4+ в полевых шпатах:
1) CA 2+
2) NA +
3) AL 3+
4) K +
35) Название структуры силикатов, в которой три кислорода атомы SiO 4 4- являются общими:
1) пирозиликаты
2) Пироксены
3) Тектозиликаты
4) Амфиболы
36) Тип силиката, присутствующего в силикате берил. 2 [Си 6 О 18 ] is :
1) соросиликат
2) циклосиликат с шестью звеньями
3) листовой силикат
4) циклосиликат с тремя звеньями
37) Сколько атомов кислорода в SiO 4 4- шт. являются общими в непрерывном трехмерном каркасе силикатов?
являются общими в непрерывном трехмерном каркасе силикатов?
1) 2
2) 3
3) 4
4) 1
38) Берилл – это силикат. Его анионная часть содержит [Si n O 3n ] 12-, тогда значение n равно:
1) 3
2) 6
3) 9
4) 18
39) Назовите тип строения силиката, в котором атом кислорода SiO 4 4- используется совместно:
1) Несосиликат
2) Соросиликат
3) Филлосиликат
4) Тектосиликат
40) Кремнезем представляет собой сетчатое твердое вещество с Si-Si связью. Во многих алюмосиликатах, несколько атомов Si в структуре кремнезема заменены атомами Al. Цеолиты, глины, асбест и т. д. являются примерами алюмосиликатов. имеющие разную структуру. Неверным является утверждение: (NEST 2017)
(A) Основной структурной единицей силикатов является тетраэдрическая (SiO 4 ) 4− .
(B) Результат замены атома Si в кремнеземе на атом Al
отрицательно заряжены на атоме Al.
(C) Кремнезем растворяется в водном растворе NaOH с образованием силиката натрия в котором Na + связан с оксианионами.
(D) Силиконы являются примерами силикатов.
41) Наиболее вероятная геометрия силикатного блока: (NEST 2012)
(A) квадратный плоский.
(В) квадратно-пирамидальный.
(С) октаэдрический.
(D) тетраэдрический
42) Синий египетский CaCuSi 4 O 10 пример из:
A) листовой силикат
B) циклический силикат
C) пиросиликат
D) цепной силикат
соответственно: (CSIR NET JUNE 2012 Solved — AdiChemistry)
1) Алюмофосфат и риформинг
2) Алюмосиликат и крекинг
3) Алюмосиликат и риформинг
4) Алюмофосфат и крекинг.
44) Виды, образующиеся в результате замены одной четверти Si(IV) в пирофиллит [Al2(OH)2Si4O10] с Al(III) Баланс заряда по K(I)] составляет (CSIR NET JUNE 2019 Solved — AdiChemistry)
(1) Московит
(2) Флогопит
(3) Монтмориллонит
(4) Тальк
Вопрос-45) силикаты с непрерывным трехмерным каркасом известны как:
(1) Тектозиликаты
(2) Амфиболы
(3) Пироксены
(4) Циклические силикаты
Ответ: 1
2.
 4 Силикатные минералы — Физическая геология
4 Силикатные минералы — Физическая геология.
Подавляющее большинство минералов, слагающих горные породы земной коры, относятся к силикатным минералам. К ним относятся такие минералы, как кварц, полевой шпат, слюда, амфибол, пироксен, оливин и большое разнообразие глинистых минералов. Строительным элементом всех этих минералов является кремнеземный тетраэдр , комбинация четырех атомов кислорода и одного атома кремния. Они расположены так, что плоскости, проведенные через атомы кислорода, образуют тетраэдр (рис. 2.6). Поскольку ион кремния имеет заряд +4, а каждый из четырех ионов кислорода имеет заряд -2, тетраэдр кремнезема имеет суммарный заряд -4.
В силикатных минералах эти тетраэдры устроены и связаны друг с другом различными способами, от одиночных блоков до сложных каркасов (рис. 2.9). Простейшая силикатная структура, у минерала оливин состоит из изолированных тетраэдров, связанных с ионами железа и/или магния. В оливине заряд -4 каждого тетраэдра кремнезема уравновешивается двумя двухвалентными (т. е. +2) катионами железа или магния. Оливин может быть либо Mg 2 SiO 4 , либо Fe 2 SiO 4 , либо их комбинацией (Mg, Fe) 2 SiO 4 . Двухвалентные катионы магния и железа довольно близки по радиусу (0,73 против 0,62 ангстрем [1] ). Из-за сходства размеров и того, что они оба являются двухвалентными катионами (оба имеют заряд +2), железо и магний могут легко заменять друг друга в оливине и многих других минералах.
е. +2) катионами железа или магния. Оливин может быть либо Mg 2 SiO 4 , либо Fe 2 SiO 4 , либо их комбинацией (Mg, Fe) 2 SiO 4 . Двухвалентные катионы магния и железа довольно близки по радиусу (0,73 против 0,62 ангстрем [1] ). Из-за сходства размеров и того, что они оба являются двухвалентными катионами (оба имеют заряд +2), железо и магний могут легко заменять друг друга в оливине и многих других минералах.
| Тетраэдрическая конфигурация | Пример Минералы | |
|---|---|---|
| Изолированный (несиликаты) | Оливин, гранат, циркон, кианит | |
| Пары (соросиликаты) | Эпидот, цоизит | |
| Кольца (циклосиликаты) | Турмалин | |
| Одинарные цепи (иносиликаты) | Пироксены, волластонит | |
| Двойные цепи (иносиликаты) | Амфиболы | |
| Листы (филлосиликаты) | Слюды, глинистые минералы, серпентин, хлорит | |
| Трехмерная структура | Каркас (тектосиликаты) | Полевые шпаты, кварц, цеолит |
Упражнение 2. 3 Создание тетраэдра
3 Создание тетраэдра
Вырежьте фигуру снаружи (сплошные линии и пунктирные линии), а затем согните по сплошным линиям, чтобы получился тетраэдр.
Если у вас есть клей или скотч, прикрепите выступы к тетраэдру, чтобы скрепить его. Если у вас нет клея или скотча, сделайте надрез по тонкой серой линии и вставьте заостренный язычок в прорезь.
Если вы делаете это в классе, попробуйте соединить свой тетраэдр с другими в пары, кольца, одинарные и двойные цепочки, листы и даже трехмерные каркасы.
В оливине, в отличие от большинства других силикатных минералов, тетраэдры кремнезема не связаны друг с другом. Однако они связаны с железом и/или магнием, как показано на рис. 2.10.
Рис. 2.10 Изображение структуры оливина, вид сверху. Формула для этого конкретного оливина, в котором на каждый ион Mg приходится три иона Fe, может быть записана так: Mg0,5Fe1,5SiO4. Как уже отмечалось, ионы +2 железа и магния имеют сходные размеры (хотя и не совсем одинаковые). Это позволяет им замещать друг друга в некоторых силикатных минералах. На самом деле обычные ионы в силикатных минералах имеют широкий диапазон размеров, как показано на рис. 2.11. Все показанные ионы являются катионами, кроме кислорода. Обратите внимание, что железо может существовать как в виде иона +2 (если оно теряет два электрона во время ионизации), так и в виде иона +3 (если оно теряет три). Fe 2+ известен как железо железо. Fe 3+ известен как трехвалентное железо . Ионные радиусы имеют решающее значение для состава силикатных минералов, поэтому мы снова обратимся к этой диаграмме.
Это позволяет им замещать друг друга в некоторых силикатных минералах. На самом деле обычные ионы в силикатных минералах имеют широкий диапазон размеров, как показано на рис. 2.11. Все показанные ионы являются катионами, кроме кислорода. Обратите внимание, что железо может существовать как в виде иона +2 (если оно теряет два электрона во время ионизации), так и в виде иона +3 (если оно теряет три). Fe 2+ известен как железо железо. Fe 3+ известен как трехвалентное железо . Ионные радиусы имеют решающее значение для состава силикатных минералов, поэтому мы снова обратимся к этой диаграмме.
Структура одноцепочечного силиката пироксена показана на рисунках 2.12 и 2.13. В пироксене тетраэдров кремнезема связаны друг с другом в единую цепь, где один ион кислорода из каждого тетраэдра является общим с соседним тетраэдром, поэтому в структуре меньше атомов кислорода. В результате отношение кислорода к кремнию ниже, чем в оливине (3:1 вместо 4:1), а суммарный заряд на атом кремния меньше (–2 вместо –4), поскольку требуется меньше катионов. чтобы сбалансировать этот заряд. Составы пироксена относятся к типу MgSiO 3 , FeSiO 3 и CaSiO 3 или их комбинация. Пироксен также может быть записан как (Mg,Fe,Ca)SiO 3 , где элементы в скобках могут присутствовать в любой пропорции. Другими словами, пироксен имеет по одному катиону на каждый тетраэдр кремнезема (например, MgSiO 3 ), а оливин — два (например, Mg 2 SiO 4 ). Поскольку каждый ион кремния равен +4, а каждый ион кислорода равен -2, три атома кислорода (-6) и один кремний (+4) дают суммарный заряд -2 для одной цепи тетраэдров кремнезема. В пироксене один двухвалентный катион (2+) на тетраэдр уравновешивает этот заряд -2. В оливине требуется два двухвалентных катиона, чтобы уравновесить заряд -4 изолированного тетраэдра.
В результате отношение кислорода к кремнию ниже, чем в оливине (3:1 вместо 4:1), а суммарный заряд на атом кремния меньше (–2 вместо –4), поскольку требуется меньше катионов. чтобы сбалансировать этот заряд. Составы пироксена относятся к типу MgSiO 3 , FeSiO 3 и CaSiO 3 или их комбинация. Пироксен также может быть записан как (Mg,Fe,Ca)SiO 3 , где элементы в скобках могут присутствовать в любой пропорции. Другими словами, пироксен имеет по одному катиону на каждый тетраэдр кремнезема (например, MgSiO 3 ), а оливин — два (например, Mg 2 SiO 4 ). Поскольку каждый ион кремния равен +4, а каждый ион кислорода равен -2, три атома кислорода (-6) и один кремний (+4) дают суммарный заряд -2 для одной цепи тетраэдров кремнезема. В пироксене один двухвалентный катион (2+) на тетраэдр уравновешивает этот заряд -2. В оливине требуется два двухвалентных катиона, чтобы уравновесить заряд -4 изолированного тетраэдра.
Структура пироксена более «разрешительная», чем у оливина — это означает, что в нее могут вписаться катионы с более широким диапазоном ионных радиусов. Вот почему пироксены могут иметь катионы железа (радиус 0,63 Å), магния (радиус 0,72 Å) или кальция (радиус 1,00 Å).
Рисунок 2.12 Изображение структуры пироксена. Тетраэдрические цепочки продолжаются влево и вправо, и каждая из них перемежается серией двухвалентных катионов. Если это ионы Mg, то формула будет MgSiO3. Часть единой цепочки тетраэдров (справа), где атомы кислорода в соседних углах являются общими для двух тетраэдров (стрелки). Для очень длинной цепи результирующее отношение кремния к кислороду составляет 1:3 (SiO3).Упражнение 2.4 Недостаток кислорода
На приведенной ниже диаграмме представлена одна цепь в силикатном минерале. Подсчитайте количество тетраэдров по сравнению с количеством ионов кислорода (желтые сферы). Каждый тетраэдр имеет один ион кремния, поэтому это должно давать отношение Si к O в одноцепочечных силикатах (например, в пироксене).
На приведенной ниже диаграмме представлена двойная цепь в силикатном минерале. Снова посчитайте количество тетраэдров по сравнению с количеством ионов кислорода. Это должно дать вам отношение Si к O в силикатах с двойной цепью (например, амфибол).
В структурах амфибола тетраэдры кремнезема связаны в двойную цепь, которая имеет более низкое отношение кислорода к кремнию, чем у пироксена, и, следовательно, для балансировки заряда требуется еще меньше катионов. Амфибол еще более снисходителен, чем пироксен, и его состав может быть очень сложным. Роговая обманка, например, может включать натрий, калий, кальций, магний, железо, алюминий, кремний, кислород, фтор и ион гидроксила (OH —).
В структурах слюды тетраэдры кремнезема расположены в виде непрерывных слоев, где каждый тетраэдр разделяет три аниона кислорода с соседними тетраэдрами. Между соседними тетраэдрами еще больше кислорода распределяется между соседними тетраэдрами, и, следовательно, для слоистых силикатных минералов требуется меньше катионов, уравновешивающих заряд. Связь между листами относительно слабая, чем и объясняется хорошо развитая однонаправленная спайность (рис. 2.14). Слюда Biotite может содержать железо и/или магний, что делает ее ферромагнезиальный силикатный минерал (например, оливин, пироксен и амфибол). Хлорит — еще один подобный минерал, обычно содержащий магний. В слюде мусковита присутствуют только катионы алюминия и калия; следовательно, это неферромагнезиальный силикатный минерал.
Связь между листами относительно слабая, чем и объясняется хорошо развитая однонаправленная спайность (рис. 2.14). Слюда Biotite может содержать железо и/или магний, что делает ее ферромагнезиальный силикатный минерал (например, оливин, пироксен и амфибол). Хлорит — еще один подобный минерал, обычно содержащий магний. В слюде мусковита присутствуют только катионы алюминия и калия; следовательно, это неферромагнезиальный силикатный минерал.
Кроме мусковита, биотита и хлорита существует множество других пластинчатых силикатов (или филлосиликатов ), которые обычно существуют в виде обломков размером с глину (т. е. менее 0,004 мм). К ним относятся глинистые минералы каолинит , иллит , и смектит , и хотя их трудно изучать из-за их очень малых размеров, они являются чрезвычайно важными компонентами горных пород и особенно почв.
е. менее 0,004 мм). К ним относятся глинистые минералы каолинит , иллит , и смектит , и хотя их трудно изучать из-за их очень малых размеров, они являются чрезвычайно важными компонентами горных пород и особенно почв.
Все листовые силикатные минералы также имеют в своей структуре воду.
Тетраэдры кремнеземасвязаны в трехмерные каркасы как из полевого шпата , так и из кварца . Это нежелезомагнезиальные минералы — они не содержат ни железа, ни магния. Помимо тетраэдров кремнезема, полевые шпаты включают катионы алюминия, калия, натрия и кальция в различных сочетаниях. Кварц содержит только тетраэдры кремнезема.
Тремя основными минералами полевого шпата являются калиевый полевой шпат (также известный как K-полевой шпат или K-шпат) и два типа плагиоклазового полевого шпата: альбит (только натрий) и анортит (только кальций). Как и в случае железа и магния в оливине, существует непрерывный диапазон составов (ряд твердых растворов) между альбитом и анортитом в плагиоклазе. Это связано с тем, что ионы кальция и натрия почти идентичны по размеру (1,00 Å против 0,99 Å). Любые промежуточные композиции между CaAl 2 Si 3 O 8 и NaAlSi 3 O 8 может существовать (рис. 2.15). Это немного удивительно, потому что, хотя ионы кальция и натрия очень похожи по размеру, они имеют разный заряд (Ca 2+ по сравнению с Na+). Эта проблема решается соответствующей заменой Si 4+ на Al 3+ . Таким образом, альбит – это NaAlSi 3 O 8 (один Al и три Si), а анортит – CaAl 2 Si 2 O 8 (два Al и два Si), а плагиоклазовые полевые шпаты промежуточного состава имеют промежуточный состав. соотношения Al и Si. Это называется «связанная замена».
Как и в случае железа и магния в оливине, существует непрерывный диапазон составов (ряд твердых растворов) между альбитом и анортитом в плагиоклазе. Это связано с тем, что ионы кальция и натрия почти идентичны по размеру (1,00 Å против 0,99 Å). Любые промежуточные композиции между CaAl 2 Si 3 O 8 и NaAlSi 3 O 8 может существовать (рис. 2.15). Это немного удивительно, потому что, хотя ионы кальция и натрия очень похожи по размеру, они имеют разный заряд (Ca 2+ по сравнению с Na+). Эта проблема решается соответствующей заменой Si 4+ на Al 3+ . Таким образом, альбит – это NaAlSi 3 O 8 (один Al и три Si), а анортит – CaAl 2 Si 2 O 8 (два Al и два Si), а плагиоклазовые полевые шпаты промежуточного состава имеют промежуточный состав. соотношения Al и Si. Это называется «связанная замена».
Плагиоклазовые полевые шпаты среднего состава представляют собой олигоклаз (от 10% до 30% Са), андезин (от 30% до 50% Са), лабрадорит (от 50% до 70% Са) и битовнит (от 70% до 90% Са). калиевый полевой шпат (KAlSi 3 O 8 ) имеет немного другую структуру, чем структура плагиоклаза, из-за большего размера иона калия (1,37 Å), и из-за этого большого размера калий и натрий не легко заменяют друг друга, за исключением высоких температур. Эти высокотемпературные полевые шпаты, вероятно, можно найти только в вулканических породах, потому что интрузивные магматические породы достаточно медленно охлаждаются до низких температур, чтобы полевые шпаты перешли в одну из более низкотемпературных форм.
калиевый полевой шпат (KAlSi 3 O 8 ) имеет немного другую структуру, чем структура плагиоклаза, из-за большего размера иона калия (1,37 Å), и из-за этого большого размера калий и натрий не легко заменяют друг друга, за исключением высоких температур. Эти высокотемпературные полевые шпаты, вероятно, можно найти только в вулканических породах, потому что интрузивные магматические породы достаточно медленно охлаждаются до низких температур, чтобы полевые шпаты перешли в одну из более низкотемпературных форм.
В кварце (SiO 2 ) , тетраэдры кремнезема связаны в «идеальный» трехмерный каркас. Каждый тетраэдр связан с четырьмя другими тетраэдрами (с кислородом, общим в каждом углу каждого тетраэдра), и в результате отношение кремния к кислороду составляет 1:2. Поскольку один катион кремния имеет заряд +4, а два аниона кислорода имеют заряд -2, заряд уравновешен.

 Запас прочности при пожаре – около 4 часов.
Запас прочности при пожаре – около 4 часов.